产丙酮酸氧化酶重组大肠杆菌的发酵过程质粒稳定性研究
2015-06-15王永红张嗣良庄英萍
赵 劼,王永红,储 炬,张嗣良,庄英萍
(华东理工大学 生物工程学院,上海 200237)
丙酮酸氧化酶(EC1.2.3.3)是一种十分重要的医用试剂酶.在PO4-3和O2存在条件下,它能够催化丙酮酸脱羧产生H2O2,CO2和乙酰磷酸[1].在过氧化物酶的共同作用下,丙酮酸氧化酶可以用于人体血液中丙氨酸氨基转移酶和天冬氨酸氨基转移酶的测定[2],同时,还可用于河水和废水[3]中磷酸根离子含量的测定.然而,商品化的PyOD几乎都来源于野生型的植物乳杆菌和绿色气球菌,发酵单位最高仅为120 U/L[4-6].大肠杆菌是一种通用的外源蛋白表达载体,迄今为止,重组大肠杆菌已经成功应用于许多医用蛋白[7-9]的外源表达.在以前的研究中,对重组大肠杆菌DH5α/pSMLPyOD异源表达PyOD做了初步优化,使得发酵单位提高到了670 U/L[10].然而,在重组大肠杆菌的发酵过程中,质粒不稳定性(Plasmid instability)是一个比较严重的问题,会导致目的产物水平的下降.在工业发酵过程中,对重组细胞要求质粒稳定性保持在25代以上[11].因此,研究重组细胞质粒的稳定性对于提高发酵效率有着十分重要的意义[12].从目前已有报道来看,影响质粒稳定性的因素很多,比如生长培养基组分[13-14]、质粒拷贝数[15]、宿主遗传背景、培养条件、比生长速率[16]、培养温度[17]、外源蛋白表达水平[18]以及所表达蛋白的毒性等[19].本文从碳源、培养温度、溶氧,pH值以及外源蛋白表达等因素对重组大肠杆菌DH5α/pSMLPyOD摇瓶发酵过程质粒稳定性进行研究.
1 材料与方法
1.1 材料
重组大肠杆菌DH5α/pSMLPyOD由本实验室构建,丙酮酸氧化酶基因克隆自Aerococcus viridans ATCC10400(AvPyOD).重组大肠杆菌DH5α/pSMLPyOD能够组成型表达丙酮酸氧化酶.
1.2 方法
1.2.1 质粒稳定性测定
参照Zhang等[12]方法进行.
1.2.2 菌体生物量测定
菌体生长量以600 nm处光密度(OD600)表示.
1.2.3 丙酮酸氧化酶活性测定
参照Zhao等[10]方法测定丙酮酸氧化酶活性.
1.2.4 碳源对发酵过程中质粒稳定性的影响
保持培养基中其他组分不变,分别以1%的葡萄糖,甘油和糊精为碳源,考察不同碳源条件下,发酵过程中菌体生长,质粒稳定性及产酶情况.
1.2.5 温度对发酵过程中质粒稳定性的影响
选择28,32,37℃三个不同温度进行发酵,研究发酵温度对重组大肠杆菌DH5α/pSMLPyOD发酵过程中菌体生长,质粒稳定性及产酶的影响.
1.2.6 溶氧对质粒稳定性的影响
采用不同装液量法,250 ml三角瓶分别盛装30,60,90 ml培养基,同等条件培养,考察溶氧对工程菌生长,产酶,质粒稳定性的影响.
1.2.7 发酵过程pH值对质粒稳定性的影响
采用pH摇床,控制培养过程中摇瓶pH值为6,6.5,7,7.5,以研究不同pH培养条件对工程菌生长,产酶,质粒稳定性的影响.
1.2.8 外源蛋白表达对质粒稳定性的影响
重组质粒pSMLPyOD转入空载大肠杆菌JM109(recA1 supE44 endA1 hsdR17 gyrA96 relA1 thi△(lac-proAB)F traD36proAB,lacIqlacZ△M15),得到重组大肠杆菌JM109/pSMLPyOD,该重组菌为诱导型表达.将JM109/pSMLPyOD与DH5α/pSMLPyOD在37℃同等条件下培养,以考察外源丙酮酸氧化酶表达对质粒pSMLPyOD稳定性的影响.
2 结果与讨论
2.1 不同碳源对E.coli DH5α/pSMLPyOD发酵过程中质粒稳定性的影响
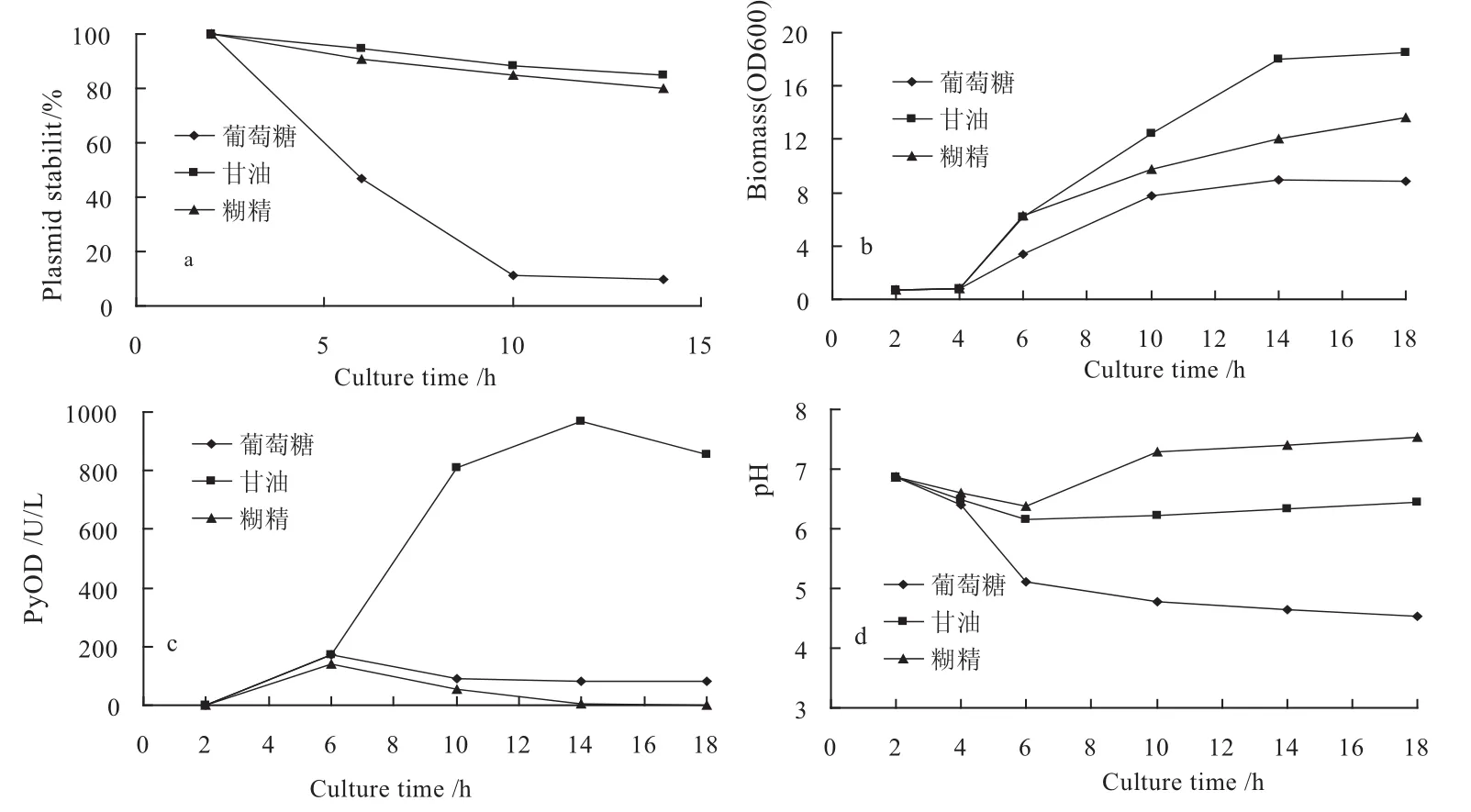
图1 不同碳源条件下DH5α/pSMLPyOD发酵过程中质粒稳定性
在无抗生素选择性压力条件下,碳源对重组大肠杆菌DH5α/pSMLPyOD摇瓶发酵过程中的质粒稳定性影响较大.当以葡萄糖为碳源时,质粒稳定性最差,发酵终点时,质粒稳定性仅有11%左右,而且菌体生长及产酶处于较低水平,分别 为 光 密 度OD600nm为4.8和88 U/L.而以甘油为碳源时,重组菌在整个发酵过程中一直保持着较高的质粒稳定性,发酵终了时,质粒稳定性仍高达88%,光密度 OD600nm为 18,酶产量700 U/L,远高于葡萄糖和糊精(见图1a,1b,1c). 黄华等[20]在利用重组大肠杆菌DH5a/AfPGA发酵表达青霉素G酰化酶的研究中也发现,葡萄糖为碳源时,质粒稳定性较差,XU Zhi-nan等[21]在研究培养基组分对质粒DNA复制的影响中也发现,以甘油为碳源时,宿主大肠杆菌细胞内质粒产量最高.
从pH值变化情况可以看出(图1d),当以葡萄糖为碳源时,过程pH值下降很快,最低pH值仅有4.5左右.而以甘油为碳源时,过程pH值始终稳定在6.5左右,这可能与重组菌对不同碳源的代谢速率不同有关.从碳流平衡角度看,流入细胞的碳流应相当于细胞用于生物合成和产生能量的碳流,但当碳流超过主要代谢途径的容量时,代谢发生不平衡,就可能通过形成代谢副产物乙酸来实现代谢平衡.葡萄糖作为碳源,其吸收速率远远大于其他碳源,代谢失衡极易发生[22],从而产生乙酸并分泌到发酵体系中,当乙酸积累到一定程度,就会抑制菌体生长[23],无质粒细胞由于其代谢压力较轻,因而对乙酸的耐受性可能要高于带质粒细胞.如果以甘油作为碳源,则可以显著降低乙酸产量或者不产生乙酸,与葡萄糖相比,细胞吸收甘油的速率较低,所以进入糖酵解的碳流下降,从而大大减少了乙酸的生成.当以糊精为碳源时,由于其为慢利用碳源,重组细胞必须先将其水解为葡萄糖,培养体系呈碳源限制性状态,菌体生长明显受到抑制,另外,由于细胞可能会利用培养基中的蛋白胨和酵母粉为碳源,因而造成培养体系pH值过高,达7.5以上.
2.2 不同培养温度对质粒稳定性的影响
不同培养温度下,重组大肠杆菌DH5α/pSML⁃PyOD质粒稳定性情况如图2所示.37℃条件下,质粒pSMLPyOD稳定性最好,14 h发酵终了时依然保持在85%以上,而28℃和32℃条件下,尽管菌体生长速率较慢(图2b),但质粒稳定性也较低.这与Gupta等[17]在研究质粒pCPPS-31在大肠杆菌DH5α中的稳定性时得到的结果基本一致.Oscam[24]等在研究质粒pTB13在枯草芽孢杆菌中的稳定性时也发现,较高培养温度下质粒更稳定,进一步研究发现,在较高培养温度下宿主细胞内质粒拷贝数也较高.低温尽管能够控制宿主的比生长速率,但低温对质粒的复制也有抑制作用,低温也可能不利于质粒在细胞间的分配.但对于不同的宿主菌和质粒来说,温度对质粒稳定性的影响不尽相同,据K wang等[25]报道,Bacil⁃lus megateriu/pCKI08在低温30℃条件下培养质粒最稳定.

图2 不同培养温度下DH5α/pSMLPyOD发酵过程中质粒稳定性
尽管低温条件下重组大肠杆菌DH5α/pSMLPyOD的质粒稳定性较差,但从图2c可以看出,工程菌的产酶水平并没有降低,36 h发酵终了时,32℃条件下PyOD水平高达1078 U/L,而37℃条件下PyOD水平在14 h达到最高,仅为930 U/L.低温条件下有利于重组大肠杆菌中外源蛋白的表达[26],但影响机理比较复杂,据Corisdeo等[27]报道,低温有利于外源基因mRNA的翻译,也有报道认为,温度会影响外源蛋白的分泌及胞内蛋白酶的活性[28].
2.3 溶氧水平对重组大肠杆菌DH5α/pSMLPyOD发酵过程中质粒稳定性的影响
溶氧是发酵过程中影响重组菌生长及质粒稳定性的又一因素,富氧能维持较高的比生长速率,但氧气对好氧微生物有着潜在的毒性副作用;低溶氧水平有时对生产有利,但过低的溶氧会导致乙酸的大量生成,菌体生长受到抑制,比生长速率下降,而比生长速率过高或过低都可能影响质粒的稳定性[29].通过改变培养基在摇瓶中的装液量以研究不同溶氧水平对重组大肠杆菌DH5α/pSMLPyOD质粒稳定性的影响.结果表明(见图3),溶氧对菌体生长是有影响的,装液量越小,菌体比生长速率越高,当装液量为30 mL时,最大比生长速率达0.26 h-1,而装液量为60和90 mL时,最大比生长速率分别为0.22 h-1和0.17 h-1,质粒稳定性也随装液量的变化而变化,在装液量为30和60 mL时,质粒稳定性均保持较高水平,其中以60 mL装液量最高,发酵14 h时仍保持在88%左右,但可以看出,在各装液量条件下,细胞质粒均保持了较高的稳定性.
有关溶氧对质粒稳定性影响的报道较多,但对其机理目前还不清楚.Huang等[30]的研究表明,质粒稳定性与比生长速率无关,溶氧过高或过低都会引起质粒的丢失[31].研究发现,质粒稳定性与比生长速率是相关的,在较低摇床转速下,质粒稳定性和比生长速率随搅拌转速的提高而同时提高,当搅拌转速达到100 rpm时,比生长速率达到0.52 h-1,此时质粒稳定性可保持在92%,但当搅拌转速提高到250 rpm时,比生长速率达0.92 h-1,此时质粒稳定性降至80%左右,因而,控制溶氧的目的就是为了使质粒复制速率与宿主菌生长速率之间的差别最小化.他们还发现,当摇瓶装液系数为0.1时,质粒稳定性最高,这与我们的实验结果基本一致.
2.4 pH水平对重组大肠杆菌DH5α/pSMLPyOD发酵过程中质粒稳定性的影响
利用pH摇床控制过程中pH值分别为6.0,6.5,7.0,7.5,结果表明(见图4),在各pH条件下,重组菌质粒稳定性均较好(85%以上),但在pH7.5条件下,工程菌的生长及产酶均受到抑制.有关pH值对质粒稳定性影响的报道并不多见,Marmelstein等[32]在研究Clostridium acetobutylicum的发酵过程时发现,低pH条件下质粒更加稳定,但研究表明,pH值对质粒稳定性没有显著影响,也有报道指出当发酵过程的pH值控制在6.5~7.0之间时,质粒拷贝数最低[33].
另外,从单位菌体产酶情况来看(见表1),低pH条件有利于酶的表达,当发酵过程pH水平控制在6.5时,菌体比酶活最高,当pH值高于7,菌体产酶水平降低,pH值7.5时,菌体比酶活仅有23 U/L/OD600.
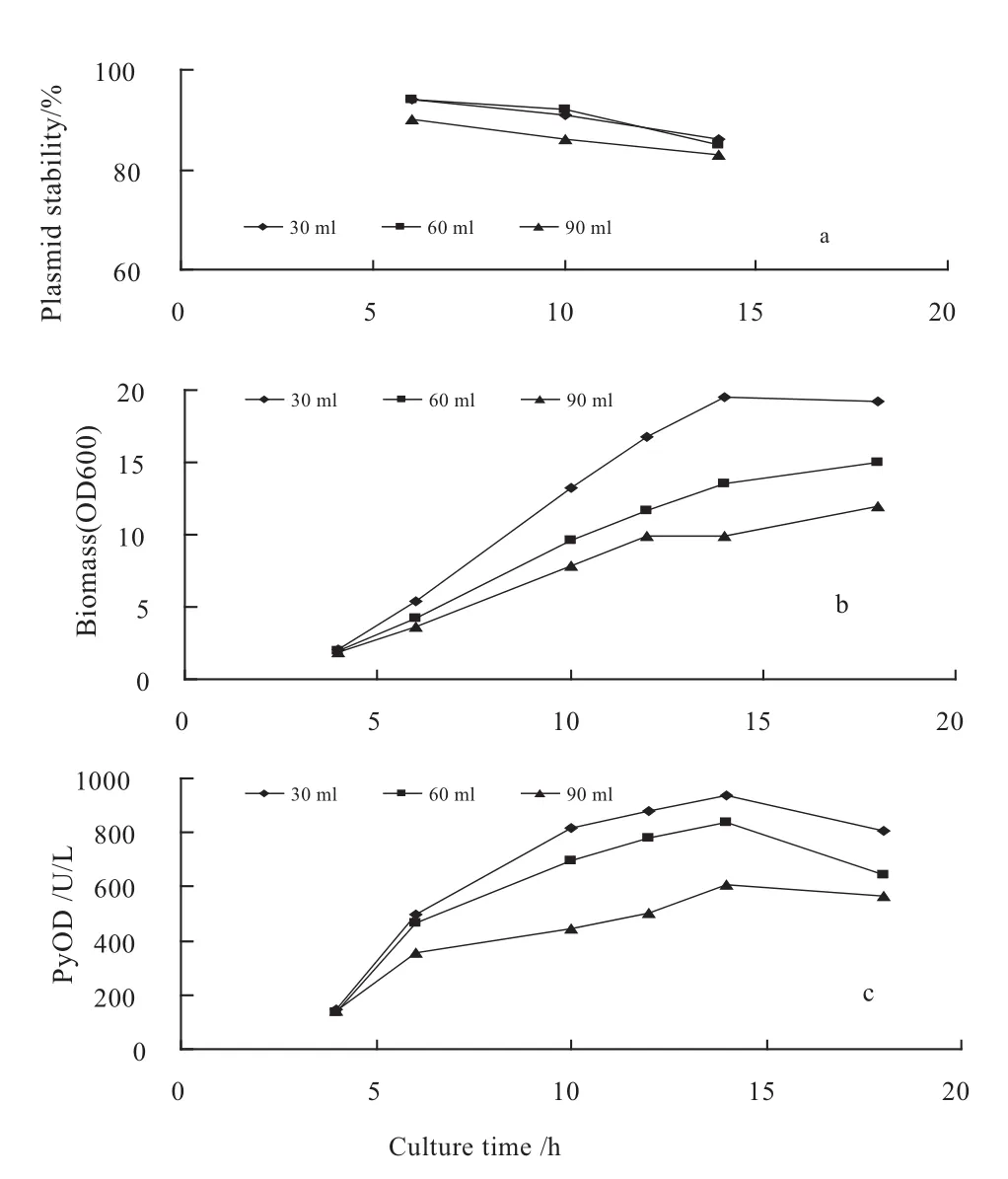
图3 不同溶氧条件下DH5α/pSMLPyOD发酵过程中质粒稳定性

表1 不同pH条件下单位菌体产酶水平/U/L/OD600
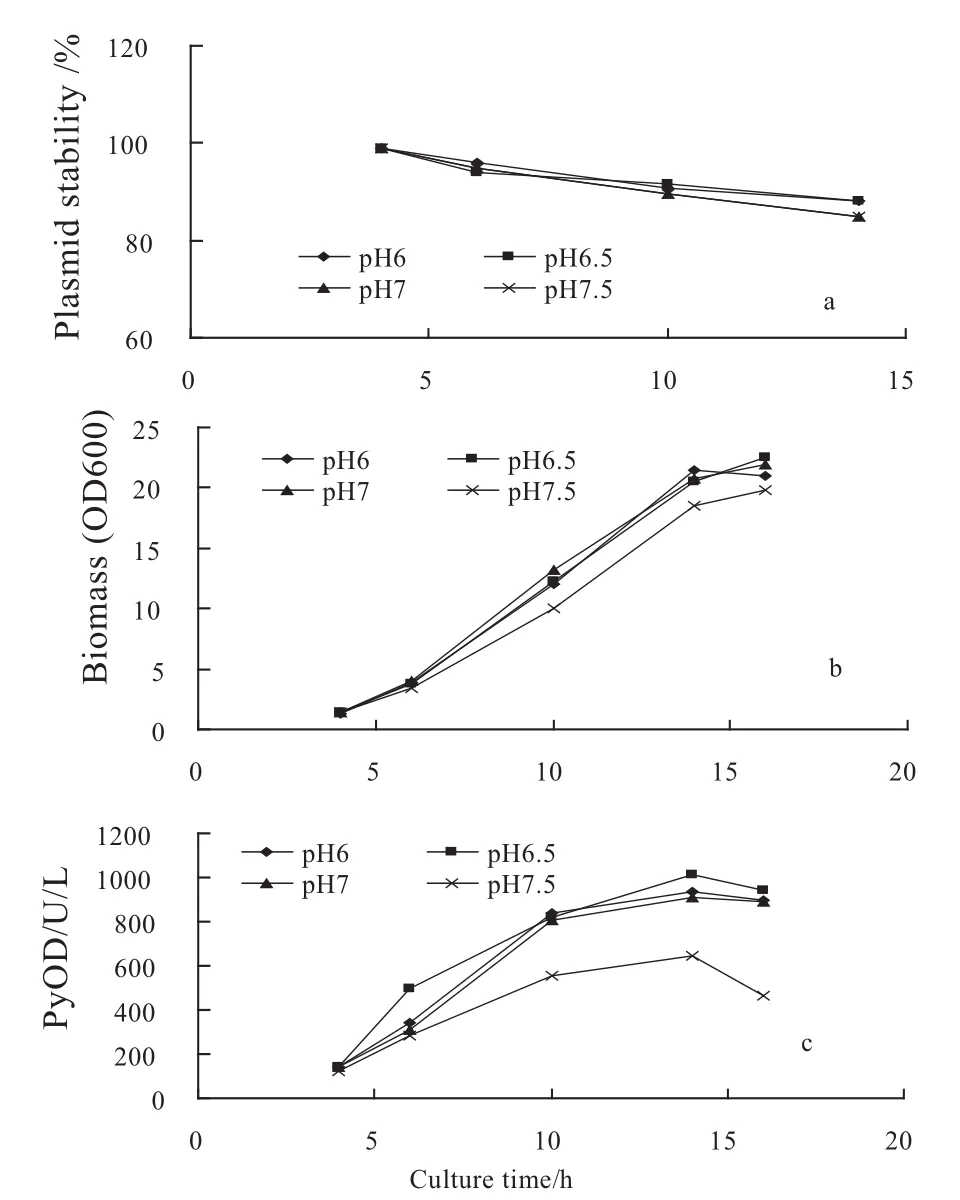
图4 不同pH条件下DH5α/pSMLPyOD发酵过程中质粒稳定性
2.5 外源蛋白表达对重组菌质粒稳定性的影响
将重组质粒pSMLPyOD转入大肠杆菌JM109,所得到的重组菌JM109/pSMLPyOD为诱导型表达,将其与重组菌DH5α/pSMLPyOD在同等条件下培养,研究外源丙酮酸氧化酶表达对质粒pSMLPyOD稳定性的影响.结果表明(见图5),在诱导型重组菌摇瓶发酵过程中,质粒稳定性始终保持在高水平,发酵结束时仍高达91%,高于表达外源蛋白的重组菌DH5α/pSMLPyOD.据Bentley等[34]研究报道,外源蛋白表达会给宿主细胞带来代谢和生长压力,这就造成了带质粒细胞和空载细胞生长速率的差异,从而引起发酵过程中质粒的丢失.由于JM109/pSMLPyOD不表达外源丙酮酸氧化酶,带质粒的JM109和空载JM109之间的生长差异较小,因而使得质粒稳定性保持在较高水平.不过从图5中也可看出,JM109的生长速率和最终菌体量都远小于DH5α/pSMLPyOD,这可能是由于培养基是以后者为对象进行优化的,因而不适于JM109的生长.

图5 外源丙酮酸氧化酶表达对质粒稳定性的影响
3 结论
对重组大肠杆菌DH5α/pSMLPyOD摇瓶发酵过程中质粒稳定性的研究表明,碳源、温度、溶氧及外源蛋白表达对重组大肠杆菌DH5α/pSMLPyOD的质粒稳定性均有影响.以甘油为碳源,37℃,装液量10%~15%条件下重组菌质粒稳定性最好.另外,当发酵过程中体系pH值在6~7之间时,质粒稳定性较高,但当pH值提高至7.5时,质粒稳定性会有所下降.低pH条件有利于重组菌产丙酮酸氧化酶.外源蛋白表达使得重组菌质粒稳定性有所下降.
[1]Tittmann K,Proske D,Spinka M,et al.Activation of Thiamin Diphosphate and FAD in the Phosphatedependent Pyruvate Oxidase from Lactobacillus lantarum[J].The Journal of Biological Chemistry,1998,273(21):12929-12934.
[2]Tao J Q.High Yield Leakage Expression of Recombinant Pyruvate Oxidase from Aerococcus viridans ATCC10400 in Escherichia coli and Its Purification[J].EastChinaUniversity of Science and Technology,2007,2(1):129-134.
[3]Kwan R C H,Leung H F,Hon P Y T,et al.A screen-printed biosensor using pyruvate oxidase for rapid determination of phosphate in synthetic wastewater[J].Appl Microbiol Biotechnol,2005,66:377-383.
[4]Elstner E,Schleifer K,Gotz F.Pyruvate oxidase:US,4,666,832[P].[1987-05-19].
[5]Hideo M,Kazuo M,Saburo H,et al.Process for the manufacture of pyruvate oxidase,and analytical method and kit for the use of the same:US,4,246-342,832[P].[1981-01-20].
[6]Yamamoto,Kazumi,Toshiro K,et al.Pyruvate oxidase and an analytical method using the same:US,4,965,194[P].[1990-10-23].
[7]Jeong K J,Choi J H,Yoo W M,et al.Constitutive production of human leptin by fed-batch cultureof recombinant rpoS Escherichia coli[J].Protein Expression and Purification,2004,36:150-156.
[8]Khalilzadeh R,Shojaosadati S A,Maghsoudi N,et al.Process Development For Production Of Recombinant Human Interferon-C Expressed In Escherichia Coli[J].J Ind Microbiol Biotechnol,2004,31:63-69.
[9]Looser V,Hammes F,Keller M,et al.Flow-Cytometric Detection of Changes in the Physiological State of E.coli Expressing a Het⁃erologous Membrane Protein During Carbon-Limited Fedbatch Cultivation[J].Biotechnology And Bioengineering,2005,92(2):69-78.
[10]Zhao J,Wang Y H,Chu J,et al.Statistical optimization of medium for the production of pyruvate oxidase by the recombinant E.coli[J].J Ind Microbiol Biotechnol,2008(3):61-64.
[11]Imanaka T,Aiba S.A perspective on the application of genetic engineering stability of recombinant plasmid[J].Ann NY Acad Sci,1981,369:1-14.
[12]Zhang Y,Li T,Liu J.Low temperature and glucose enhanced T7 RNA polymerase-based plasmid stability for increasing expres⁃sion of glucagon-like peptide-2 in Escherichia coli[J].Protein Expression and Purification,2003,29:132-139.
[13]Matsui T,Sato H,Sato S,et al.Effects of nutritional conditions on plasmid stability and production of tryptophan synthase by a re⁃combinant Escherichia coli[J].Agric Biol Chem,1990,54:619-624.
[14]Shoham Y,Demain A L.Effect of medium composition on the maintenance of a recombinant plasmid in B.subtilis[J].Enzyme Mi⁃crob Technol,1990,12:330.
[15]Togna A P,Shuler M L,Wilson D B.Effect of plasmid copy number and runway plasmid replication on over production and excre⁃tion of p-lactamase from Escherichia coli[J].Biotechnol Prog,1993,9:31-39.
[16]Nancib N,Bordrant J.Effect of growth rate on stability and gene expression of a recombinant plasmid during continuous culture of E.coli in a non-selective medium[J].Biotechnol Lett,1992,14:643-648.
[17]Gupta R,Sharma P,Vyas V V.Effect of growth environment on the stability of a recombinant shuttle plasmid pCPPS-31 in Esche⁃richia coli[J].Journal of Biotechnology,1995,41:29-37.
[18]Parker C,DiBiasio D.Effect of growth rate and expression level on plasmid stability in Saccharomyces cerevisiae[J].Biotechnolo⁃gy and Bioengineering,1987,29:215-221.
[19]Corchero J L,Villaverde A.Plasmid maintenance in Escherichia coli recombinant cultures is dramatically,steadily,and specifical⁃ly influenced by features of the encoded proteins[J].Biotechnology And Bioengineering,1998,58:625-632.
[20]黄华,苟斌全,王永红,等.组成型表达粪产碱杆菌青霉素G酰化酶重组大肠杆菌发酵条件研究[J].生物技术,2006,16:57-63.
[21]XU Zhi-nan,SHEN Wen-he,CHEN Hao,et al.Effects of medium composition on the production of plasmid DNA vector potential⁃ly for human gene therapy[J].J Zhejiang Univ SCI,2005,6B:396-400.
[22]Holms W H.The central metabolic pathways in Escherichia coli:relationship between flux and control at a branchpoint,efficiency of conversion to biomass,and excretion of acetate[J].Current Topics in Cellular Regulation,1986,28:69-105.
[23]Lee S Y.High cell density culture of Escherichia coli[J].Trends Biotechnology,1996,14:98-105.
[24]Oscam L,Venena G,Bron S.Plasmid pTB-913 derivatives are segregationally stable in B.subtilis at elevated temperatures[J].Plasmid,1992,28:70-79.
[25]Kwang H S,Jong H J,Jung H K.Effect Of Temperature On Plasmid Stability And Expression Of Cloned Cellulase Gene In A Re⁃combinant Bacillus Megaterium[J].Biotechnology Letters,1987,9:821-824.
[26]叶姣,陈长华,夏杰,等.温度对重组大肠杆菌生长及外源蛋白表达的影响[J].华东理工大学学报,2002,28:364-368.
[27]Corisdeo S,Wang B.Functional expression and display of an antibody Fab fragment in Escherichia coli:Study of vector designs and culture conditions[J].Protein Expression and Purification,2004,34:270-279.
[28]Bird P I,Pak S C,Worrall D M,et al.Production of recombinant serpins in Escherichia coli[J].Methods,2004,32:169-176.
[29]蔡丰聚,徐英黔.基因工程菌稳定性的若干影响因素[J].生命的化学,2006,26:451-453.
[30]Huang J,Dhulster P,Barbotin J N,et al.Effects of oxygen diffusion on recombinant E.coli B(pTG201)plasmid stability,growth rate,biomass production,and enzyme activity in immobilized and free bacteria during continuous culture[J].J Chem Tech Bio⁃technol,1989,45:259-269.
[31]Count P,Limpoolsup A,Greenfield P F.The effect of oxygen limitation on stability of a recombinant plasmid in S.cereuisiae[J].Biotechnol Lett,1989,11:5-10.
[32]Marmelstein L D,Papoutsakis E T.Evolution of microlide and lincosamide antibiotics for plasmid maintenance in low pH Cl.ace⁃tobutylicum ATCC-824 fermentations[J].FEMS Microbial Lett,1993,113:71-76.
[33]Reinikainen P,Virkajarvi T.E.coli growth and plasmid copy numbers in continuous cultivations[J].Biotechnol Lett,1989,11:225-230.
[34]Bentley W E,Kompala D S.Stability in continuous culture in recombinant bacteria:a metabolic approach[J].Biotechnol Lett,1990,12:329-334.
