猪源奇异变形杆菌的分离鉴定与生物学分析
2015-06-15任梅渗杨泽晓姚学萍林星宇
任梅渗,王 印,杨泽晓,姚学萍,林星宇
猪源奇异变形杆菌的分离鉴定与生物学分析
任梅渗1,2,王 印1,2,杨泽晓1,姚学萍1,林星宇1,2
目的 从四川省某规模化养猪场病死猪肝脏分离到一株奇异变形杆菌,分析其生物学特性,为临床鉴别诊断和治疗提供参考。方法 对分离株进行革兰氏染色、培养特性观察、毒力试验、生化试验、药敏试验以及16S rRNA基因序列分析,并且构建系统进化树。结果 分离株16S rRNA测序结果经BLAST对比分析,其与各株奇异变形杆菌同源性均为98%以上,将分离株与GenBank中其他6株不同来源的变形杆菌与3株不同来源的肠杆菌科细菌进行序列对比分析并且构建系统进化树,证明分离株与猪源奇异变形杆菌(HQ259935.1)的同源性最高,为99.8%;与大肠杆菌,沙门氏菌,克雷伯氏菌的同源性仅为92.1%~93.2%。致病性试验表明分离株对小鼠LD50为1.86×106CFU/只。分离株对氨基糖苷类和β-内酰胺类药物中度敏感,对其他种类药物敏感性较低。结论 分离株经鉴定为猪源奇异变形杆菌,具有较高的耐药性和致病性。
奇异变形杆菌;猪;分离鉴定;16S rRNA
奇异变形杆菌(Proteusmirabilis)为条件致病菌,属于肠杆菌科变形杆菌属,是一种无荚膜、无芽孢的革兰氏阴性杆菌。奇异变形杆菌具有活泼的运动力,能迅速分解尿素,产生大量硫化氢,在低浓度的琼脂表面能快速地迁徙生长,形成环状的厚度不一的波状菌苔[1]。奇异变形杆菌广泛分布于泥土、水、粪便以及人与动物的体表、粘膜、消化道中;可引起人类和动物的尿道感染,引起尿道炎,肾盂肾炎,也能导致菌血症、败血症[2]。研究表明该菌能够引起猪发病并且有一定的致死性,临床主要表现为高热、呕吐、腹泻、气喘,引起猪的败血症并产生不耐热肠毒素反应而导致病猪致死[3]。近年来,奇异变形杆菌作为人兽共患的病原体,在人与动物中引起的疫情频繁发生[4],由于近年广谱抗生素的大量使用,其临床耐药菌株也开始大量产生并且其耐药性也不断增加,这为临床治疗带来了更大的困难[5]。本研究针对从病死猪分离的一株细菌,根据对其进行生化鉴定,药敏试验,生长特性和序列分析,判定该菌为奇异变形杆菌,以此对该菌的病原学研究与临床诊断和治疗奠定基础。
1 材料与方法
1.1 样品与试验动物 从四川地区某规模化养猪场采集病死猪组织。SPF级昆明小鼠45只,体重为17~20 g,雌雄各半,购自成都达硕生物科技有限公司。
1.2 试剂与培养基 普通琼脂、SS琼脂、血琼脂,麦康凯琼脂购自奥博星生物技术(北京)有限责任公司。抗菌药物药敏纸片及细菌微量生化反应管均购自杭州微生物试剂有限公司。2×Taq PCR Master Mix、DNA 分子量标准,细菌基因组DNA提取试剂盒以及DNA纯化回收试剂盒购自天根生化科技(北京)有限公司。pMD19-T载体购自宝生物工程(大连)有限公司,大肠杆菌DH5α为实验室自行保存,其他试剂为国产分析纯。
1.3 细菌分离与纯化 无菌操作取病死猪肝脏接种于麦康凯琼脂培养基,挑取光滑,圆形,半透明的单个可疑菌落涂片镜检并且分离纯化,为后续试验做准备。
1.4 细菌的培养特性 将分离株分别接种在琼脂浓度为1.0%、2.0%与3.0%的普通琼脂培养基上,37 ℃培养24 h;在5%脱纤绵羊血的血琼脂培养基和SS琼脂培养基上划线接种37 ℃培养24 h,观察分离株的生长情况。
1.5 测定LD50按照改良寇氏法,用预试验确定LD100与LD0,在此剂量区间范围内设置5个剂量组,每个剂量组随机取8只小鼠。每组腹腔注射不同浓度梯度的菌液0.2 mL;另取5只小鼠设置为阴性对照组并注射等量生理盐水。每组小鼠隔离饲养,常规管理,观察临床症状并记录死亡数,总共观察72 h,每6 h观察一次;剖检死亡小鼠,记录组织脏器的病理变化,分离致死菌进行鉴定,并以改良寇氏法[6]计算LD50。
1.6 药敏试验 按照药敏纸片扩散法进行试验,参照CLSI(2014)药敏标准对结果进行判定[7]。
1.7 生化试验 使用肠杆菌科细菌微量生化反应管,参照伯杰氏细菌鉴定手册进行试验[8]。
1.8 引物设计 采用通用引物扩增16S rRNA基因,引物序列为F:5′-AGAGTTTGATCCTGGCTCAG-3′;R:5′-GGTTACCTTGTTACGACT-3′,预期目的片段为1 445 bp。引物由生工生物工程(上海)股份有限公司合成。
1.9 16S rRNA PCR扩增与序列分析 分离株DNA模板用细菌基因组DNA提取试剂盒提取。扩增体系50 μL,Rnase-free H2O 20 μL,2×Taq PCR Master Mix 25 μL,上下游引物各1.5 μL,DNA模板2 μL。PCR反应参数:95 ℃预变性5 min,95 ℃变性45 s,58 ℃退火45 s,72 ℃延伸1 min,反应进行30个循环,最后72 ℃延伸10 min。使用DNA纯化回收试剂盒对PCR产物进行切胶回收并连接pMD19-T载体,转化入大肠杆菌DH5α,将重组菌液送华大科技有限公司测序。使用Blast对测序得到的基因序列与GenBank公布的各株奇异变形杆菌16S rRNA基因序列进行对比,利用MEGA4.1软件中Neighbor-joining方法构建系统进化树。
2 结 果
2.1 生长特性与镜下形态 从病死猪肝脏分离出1株可疑菌,编号为PLB-1,在麦康凯培养基上呈现圆形,中等大小的半透明菌落;在血琼脂培养基上出现α溶血现象;SS琼脂培养基上出现圆形,中等大小、扁平,中心黑色的光滑菌落(见图1、2)。分离株在含1.0%琼脂的普通培养基上,呈放射状扩散生长,在含2.0%和3.0%琼脂的普通培养基上,呈现同心圆状扩散生长。其扩散速度在含1.0%琼脂的普通培养基上最快,2.0%次之,在含3.0%琼脂的普通培养基上扩散最慢(见图3、4、5)。镜下形态呈革兰氏阴性菌,呈现多形性,杆状居多,球状偏少。
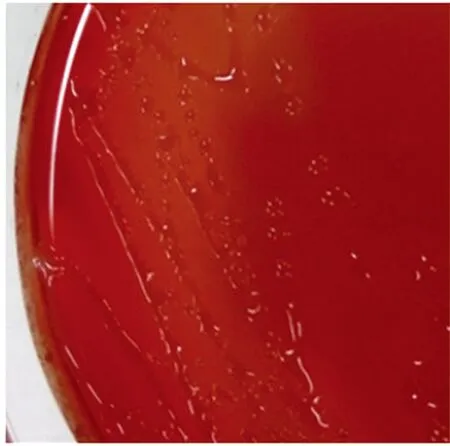
图1 在血琼脂上的生长特性

图2 在SS培养基上的生长特性
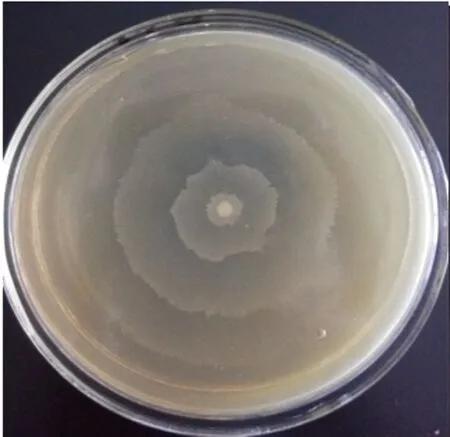
图3 1%琼脂
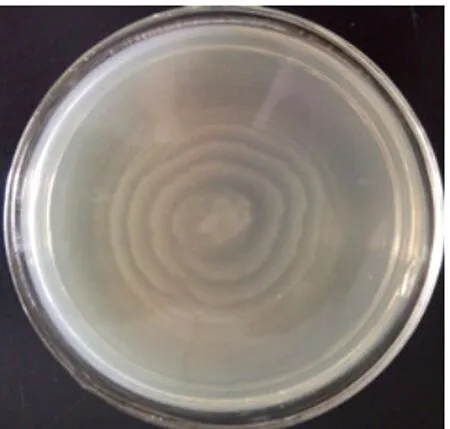
图4 2%琼脂
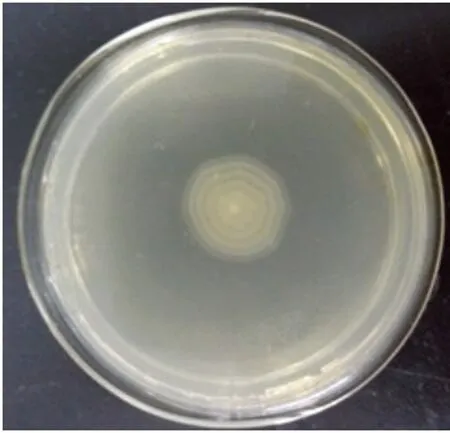
图5 3%琼脂
2.2 LD50测定 试验组小鼠2 h后陆续出现精神沉郁,食欲下降,被毛粗乱,6 h后部分小鼠全身震颤,眼角出血。12~30 h为小鼠死亡高峰期,48 h后不再出现死亡,对照组小鼠均未出现异常。病死小鼠肝脏和肾脏肿大,充血,伴有出血点,肝脏表面出现坏死灶,脾脏边缘肿大充血,肠道臌气,恶臭。取肝脏分离细菌,鉴定结果为分离株阳性。按照改良寇氏法计算LD50为1.86×106CFU/只。
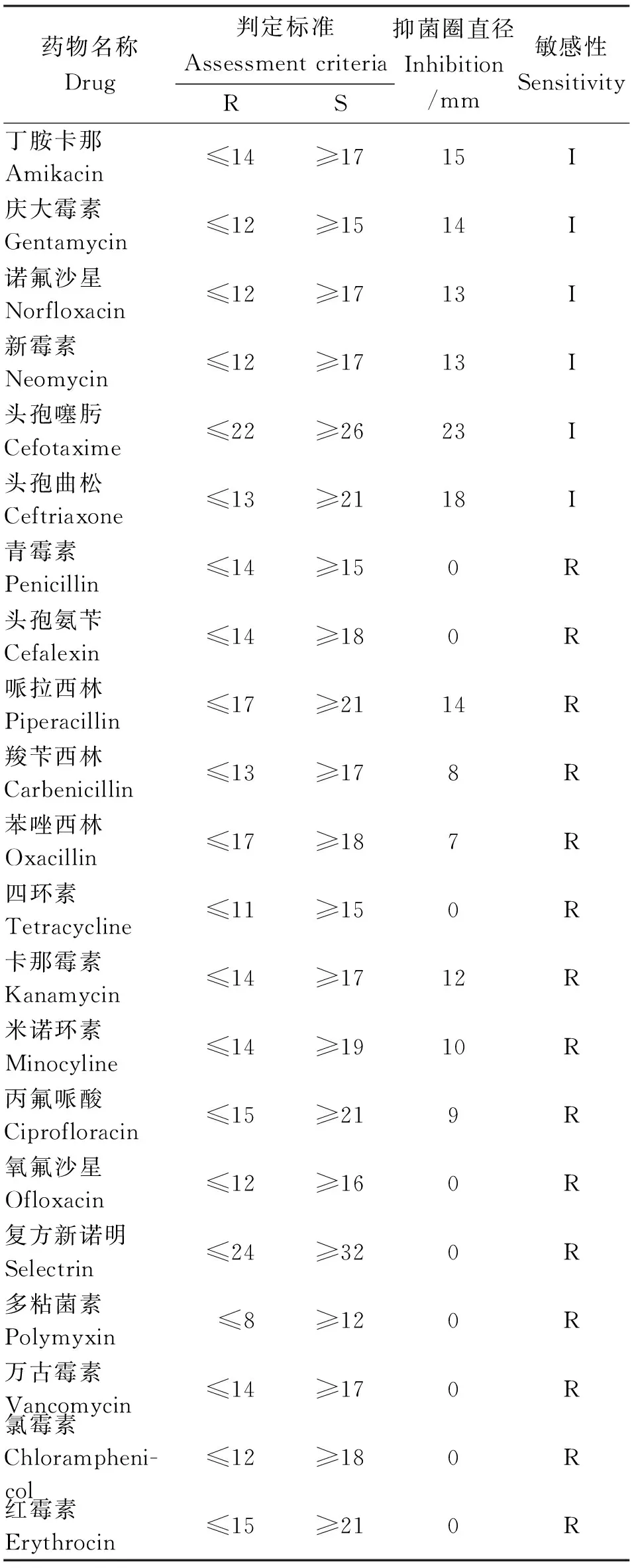
表1 药敏试验结果
Note: “S” Sensitivity; “I” Moderate; “R” Resistance.
2.3 药敏试验 在测定的21种常用药物当中,无高度敏感药物;对6种药物中度敏感,占总试验药物的28.6%,分别是诺氟沙星、新霉素、丁胺卡那、庆大霉素、头孢噻肟以及头孢曲松;对其他15种药物均为耐药,占总试验药物的71.4%(见表1)。
2.4 生化试验 分离株发酵葡萄糖产酸产气;尿素、硫化氢,明胶以及MR结果呈阳性;吲哚、VP,七叶苷试验呈阴性;不发酵麦芽糖、乳糖、蔗糖、山梨醇、卫矛醇。参照伯杰氏细菌鉴定手册,符合奇异变形杆菌的生化特性(见表2)。
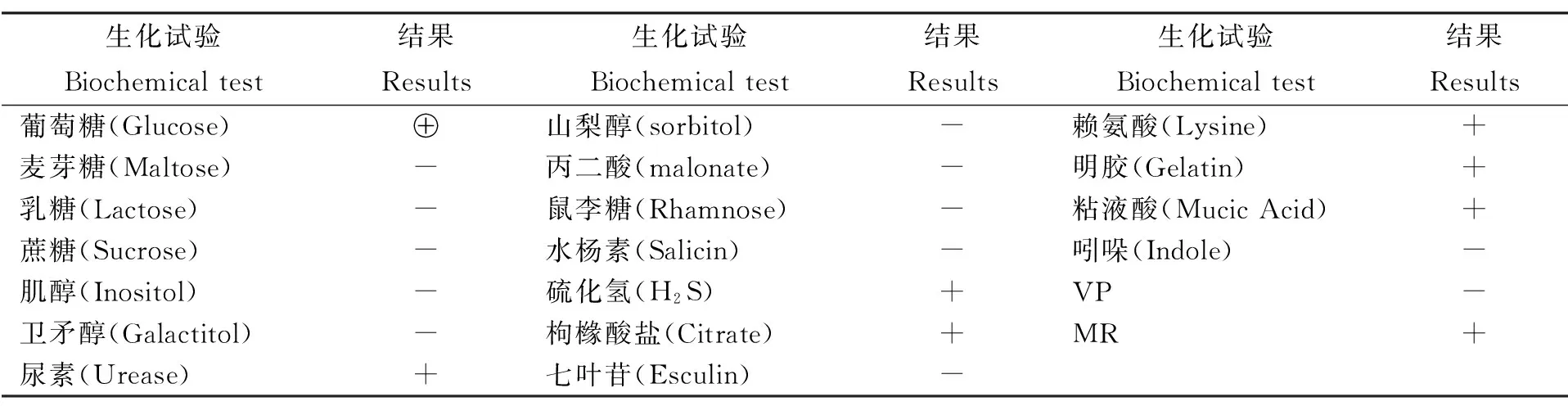
表2 生化试验结果
Note: “⊕” positive product acid gas; “+” positive; “-” negative.
2.5 16S rRNA PCR扩增使用16S rRNA通用引物,扩增分离株16S rRNA基因序列,预计扩增片段为1 445 bp,结果符合预计的片段长度(见图6)。
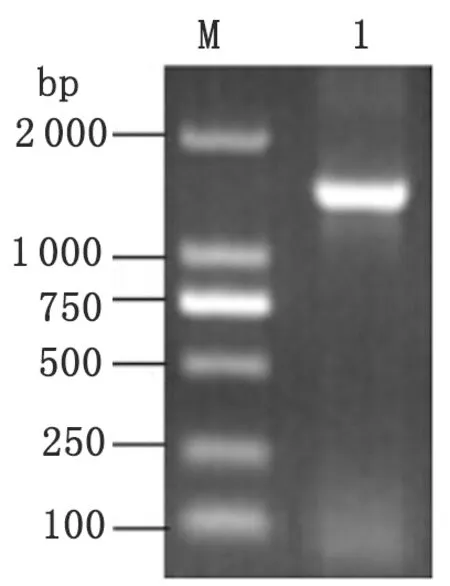
1: Product of 16S rRNA by PCR; M: DNA Marker DL2000.
2.6 16S rRNA序列同源性比较与系统进化树的构建 16S rRNA测序所得序列已上传GenBank(登录号KR133627)。将其与GenBank中各株奇异变形杆菌序列进行BLAST对比分析,同源性均在98%以上。选取6株变形杆菌属和3株肠杆菌科的不同属的16S rRNA序列,用MEGA4.1软件中Neighbor-jioning方法构建系统进化树(见图7)。分离株PLB-1与两株猪源奇异变形杆菌HQ259935.1与AB272351.1同源性最高,为99.6%~99.8%;与AB682277.1(彭氏变形杆菌)、HF947011(普通变形杆菌),KC210868.1(豪氏变形杆菌)同源性稍低,为98.5%~99.3%,与FJ949577.1(大肠杆菌)、FJ463825.1(沙门氏菌),FJ655784.1(克雷伯氏菌)同源性仅为92.1%~93.2%,明显不是同一个种属。
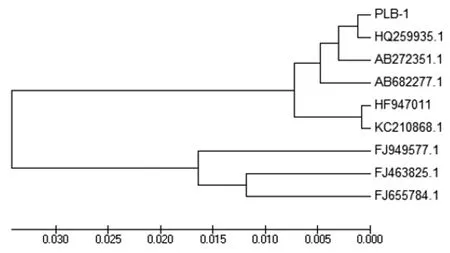
图7 分离株PLB-1 16S rRNA核苷酸系统进化树
Fig.7 Phylogenetic tree based on 16S rRNA gene of the PLB-1 isolate
3 讨 论
奇异变形杆菌属于肠杆菌科,变形杆菌属,是一种革兰氏阴性的条件致病菌,能够引发人和动物的尿道感染,引起肾盂肾炎,某些情况下也能导致菌血症的产生。奇异变形杆菌能产生多种毒力因子,包括ZapA金属蛋白酶,Hfq分子伴侣和溶血素等[9]。ZapA是锌金属蛋白酶的成员,能裂解多种底物,如IgA1,IgA2和免疫系统的防御素,而且ZapA不只是导致IgA铰链部分断裂而是能够完全降解免疫球蛋白[10]。Hfq分子伴侣在奇异变形杆菌引起的人和动物尿路感染中是重要的影响因素,Hfq能使得其鞭毛大量表达,引起奇异变形杆菌黏附与侵袭尿路上皮细胞的能力增强,并且减少宿主体内巨噬细胞的数量,降低宿主的免疫力[11]。本试验从病死猪肝脏分离细菌,依据培养特性、生化试验,药敏试验以及16S rRNA序列分析,鉴定分离株为奇异变形杆菌。选取小鼠对分离株进行致病性试验,测得LD50为1.86×106CFU/只。
奇异变形杆菌有很强的运动性,在琼脂浓度低的培养基上扩散速度快,距离远,此时其以CGC的形态生长,镜下呈菌体较长、多鞭毛的杆菌。由于高浓度的琼脂不利于其酸性代谢产物的扩散,继而影响该菌的生长,所以在琼脂浓度高的培养基上扩散速度较慢,距离较近,此时奇异变形杆菌以VC的形态生长,镜下呈短杆菌,鞭毛减少[12]。由于奇异变形杆菌感染人和动物尿路上皮细胞的能力受到菌毛和鞭毛的影响,所以CGC的这种生长形态可能有助于提高其在尿路上皮细胞的粘附与定植能力[13-14]。本试验将分离株分别接种在琼脂浓度为1.0%~3.0%的普通培养基上,结果显示分离株的扩散生长也明显受到培养基内琼脂浓度的影响。
有研究表明奇异变形杆菌自身携带的R质粒能够在不同细菌中转移构成复合R质粒,许多的R质粒可在异种或者异属之间转移,从而导致细菌的抗性进化过快,耐药性增加[15-16]。目前多数奇异变形杆菌对β-内酰胺类与氨基糖苷类药物敏感[1,6,14-15],但本试验分离株无高度敏感药物,且仅对氨基糖苷类和β-内酰胺类的少量药物以及恩诺沙星中度敏感,说明养殖场存在滥用抗菌药物的情况,导致该菌可能存在多种耐药的质粒基因,致使耐药性较高,病原性更加突出,临床上对于该菌的治疗难度加大,所以消除耐药质粒以及研发新型消除剂还有待更深入的研究。
近年来,人和动物感染奇异变形杆菌的报道不断增多,在高密度养殖的饲养场内,容易迅速蔓延,引发流行病。对于该病防治与诊断技术的深入研究应引起足够重视。
[1]Zhao ZP, Yang Z, Lin WD, et al. Isolation, identification and swarming motility analysis ofProteusmirabilisfrom pig[J]. Chin Anim Husb Vet Med, 2014, 41(10): 219-223. (in Chinese) 赵振鹏,杨振,林伟东,等.猪源奇异变形杆菌的分离鉴定及集群运动分析[J].中国畜牧兽医, 2014, 41(10): 219-223.
[2]Chen CY, Chen YH, Lu PL, et al.Proteusmirabilisurinary tract infection and bacteremia: risk factors, clinical presentation, and outcomes[J]. J Microbiol Immunol Infect, 2012, 45(3): 228-236.
[3]Ye SZ, Huang YJ, Zhang LM, et al. An investigative study on infection ofProteusin pigs[J]. Chin J Anim Vet Sci, 1991, 22(1): 74-77. (in Chinese) 叶树株,黄言钧,张理谟,等.猪变形杆菌感染症的调查研究[J].畜牧兽医学报, 1991, 22(1): 74-77.
[4]Cohen-Nahum K, Saidel-odes L, Riesenberg K, et al. Urinary tract infections caused by multi-drug resistantProteusmirabilis: Risk factors and clinical outcomes[J]. Infection, 2010, 38(1): 41-46.
[5]Cernohorska L, Chv lova E.Proteusmirabilisisolated from urine, resistance to antibiotics and biofilm formation[J]. Klin Mikrobiol Infekc Lek, 2011, 17(3): 81-85.
[6]Ma L, Yan QG, Wan L, et al. Isolation and identification onK.peneumoniaeinRhizomys[J]. Chin J Zoonoses, 2011, 27(9): 825-827. (in Chinese) 马磊,颜其贵,万莉,等.竹鼠肺炎克雷伯氏菌的分离鉴定[J].中国人兽共患病学报, 2011, 27(9): 825-827.
[7]Zhang YW, Wang H. Interpretation of major changes in CLSI M100-S24[J]. Chin J Lab Med, 2014, 37(4): 256-260. (in Chinese) 张雅薇,王辉.2014年CLSI M100-S24主要更新内容解读[J].中华检验医学杂志, 2014, 37(4): 256-260.
[8]Buchanan RE, Gibbons NE. Bergey's manual of systematic bacteriology[M]. 8th ed. Beijing:Science Press, 1984:454-457. (in Chinese) 布坎南 RE,吉本斯 NE.伯杰细菌鉴定手册[M].8版.北京:科学出版社, 1984:454-457.
[9]Pearson MM, Sebaihia M, Churcher C, et al. Complete genome sequence of uropathogenicProteusmirabilis, a master of both adherence and motility[J]. J Bacteriol, 2008, 190(11): 4027-4037.
[10]Wang MC, Chien HF, Tsai YL, et al. The RNA chaperone Hfq is in stress tolerance and virulence in uropathogenicProteusmirabilis[J].PLoS one, 2014, 9(1): e85626. DOI: 10.1371/journal.pone.0085626
[11]Yang QL, Gao J, Luo LP, et al. Virulence test ofProteusmirabilisfrom dog[J]. Chin J Vet Med, 2013, 49(8): 60-63. (in Chinese) 杨巧玲,高健,罗立平,等.犬源性奇异变形杆菌的毒力试验[J].中国兽医杂志, 2013, 49(8): 60-63.
[12]Jia XF, Liu JK, Xu QW, et al. Periodic variety in swarming motility ofProteusmirabilis[J]. Acta Acad Med Mil Tert, 2005, 27(9): 868-870. (in Chinese) 贾雄飞,刘俊康,徐启旺,等.奇异变形杆菌周期性群集运动的研究[J].第三军医大学学报, 2005, 27(9): 868-870.
[13]He XY, Liao SX, Liu JK, et al. Study on whorl swarming growth phenomenon ofProteusmirabilis[J]. J Biomed Eng, 2015, 32(1): 131-136. (in Chinese) 何先元,廖巳祥,刘俊康,等.奇异变形杆菌螺纹迁徙生长现象研究[J].生物医学工程学杂志, 2015, 32(1): 131-136.
[14]Shi TR, Li D, Liu N, et al. Isolation and identification ofProteusmirabilisfrom mink[J]. Chin J Prev Vet Med, 2013, 35(10): 817-820. (in Chinese) 史同瑞,李丹,刘宁,等.貂奇异变形杆菌的分离及其生物学鉴定[J].中国预防兽医学报, 2013, 35(10): 817-820.
[15]Su WY, Li XN, Han JZ, et al. Drug-resistance research and elimination of drug resistance plasmids of 10 strains of chicken sourceProteusmirabilis[J]. Mod Anim Husb Vet Med, 2014(10): 5-9. (in Chinese) 苏葳艺,李欣南,韩镌竹,等.10株鸡源奇异变形杆菌的质粒消除及耐药性研究[J].现代畜牧兽医, 2014(10): 5-9.
[16]Khan AU, Musharraf A. Plasmid-mediated multiple antibiotic resistance inProteusmirabilisisolated from patients with urinary tract infection[J]. Med Sci Monit, 2004, 10(11): 598-602.
Isolation, identification and biological characteristics analysis ofProteusmirabilisfrom swine
REN Mei-shen1,2,WANG Yin1,2,YANG Ze-xiao1,YAO Xue-ping1,LIN Xing-yu1,2
(1.CollegeofVeterinaryMedicine,SichuanAgriculturalUniversity,Chengdu611130,China; 2.KeyLaboratoryofAnimalDiseaseandHumanHealthofSichuanProvince,Chengdu611130,China)
To investigate biological characteristics and provide reference forProteusmirabilisidentification diagnosis and treatment, samples from a large scale pig farm in Sichuan Province were collected for isolation ofProteusmirabilis. The pathogen was tested by gram staining, culture characteristics observation, biochemical tests, antimicrobial susceptibility tests and 16S rRNA gene sequence analysis. Results of alignment analysis indicated that this sequence showed 98% homology with the sequence ofProteusmirabilis. Furthermore, the phylogeny tree that constructed with 6 reference strains ofProteusand 3 reference strains of enteric bacilli indicated that the highest homology with the strain HQ259935.1 was 99.8%. However, the homology with 3 strains of enteric bacilli was only 92.1%-93.2%, which proved that they didn't belong to the same species. In addition, the result of pathogenicity test showed that the LD50was 1.86×106CFU per mouse. And then, the isolated pathogen was moderately sensitive to antibiotics of aminoglycoside and β-lactam, but resistant to others. In conclusion, the pathogen was identified to beProteusmirabilis. In addition, it was proved to have strong pathogenicity and powerful drug resistance.
Proteusmirabilis; swine; isolation and identification; 16S rRNA
Wang Yin, Email: yaanwangyin@tom.com
10.3969/j.issn.1002-2694.2015.12.002
王印,Email:yaanwangyin@tom.com
1.四川农业大学动物医学院,成都 611130; 2.动物疫病与人类健康四川省重点实验室,成都 611130
R378.2
A
1002-2694(2015)12-1093-05
2015-04-28;
2015-07-25
国家“十二五”国家科技支撑计划(No.2013BAD12B04)
Supported by the "Twelfth Five-Year-Plan" in National Science and Technology for the Rural Development in China (No. 2013BAD12B04)
