肺微瘤型类癌合并肺隔离症和肺曲霉菌病一例报告并文献复习
2015-06-12胡秋芳杨小东吴立雪黄燕花
胡秋芳,杨小东,张 艺,吴立雪,黄燕花
肺微瘤型类癌 (pulmonary carcinoid tumourlet)是比较少见的肺神经内分泌肿瘤,早期无特异性临床表现,经常被误诊或漏诊。肺隔离症 (pulmonary sequestration,PS)也是临床上比较罕见的先天性肺发育畸形,由胚胎期部分肺芽组织与支气管树分离导致。目前,有关肺微瘤型类癌合并PS的报道非常少,本研究对1例在隔离肺组织中发现微瘤型类癌和曲霉菌,同时伴支气管扩张的患者进行报道,并结合文献复习,以提高临床医生对该类疾病的认识。
1 病例简介
患者,男,44岁,于2012-10-13因“反复咳嗽、咳痰10个月”到四川大学华西医院就诊。患者于10个月前,因“上呼吸道感染”出现咳嗽、咳痰症状,到井研县人民医院就诊,经X线检查诊断为左下肺炎,予以左氧氟沙星 (0.8 g/次,2次/d)抗感染治疗,并给予祛痰、止咳等对症治疗,5 d后症状缓解。随后症状反复发作,为求进一步诊治到本院就诊。体格检查:体温35.9℃,脉搏75次/min,呼吸20次/min,血压130/70 mm Hg(1 mm Hg=0.133 kPa)。神志清,皮肤、巩膜无黄染,全身浅表淋巴结无肿大。双侧呼吸运动均匀对称,双肺语音震颤对称无异常,无胸膜摩擦感,双肺叩诊呈清音,左肺下叶呼吸音稍粗,余未闻及干湿啰音和胸膜摩擦音。心界不大,心律齐,各瓣膜区未闻及杂音。腹软,无压痛及反跳痛,腹部包块未触及,肝脾肋下未触及,肾脏未触及。双下肢无水肿。胸部CT示:左肺下叶基底段体积缩小,见多发性支气管囊、柱状扩张伴感染;右肺上叶尖端及下叶后基底段小结节灶形成,炎性肉芽肿可能性大。门诊以“左肺下叶囊肿伴感染”收治入院。入院后给予盐酸莫西沙星氯化钠注射液 (400 mg/次,1次/d)、盐酸氨溴索 (15 mg/次,2次/d)等对症治疗。6 d后,胸部增强CT示:左侧胸廓稍塌陷,胸廓骨骼未见异常;左肺下叶体积缩小,见多个囊、柱状影,最大直径约3.1 cm,其内可见气液平面;下叶肺组织内见磨玻璃影、斑片影;右肺下叶后基底段、上叶尖段可见大小约0.4~0.5 cm结节影;双侧肺门及纵隔淋巴结无增大,纵隔未见移位;心脏未见增大,心包未见积液;双侧未见胸腔积液。与入院时CT片比较,无明显变化。经胸外科会诊,于2012-11-18行“胸腔镜下左肺下叶切除、胸膜烙断术”。术中见左侧胸腔致密粘连,无胸腔积液,肺裂发育不良,肺表面碳末沉着,从膈下主动脉发出一条直径约6 mm的异常血管,经肺下韧带至左下肺基底段。术后病理检查:切面 (左肺)见囊腔形成,镜检发现囊壁为扩张支气管,周围可见平滑肌组织,软骨缺如,腔内有霉菌团,形态符合曲霉菌;周围肺组织有慢性炎症,伴纤维组织增生和畸形血管;病灶处有数团中等大小增生的瘤细胞,较大直径分别为1 mm和2 mm(见图1)。免疫组化染色:神经黏附因子 (CD56,+)、嗜铬素 A(CgA,+)、突触素 (Syn,-)、广谱细胞角蛋白 (PCK, ±)、上皮膜抗原 (EMA,+)、细胞增殖指数 (Ki-67,+,个别),符合肺微瘤型类癌。结合临床表现,确诊为左肺下叶支气管扩张,肺微瘤型类癌合并PS和肺曲霉菌病。术后给予抗感染、伏立康唑抗霉菌等治疗,病情稳定。切口愈合出院,随访半年无复发。
2 讨论
2.1 肺微瘤型类癌 肺微瘤型类癌是肺神经内分泌细胞(pulmonary neuroendocrine cells,PNECs)局灶性增生并突破气道黏膜上皮基底膜而形成的纤维化结节,结节直径<5 mm,若结节直径≥5 mm则诊断为类癌[1]。该结节可散在多发于一个肺叶或多个肺叶,甚至双肺,多为手术或尸解标本时偶然发现,国内外均罕有报道[2]。肺微瘤型类癌因其病理特征和免疫表型与典型周围型类癌相似,被认为可能是典型类癌发生的早期阶段。由此可见,增生的PNECs、肺微瘤型类癌及典型类癌在形成方面具有一定连续性,其区别主要在于细胞体积大小的不同。
肺微瘤型类癌临床发病率较低,病程缓慢。早期病灶体积较小,影像学检查和常规病理取材很难发现,因此临床上容易漏诊或误诊。随着病程的发展,增生的PNECs造成气道狭窄、阻塞或并发炎性反应,患者表现为干咳、气促或缓慢进行性呼吸困难,肺功能检查提示为不可逆的气流阻塞。X线、CT影像学检查主要表现为单个或多个广泛的结节样阴影[2-5],同时伴肺间质性炎症、支气管壁增厚、小结节样改变或支气管扩张[6]。微瘤型类癌的诊断主要依靠病理和免疫组化检查。病理检查:镜下瘤细胞大小较一致,胞质较少,核圆形、卵圆形或短梭形,核深染或呈细颗粒状,核仁不明显。瘤细胞常在肺实质及肺泡腔内形成多灶性细胞巢或小圆形结节,呈浸润性生长,细胞无异型性或轻度异型性,核分裂象少见,未见明显坏死。免疫组化:特征性分子标记物Syn和CgA的检查是诊断神经内分泌肿瘤的必备条件;其他可选用的标记物还有神经元特异性烯醇化酶 (NSE)和CD56等,虽然敏感性较高,但特异性较差;Ki-67低表达或阳性率 <5%[7-8]。肺微瘤型类癌需与支气管内黏液栓、曲菌球、弥漫性特发性肺神经内分泌细胞增生 (diffuse idiopathic pulmonary neuroendocrine cell hyperplasia,DIPNECH)及小细胞肺癌进行鉴别。(1)支气管内黏液栓:增强CT显示密度较低,多沿支气管走向形成囊、柱状阴影;经纤支镜检查或灌洗后,囊、柱状影减小或消失;(2)曲菌球:CT增强扫描后无强化,体积比微瘤型类癌稍大;(3)DIPNECH:增生的PNECs沿支气管呈线状排列,未穿透黏膜上皮基底膜;(4)小细胞肺癌:细胞呈多形性,核分裂活跃,有坏死灶,病理细胞学检查可鉴别。
临床医生应提高警惕,对于支气管扩张或囊肿病变患者,应尽早行高分辨增强CT检查,排除肺内结节样病变,提高该病检出率。肺微瘤型类癌生长缓慢,很少发生转移,治疗方法首选外科手术切除,术后无需化疗、放疗,且预后较好[9]。
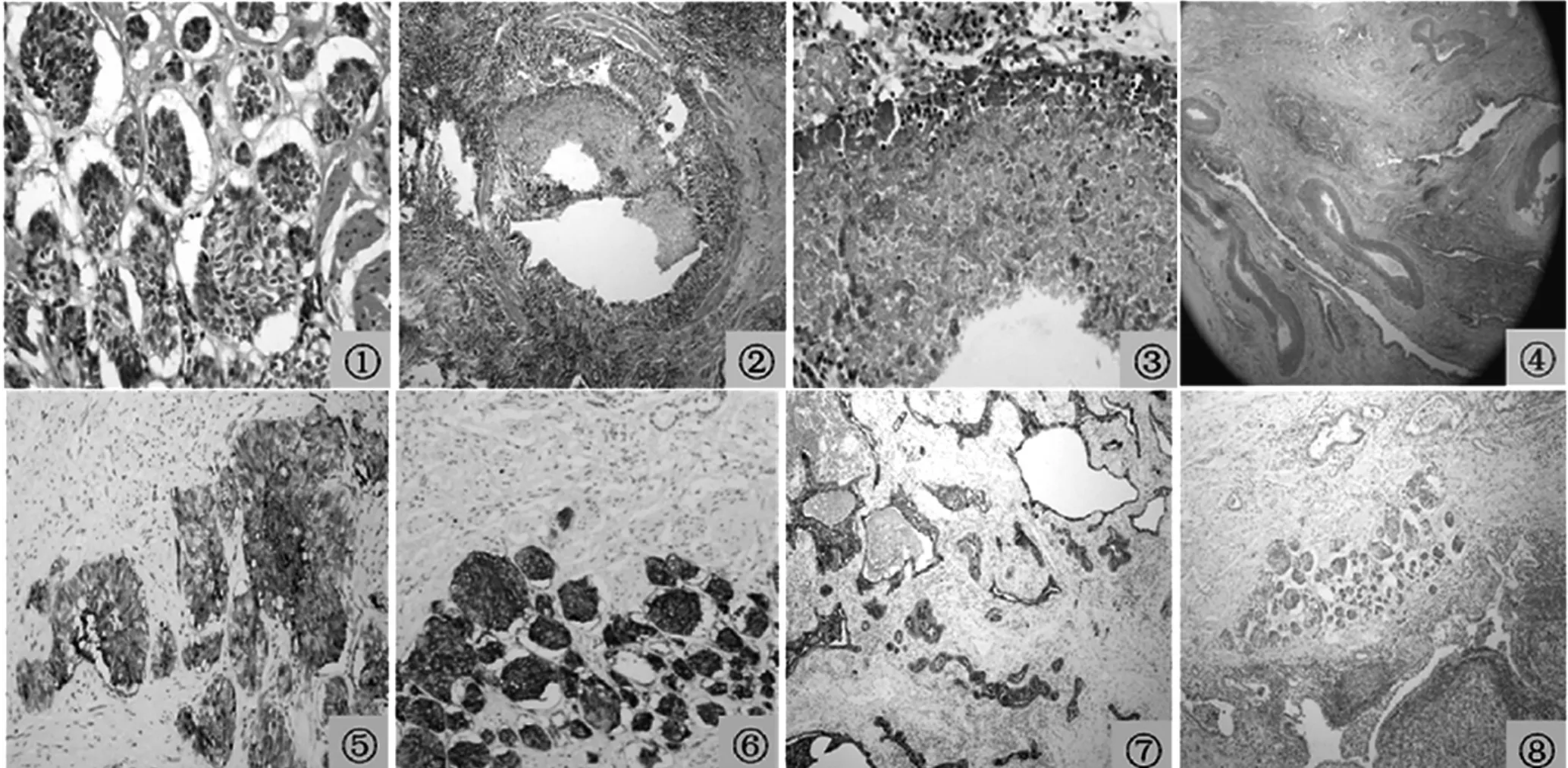
图1 肺微瘤型类癌合并肺隔离症和肺曲霉菌病病理组织切片Figure 1 The pathologic tissue section of pulmonary carcinoid tumourlets with pulmonary sequestration and aspergillus
2.2 PS PS是临床少见先天性肺发育畸形,1777年Huber首次报道了1例源于主动脉供血的肺囊肿病例,1861年Rokitansky将这种病理表现描述为“附属肺叶”[10]。之后 Peyce[11]报道 7 例由主动脉分支直接供血并与正常肺组织分离的肺部病变,最终将本病命名为PS。隔离肺组织与正常气管、支气管不相通,其血供来自体循环的血管,常为胸主动脉、腹主动脉的单支或多支异常动脉。PS包括叶内型 PS(intralobarpulmonary sequestration,ILS)和 叶 外 型 PS(extralobar pulmonary sequestration,ELS)。ILS较常见,好发于双肺下叶,以左肺下叶最为常见[12]。
若隔离肺组织与正常支气管有病理性相通,常会继发感染,引起反复咳嗽、咳痰、咯血及发热等症状。长期慢性炎症改变,反复加重、迁延不愈,可导致肺纤维组织增生、实质改变或机化等。影像学检查多样性,临床诊断较难,易误诊。PS的诊断金标准为选择性血管数字减影(DSA),但由于其为有创检查,风险较大,在临床上逐渐被增强CT联合三维重建影像技术所取代。增强CT联合三维重建影像技术有较好的临床实用价值,可立体显示供血动脉的起源及行程,有利于手术方案的制定。
PS在治疗上,首选手术切除。目前PS约占肺先天性畸形的0.15%~6.45%,占肺切除的1.1%~1.8%,外科手术发现率约为1.5%[13]。术中完整切除病变肺组织,结扎供血血管,防止大出血是手术的关键。
2.3 肺微瘤型类癌合并PS 在隔离肺组织中发现微瘤型类癌的报道很少,目前国内外共有报道6例,国外5例,国内1例(本例)。其中男4例,女2例。其临床表现无特异性,主要以反复咳嗽、咳痰及咯血为主,多数伴支气管扩张。本例患者临床症状为咳嗽、咳痰,胸部CT检查提示左肺下叶囊肿。经手术治疗,诊断为ILS合并微瘤型类癌和肺曲霉菌病。回顾文献,Pelosi等[14]首次报道1例在 ILS隔离肺组织封存的瘢痕组织中发现数以百计的大量类癌微瘤细胞。Dewan等[15]报道1例肺微瘤型类癌合并弥漫性支气管扩张和PS患者,该患者居住在高海拔地区,因反复肺部感染、进行性呼吸困难及咯血,行左肺下叶切除术后病理证实。Nowak等[16]报道了1例男性患者,既往体健无肺部反复感染病史,因突然大量咯血就诊,胸部CT提示为PS,行外科术后病理证实为类癌,建议根治性治疗方案首选手术切除,而不是栓塞治疗。Masuko等[17]报道1例74岁的女性患者,有类风湿关节炎病史,胸部CT显示右肺下叶囊性病变,考虑支气管扩张,但随访3年后发现该囊性病变明显增大,术前胃泌素释放肽前体 (proGRP)明显升高 (108 pg/ml,参考值为<50 pg/ml),术后确诊为 ILS合并微瘤型类癌,且瘤细胞proGRP表达阳性,随访患者血清proGRP逐渐降至正常水平。Ye等[18]对乳腺癌诊断3年后合并PS及肺微瘤型类癌的病例进行研究,发现乳腺癌和支气管扩张可能共同促使微瘤型类癌的形成,而PS可能是微瘤型类癌形成的第二促发因素。此外,大多数学者认为微瘤型类癌的形成与肺内慢性炎性反应、间质纤维化所造成的组织损伤和瘢痕所导致的低氧有关[2,14,19]。由此可见,肺微瘤型类癌的形成与肺组织的先天发育不良有关,隔离肺组织引起的慢性炎性反应及局部低氧环境可能促进PNECs的增生,形成微瘤型类癌。
2.4 肺曲霉菌病 肺曲霉菌病早期症状缺乏特异性,常表现为咳嗽、咳痰、发热及咯血等,临床常被误诊为支气管扩张、肺结核或肺囊肿等肺部疾病。曲霉菌菌丝与纤维蛋白、溃疡碎片及炎性肉芽肿的形成有关,因此其病变组织易掩盖肺类癌。如曲霉菌引起组织出现坏死性碎片,会增加病理活检的诊断难度,与非典型类癌混淆[20]。
总之,肺微瘤型类癌、PS及肺曲霉菌病引起的肺组织病变具有相同之处,其临床表现及并发症也非常相似,临床医生应进一步加强对该类疾病的认识与管理。对于有咳嗽、咳痰及发热等肺部反复感染病史,感染部位较固定,特别是在左肺下叶基底段,影像学检查提示为囊性病变者,临床医生应警惕PS的存在,尽早行增强CT或血管造影术予以排除。治疗上首选外科手术切除,术后结合病理和免疫组化检查可以确诊。伴曲霉菌感染的患者可同时给予抗真菌药物辅助治疗。
[1]Beasley MB.Pulmonary neuroendocrine tumours and proliferations:a review and update [J].Diagnostic Histopathology,2008,14(10):465-473.
[2]Ozbey N,Bozbora A,Kalaycl G,et al.Cushing'ssyndrome caused by ectopic corticotrophin secretion by multiple peripheral pulmonary carcinoids and tumorlets of carcinoid type[J].J Endocrinol Invest,2000,23(8):536-541.
[3]Cameron CM,Roberts F,Connell J,et al.Diffuse idiopathic pulmonary neuroendocrine cell hyperplasia:an unusual cause of cyclical ectopic adrenocorticotrophic syndrome [J].Br J Radiol,2011,84(997):e14 -17.
[4]Lebras L,Arpin D,Collardeau - Frachon S, et al.Diffuse idiopathic pulmonary neuroendocrine cellhyperplasia:a rare preneoplastic condition[J].Revue Des Maladies Respiratoires,2008,25(9):1131-1135.
[5]Aubry MC,Thomas CF,Jett JR,et al.Significance of multiple carcinoid tumors and tumorlets in surgical lung specimens:analysis of 28 patients [J].Chest Journal,2007,131(6):1635-1643.
[6]Koo CW,Baliff JP,Torigian DA,et al.Spectrum of pulmonary neuroendocrine cell proliferation:diffuse idiopathic pulmonary neuroendocrine cell hyperplasia, tumorlet,and carcinoids[J].American Journal of Roentgenology, 2010, 195(3):661-668.
[7]Sartelet H,Decaussin M,Devouassoux G,et al.Expression ofvascular endothelial growth factor(VEGF)and its receptors(VEGF-R1[Flt-1]and VEGF-R2[KDR/Flk - 1])intumorlets andin neuroendocrine cell hyperplasia of the lung[J].Hum Pathol,2004,35(21):1210-1217.
[8]Liang HQ,Zeng QS,Yuan GQ,et al.An analysis of the CT manifestations and pathologic features of pulmonary carcinoid tumourlets[J].Chinese Journal of Radiology,2013,47(11):1041-1042.(in Chinese)
梁辉清,曾庆思,袁国奇,等.肺微瘤型类癌的CT表现及病理分析[J].中华放射学杂志,2013,47(11):1041-1042.
[9]Huo Z,Shi XH,Cui QC,et al.Pulmonary neuroendocrine cell hyperplasia and tumorlets in bronchiectasis:a clinicopathologic study of 22 cases with review of literature [J].Chinese Journal Pathology,2012,41(8):525-529.(in Chinese)
霍真,师晓华,崔全才,等.肺支气管扩张症伴发肺神经内分泌细胞增生及微小瘤形成临床病理学观察 [J].中华病理学杂志,2012,41(8):525-529.
[10]Zheng HS,Fu JH.The development of diagnosis and therapeutics of pulmonary sequestration[J].Practical Journal of Medicine,2013,30(1):86-88.
[11]Peyce DM.Lower accessory pulmonary artery with intralobarsequestration oflung:a report of seven cases[J].The Journal of Pathology and Bacteriology, 1946, 58(3):457-467.
[12]Cheng BJ,Gao J,Li WM,et al.An analysis of the clinicopathological features and misdiagnosis of 16 adults pulmonary sequestration[J].Chinese Journalof Internal Medicine,2012,51(1):42-45.
[13]Kestenholz PB,Schneiter D,Hillinger S,et al.Thoracoscopic treatment of pulmonary sequestration[J].European Journal of Cardio-thoracic Surgery,2006,29(5):815-818.
[14]Pelosi G,Zancanaro C,Sbabo L,et al.Development of innumerable neuroendocrine tumorletsin pulmonary lobe scarred by intralobar sequestration.Immunohistochemical and ultrastructural study of an unusual case[J].Archives of Pathology & Laboratory Medicine, 1992, 116 (11):1167-1174.
[15]DewanM,MalataniTS, OsinowoO,et al.Lessons to be learned:a case study approach carcinoid tumourlets associated with diffuse bronchiectasis and intralobar sequestration[J].The Journal of The Royal Society for the Promotion of Health,2000,120(3):192-195.
[16]Nowak K,vonder Thüsen J,Karenovics W,et al.Pulmonary sequestration with haemoptysis and an unsuspected carcinoid tumour[J].General Thoracic and Cardiovascular Surgery,2013,61(8):479-482.
[17]Masuko H,Satoh H,Miyazaki K,et al.Pulmonary sequestration with elevated serum level of progastrin-releasing peptide[J].Internal Medicine,2007,47(3):157-160.
[18]Ye Y,Mu Z,Wu D,et al.Carcinoid tumorlet in pulmonary sequestration with bronchiectasis after breast cancer:a case report[J].Oncology Letters,2013,5(5):1546-1548.
[19]Wang JC,Shi DR,Fu XL,et al.Analysis of clinicopathologic features and morphogenesis of carcinoid tumorlets in the lung with bronchiectasis[J].Chinese Journal of Pathology,2003,32(4):350-353.(in Chinese)
王军臣,施达仁,符雪莲,等.肺类癌型微小瘤的临床病理及其形态发生分析[J].中华病理学杂志,2003,32(4):350-353.
[20]Nilsson JR,Restrepo CS,Jagirdar J.Two cases of endobronchial carcinoid masked by superimposed aspergillosis:a review of the literature of primary lung cancers associated with Aspergillus[J].Annals of Diagnostic Pathology,2013,17(1):131-136.
