黄芪多糖对红细胞调控T 淋巴细胞增殖的影响
2015-06-11马骞寰姜俊兵范阔海孙耀贵杨丽华李宏全
尹 伟,马骞寰,姜俊兵,范阔海,孙 娜,孙耀贵,杨丽华,李宏全*
(1.山西农业大学动物科技学院,山西太谷030801;2.东营佛思特生物工程有限公司,山东东营257091;3.山西省农业科学院畜牧兽医研究所,山西太原030032)
自1981年美国学者Siegel提出“红细胞免疫系统(red-cell immune system,RCIS)”的新概念以来,已证实红细胞具有很多免疫相关物质,使红细胞不仅具有识别、黏附、杀伤抗原及传递抗原信息和清除免疫复合物(immune complex,IC)等能力,还能调理吞噬、抑制补体活化,参与机体的免疫调控,并有完整的自我调控系统。因此,红细胞免疫功能的变化与机体疾病的发生、发展及免疫状态有高度相关性[1-5],寻求提高红细胞免疫功能的活性物质在临床上具有重要意义。
早在1962年,Cartstairs就首次报道自体红细胞对植物血凝素P(phytohenag ylatinin,PHA-P)刺激的人淋巴细胞增殖有影响,红细胞有利于人淋巴细胞的培养。Arosa F A 等[6]认为红细胞是T 细胞活性调节器,红细胞可促进人外周血T 淋巴细胞存活并能抑制激活介导的细胞死亡和氧化应激,并设想可以通过平衡红细胞免疫活性来改善T 淋巴细胞活性,达到临床治疗某些疾病的目的,越来越引起广大研究者的关注。虽然许多研究证实了红细胞上相关免疫物质参与T 淋巴细胞的调控,但其免疫调控的机理研究尚不完全清楚。近年来,国外己建立了许多测定红细胞调控淋巴细胞免疫功能的细胞培养法,研究红细胞对T 淋巴细胞免疫功能的调控作用与机理。国内虽然有一些实验室开展了红细胞调控淋巴细胞免疫功能的试验研究,但相关研究方法亟待向规范化、标准化和定量、精确化方向发展。同时,国内外关于外源性物质调控红细胞影响淋巴细胞增殖、分化的研究尚近乎空白。
黄芪多糖(Astragalus polysaccharides,APS)是中药黄芪(Radix Astragalus)中含量最多、生物活性较强的一种物质,APS调节机体免疫功能的作用机制尚不清楚,但APS对机体细胞免疫和体液免疫有着广泛影响[7]。为此设计本试验,将红细胞与本实验室提取的一种新型APS分别或共同作用于淋巴细胞,探讨APS对红细胞调控机体免疫功能的影响及其效应机制,为拓展APS作为免疫调节剂在临床上的应用提供试验依据。
1 材料与方法
1.1 材料
1.1.1 实验动物 普通昆明(KM)小鼠30只,4周龄~6周龄,雌性,清洁级,体重18g~22g。购自山西医科大学实验动物中心。小鼠饲养在22℃±2℃环境里,自由采食和饮水,自然光照,饲喂1周后开始试验。
1.1.2 药品及试剂 抗凝剂(肝素钠125U/mL)、HANK'S缓冲液、红细胞裂解液(Trise-NH4CL)、RPMI1640为美国GIBCO 公司产品;植物凝集素(PHAP)为美国Sigma公司产品;浓度20g/L台盼兰、二甲基亚砜、四甲基偶氮唑盐(MTT)为北京医药公司产品;胎牛血清(FCS)为杭州四季青生物工程材料有限公司产品;淋巴细胞分离液为中国医学科学院生物工程研究所研制;APS为本实验室提取精制,呈乳白色粉末,分子质量1.1×104ku、纯度97.16%,单糖组成及分子摩尔比为:鼠李糖∶葡糖糖∶半乳糖∶阿拉伯糖=1.19∶72.01∶5.85∶20.95。
1.1.3 试 验 仪 器 酶 标 仪(ZS-2 型),离 心 机(TGL168),恒温培养箱(78-1),超净工作台,微量加样器,无菌过滤器(直径25mm、孔径0.2nm),24孔和96 孔培养板,纯水蒸馏器(SZ-96),生物显微镜(BDS200-PH),流式细胞仪(FACScalibur)。
1.2 方法
1.2.1 试验分组 应用Statistics Analysis System,按重复数为3的4×4双向分组原则完全随机设计,A 因素为外周血/脾脏T 淋巴细胞(T)、外周血/脾脏T 淋巴细胞(T)+植物凝集素(PHA)、外周血/脾脏T 淋巴细胞(T)+红细胞(RBC)、外周血/脾脏T 淋巴细胞(T)+红细胞(RBC)+植物凝集素(PHA),B 因 素 为APS 0g/mL、APS 10g/mL、APS 50g/mL、APS 200g/mL(表1)。

表1 T 淋巴细胞增殖测定方案Table 1 Experimental program for detecting T lymphocyte proliferation
1.2.2 药物配制 PHA 应用液:将5mg PHA 溶于10mL无血清RPMI1640培养液,无菌滤器微孔过滤,分装2 mL/瓶,-40℃冻存备用;APS 应用液:细胞培养用的APS 20mg用2mL 无血清RPMI1640培养液充分溶解后离心,取上清,在无菌超净台内,用5 mL 注射器和无菌过滤器过滤,然后,用含100mL/L胎牛血清的RPMI1640细胞完全培养液稀释成1、5、10mg/mL 3个浓度的应用液。细胞培养体系中加入APS的终浓度分别为0、10、50、200μg/mL。
1.2.3 外周血T 淋巴细胞悬液的制备 ①取9只试验小鼠,分别无菌摘除眼球采集各小鼠眼眶肝素抗凝血,加入等量无血清1640培养液,4℃保存;②吸取淋巴细胞分层液(萄聚糖-泛影葡胺)6mL 置于15mL离心管中,将离心管倾斜45°角;取稀释保存的抗凝血约3mL,在距分层液界面1cm 处沿试管壁缓慢加至分层液上面,应注意保持两者界面清晰,勿使血液混入分层液内;③将离心管置于水平式离心机内在18℃~20℃、2 000r/min离心20min,离心后,管内可分为4层:上层是血浆、血液稀释液及绝大部分的血小板,下层为红细胞及粒细胞,中层为细胞分层液,分层液和血浆交界部位浑浊的灰白色层即为外周血单个核细胞(主要是淋巴细胞);④用毛细管轻轻插入灰白色层,沿管壁轻轻吸出灰白色的单个核细胞,盛入另一离心管,加RPMI1640 维持液重悬;⑤将所得到的外周血单个核细胞悬液用5倍体积的RPMI-1640 洗涤2 次,依次在18℃~25℃环境下以2 000r/min、1 500r/min 离心10 min,去掉大部分混杂的血小板。⑥用完全RPMI-1640(含100mL/L胎牛血清的RPMI-1640)重悬洗涤后的外周血单核细胞,然后接种至培养瓶中,贴壁2h后,取非贴壁细胞(97%以上为T 淋巴细胞),1 000r/min离心10min,重悬于完全RPMI-1640;⑦用完全RPMI-1640定容细胞,计数细胞后再调整细胞至1×106/mL浓度;⑧取2滴细胞悬液加1滴20g/L台盼蓝染液,3min~5min后取样作湿片高倍镜检。活细胞不着色,死亡的细胞染成蓝色。计数200 个细胞,计算活细胞百分率,要求活性在95%以上,备用。⑨将分离得到的9只小鼠的外周血T 淋巴细胞合并用于试验。
1.2.4 脾脏T 淋巴细胞悬液的制备 ①拉颈处死经无菌摘除眼球采血后的小鼠,置700 mL/L 乙醇中浸泡5min,取出后用无菌生理盐水擦洗,无菌棉球擦干;②将小鼠后右侧卧位固定于解剖板上,消毒左侧背腹交界处皮肤,在超净工作台上无菌取出小鼠脾脏,置于盛有Hank's液的平皿中;剔除脾脏表面脂肪及结缔组织,用含抗生素的Hank's液洗净表面血迹后,将脾脏剪成小块,继续用含抗生素的Hanks液冲洗至清亮;③将脾脏小块置于200目滤网上,用灭菌注射器针芯轻轻将其捻碎,同时用RPMI-1640液冲洗,使单个细胞经网进入溶液中,收集网下含脾细胞的冲洗液,注入无菌离心管中,1 500 r/min离心10min,洗涤一次并重悬;④取10mL圆底带盖离心管,预先加好6mL 淋巴细胞分离液,然后缓缓沿管壁将上述脾脏细胞悬液4mL 叠加到分离液上,2 000r/min水平离心20 min;⑤吸取第2层云雾状的低密度细胞,转移入另一离心管中,用Hank's液重悬,在1 500r/min离心10min条件下洗涤两次。⑥去上清后加入预冷的8.3g/L Tris-NH4Cl裂解红细胞1min,重复裂解1次,再用1640液洗2次~3 次,弃上清,混匀。⑦经20g/L 台盼蓝染色,检查死亡细胞数少于5%,再用含100mL/L胎牛血清的RPMI-1640完全培养液(含100 U/mL青霉素,100 U/mL 链霉素)将脾细胞稀释为6×106个/mL的细胞悬液。⑧将分离得到的9只小鼠的脾脏T 淋巴细胞合并用于试验。
1.2.5 红细胞悬液的制备 从上述淋巴细胞分层液离心后的离心管中,小心的吸取沉底的红细胞100μL,加入到2 mL Hanks液中洗涤3 次,离心(2 000r/min)5min,弃上清,计数测活性,光学显微镜下观察证实不含白细胞和血小板后,再用完全RPMI-1640调整红细胞悬液的浓度为1×108/mL。
1.2.6 T 淋巴细胞增殖活性的测定 ①于96孔平底培养板中各孔中加入100μL 相应的细胞与相应剂量的药物(PHA、APS),对照组加培养液,每孔做3个重复孔;外周血或脾脏T 淋巴细胞体系中加入红细胞的数量为红细胞∶T 淋巴细胞=100∶1[8-9];脾脏T 淋巴细胞体系中PHA 的终浓度为1g/mL、外周血T 淋巴细胞为1.25g/mL,APS的终浓度分别为:高浓度200g/mL、中浓度50g/mL、低浓度10g/mL 和0g/mL;各孔用RPMI 1640完全培养液补充总体积至250μL。②将培养板放入37℃、体积分数为5%的CO2的培养箱中培养48h,于终止培养前4h,轻轻从各孔中吸出100μL上清后,每孔加入10mg/mL MTT 溶液10μL,继续培养4h,培养结束后仔细弃去上清,每孔加酸化异丙醇100 μL,充分振荡吹打后静置20 min,用检测波长595 nm 进行检测,用OD 值表示结果。
2 结果
2.1 外周血T 淋巴细胞增殖的检测结果比较
不同细胞培养体系、相同APS作用水平下外周血T 淋巴细胞增殖结果的统计分析显示:在APS为0水平时,除A 体系外,其余各体系中T 淋巴细胞均有不同程度增殖;其中,B-0组增殖水平最高,而C-0与D-0组间差异不显著(P>0.05)。在APS分别为低、中、高3个不同水平时,B、C 和D 体系中相应各组T 淋巴细胞增殖均分别显著高于A 体系(P<0.05)。其中,APS低水平时,C-1组与D-1组组间差异不显著(P>0.05)而均显著高于B-1 组(P<0.05),以D-1组测定值最高;APS中水平时,C-2组与D-2组组间差异不显著(P>0.05)而均显著高于B-2组(P<0.05),以D-2 组测定值最高;APS高水平时,D-3显著高于B-3组和C-3组(P<0.05),而B-3 组 与C-3 组 组 间 差 异 不 显 著(P<0.05)(表2)。
相同细胞培养体系、不同APS作用水平下外周血T 淋巴细胞增殖结果的统计分析显示:在A 体系中,各组间T 淋巴细胞的增殖无统计学差异(P>0.05),但A-0组测定值最低;在B体系中,APS低、中、高水平组间T 淋巴细胞的增殖差异不显著(P>0.05),但均显著低于B-0组(P<0.05),以B-3组测定值最低;在C体系中,APS低、中水平组T 淋巴细胞的增殖组间差异不显著(P>0.05)而显著高于C-0组(P<0.05),APS高水平组与C-0 组差异不显著(P>0.05),以C-2 组测定值最高;在D 体系中,APS 中水平组T 淋巴细胞的增殖显著高于D-0组、D-1组和D-3组(P<0.05),D-0组、D-1组与D-3组组间差异不显著(P>0.05),以D-2组测定值最高(表2、图2)。结果显示,APS不能刺激体外培养的外周血T 淋巴细胞增殖或作用微弱;PHA 和红细胞均能刺激体外培养的外周血T 淋巴细胞增殖,且PHA 的作用显著高于红细胞;APS 与PHA 共同作用于体外培养的外周血T 淋巴细胞时可抑制其增殖,而与红细胞共同作用时可促进其增殖;红细胞与PHA 共同作用于体外培养的外周血T 淋巴细胞时可促进其增殖;APS 的作用不呈浓度依赖性,以50μg/mL剂量作用最强。
2.2 脾脏T 淋巴细胞增殖的检测结果比较
不同细胞培养体系、相同APS作用水平下脾脏T 淋巴细胞增殖结果的统计分析显示:在APS为0水平时,B-0组、C-0组和D-0组T 淋巴细胞增殖均显著高于A-0组(P<0.05),且B-0组显著高于C-0组和D-0组(P<0.05),而C-0与D-0组间差异不显著(P>0.05),但D-0组测定值高于C-0组。在APS分别为低、中和高三个不同水平时,B、C 和D体系中相应各组T 淋巴细胞增殖均分别显著高于A 体系(P<0.05)。其中,APS为低水平时,C-1显著高于B-1和D-1(P<0.05),B-1和D-1组间差异不显著(P>0.05);APS为中水平时,C-2显著高于B-2组和D-2组(P<0.05),而B-2组和D-2组组间差异不显著(P>0.05);APS为高水平时,C-3组显著高于B-3组和D-3组(P<0.05),而B-3组与和D-3组组间差异不显著(P<0.05)(表3、图3)。
相同细胞培养体系、不同APS作用水平下脾脏T 淋巴细胞增殖结果的统计分析显示:在A 体系中,各组间T 淋巴细胞的增殖无统计学差异(P>0.05);在B 体系中,APS低、中和高水平组间T 淋巴细胞的增殖差异不显著(P>0.05),但均显著低于APS为0的B-0组(P<0.05),以APS低剂量组测定值最高;在C体系中,APS低、中水平组T 淋巴细胞的增殖显著高于C-0组(P<0.05),而APS高剂量水平组与C-0组差异不显著(P>0.05),APS低、中、高水平组组间差异不显著(P>0.05),但以APS中剂量组测定值最高;在D 体系中,APS 低剂量组脾脏T 淋巴细胞的增殖与D-0组差异不显著(P>0.05),中剂量显著高于D-0组(P<0.05),低剂量组显著低于D-0组(P<0.05),而APS低、中、高水平组组间差异显著(P<0.05),以D-2组测定值最高(表3)。结果表明,APS、红细胞和PHA 对体外培养脾脏和外周血T 淋巴细胞的作用呈现一致的效应。

表2 不同细胞培养体系外周血T 淋巴细胞增殖测定值Table 2 The detection value of peripheral blood T lymphocyte proliferation in different cell culture systems
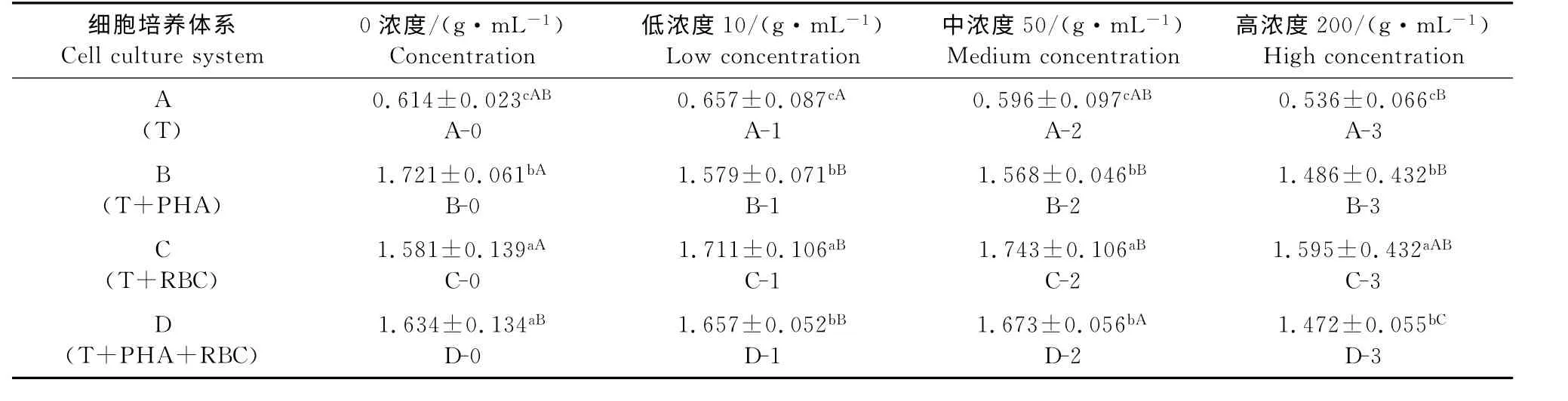
表3 不同细胞培养体系中脾脏T 淋巴细胞增殖测定值Table 3 The detection value of splenic T lymocyte proliferation in different cell culture systems
3 讨论
血液循环系统与淋巴系统之间不仅在组织学上关系密切,在功能上也是相辅相成的。淋巴细胞在中枢淋巴器官发育成熟后,经血流迁移到外周血淋巴器官发挥各种生物学功能,在迁移过程中淋巴细胞会与红细胞不断接触,红细胞上的免疫活性分子就有可能对其增殖转化产生作用。脾脏既是机体最大的外周免疫器官又是机体血库,它给淋巴细胞与红细胞之间的相互作用提供了有利的场所。血液中红细胞的数量与其他各种血细胞相比占绝对优势,这与红细胞功能有关。红细胞免疫研究发现,红细胞具有清除血液中免疫复合物的作用,参与这一功能的红细胞表面分子是C3b受体(CR1)。对红细胞免疫的进一步研究发现红细胞表面存在有CD2分子的配体(CD58、CD59),红细胞内含有NK 细胞刺激因子,这是红细胞体外培养体系中能够刺激T 淋巴细胞、NK 细胞的分子基础,但至今国内研究还对红细胞以何种方式激活淋巴细胞并不清楚,也缺乏相关的研究报道。直到查占山等[8]报道红细胞细胞CD35和血浆补体活性对提高淋巴细胞免疫活性有意义,张佩军等[9]也报道犬红细胞培养上清液对犬淋巴细胞的增殖转化有明显的促进作用。
结合前人的研究,本试验选择了脾脏和外周血两个相关的淋巴细胞增殖反应指标进行研究。研究中发现,红细胞、PHA 单独作用于T 淋巴细胞或者共同作用均能刺激T 淋巴细胞的增殖活性,但二者无协同作用,这些因素能使T 细胞对刺激的敏感性增强,从而使OD 值变化急剧,表明体外培养48h,红细胞有类似于PHA 的功效,它能促进脾脏T 淋巴细胞和外周血T 淋巴细胞的增殖活性。查占山等[8]研究了健康成人红细胞CD35在灭活腹水癌细胞S180激活淋巴细胞免疫反应中的作用,在单抗阻断红细胞CD35或EDTA 破坏补体后,T 淋巴细胞CD25的表达显著降低,表明红细胞CD35和血浆补体对抗原激活淋巴细胞免疫反应起着重要的调控作用,本试验T 淋巴细胞体外培养体系中不存在有致病原(抗原)或抗原抗体复合物,因此红细胞上不会粘附有CD35-C3b复合物,说明红细胞促进T 淋巴细胞的增殖存在有多种机制,可能红细胞CD58、CD59与淋巴细胞CD2的结合促进了淋巴细胞在增殖,并且这种结合不需要CD35粘附免疫复合物的介导。
同时试验中发现APS的添加会影响各体系中的T 淋巴细胞的增殖活性,APS作用于无红细胞试验体系时,APS 不能刺激体外培养的外周血、脾脏T 淋巴细胞增值或作用微弱;在PHA 激活组,APS不仅不能够促进体外培养T 淋巴细胞增殖活化,而且还抑制PHA 诱导的T 淋巴细胞的增殖活性。孔祥峰等对APS 的免疫调节作用进行了综述:APS均可降低脾脏T 细胞对ConA 和PHA 的应答反应,其作用随浓度增大而加强,这说明APS对T 细胞的功能有抑制作用[10],本试验结果与其一致。但胡庭俊等报道,APS能使小鼠脾淋巴细胞PKC(蛋白激酶)活性明显升高,可增加PHA 诱导的小鼠体内淋巴细胞的转化率及小鼠外周淋巴细胞酸性非特异性酯酶(ANAE)活性细胞的阳性率[11],张华玉等[12]通过给7 日龄正常雏鸡注射APS 进行研究,发现APS注射液组淋巴细胞数量及ANAE 染色阳性淋巴细胞的百分率显著增高,提示APS注射液对雏鸡外周血液中的淋巴细胞数量和T 淋巴细胞的百分率有明显的增进作用。说明APS必须经过体内的外代谢环节才能参与淋巴细胞的分化与成熟。
APS和红细胞共同作用于本试验体系时,在一定浓度范围内APS可协同红细胞促进T 淋巴细胞的增殖活性,且对PHA 激活T 淋巴细胞的促进作用最为明显,在中剂量水平(50μg/mL)效果最佳,在脾脏和外周T 淋巴细胞的试验体系中得到一致的效果。李宏全等[13]研究证实,人工感染传染性法氏囊病毒(IBDV)雏鸡红细胞免疫粘附功能显著下降,肌肉注射APS可显著恢复雏鸡红细胞免疫功能并促进免疫复合物的清除,结合本试验的结果,提示APS有可能通过增强红细胞与T 淋巴细胞的黏附而促进淋巴细胞的增殖。APS 作为一种传统的免疫调节药物,它影响了红细胞对淋巴细胞的调节作用,使红细胞对淋巴细胞的调节功能趋于缓和,而且红细胞的免疫调节作用随着APS浓度的变化而变化,中浓度时效果最好。APS与红细胞的这种协同作用,对外周血和脾脏淋巴细胞增殖作用的效果一致,由此得出结论:在体外试验中,在同一种属内,红细胞对外周血和脾脏的T 淋巴细胞增殖的免疫效应有刺激作用,红细胞能够使淋巴细胞对外援刺激的敏感性增强。同时本试验证明了APS能够协助红细胞对淋巴细胞进行免疫调控,两者共同作用,引起淋巴细胞数目的增加和增殖功能的增强,从而促进细胞免疫功能,但是APS 单独做刺激或者与PHA 共同刺激时,不能促进T 淋巴细胞的增殖,故此推测APS可以通过调节红细胞的免疫功能间接的促进了T 淋巴细胞的增殖活性。
综上所述,本试验研究结果表明小鼠红细胞、PHA 单独作用对T 淋巴细胞的增殖均有显著的促进作用,且红细胞对PHA 激活的T 淋巴细胞的增殖也有促进作用,但是二者没有明显的协同促进作用;黄芪多糖不能够促进体外培养T 淋巴细胞增殖活化,甚至还抑制PHA 诱导的T 淋巴细胞的增殖活性;黄芪多糖能够协助红细胞对淋巴细胞的免疫调控功能,双方共同作用,引起淋巴细胞数目的增加和增殖功能的增强从而促进细胞免疫功能。
[1] Kremlitzka M,Polgar A,Fulop L,et al.Complement receptor type 1(CR1,CD35)is a potent inhibitor of B-cell functions in rheumatoid arthritis patients[J].Int Immunol,2012,25(1):25-33.
[2] Anand D,Kumar U,Kanjilal M,et al.Leucocyte complement receptor 1(CR1/CD35)transcript and its correlation with the clinical disease activity in rheumatoid arthritis patients[J].Clin Exp Immunol,2014,176(3):327-335.
[3] Congbin Y,Aibin L,Congli Y,et al.Overexpression of complement receptor type I(CR1,CD35)on erythrocytes in patients with hemoplasma infection[J].Microbiol Immunol,2010,54(8):460-465.
[4] Carlisle R C,Di Y,Cerny A M,et al.Human erythrocytes bind and inactivate type 5adenovirus by presenting Coxsackie virus-adenovirus receptor and complement receptor 1[J].Blood,2009,113(9):1909-1918.
[5] Ogembo J G,Kannan L,Ghiran I,et al.Human complement receptor type 1/CD35is an Epstein-Barr virus receptor[J].Cell Rep,2013,3(2):371-385.
[6] Arosa,F A,Pereira,C F,Fonseca,A M.Red blood cells as modulators of T cell growth and survival[J].Cur Pharmaceut Design,2004,10(2),191-201.
[7] 任 敏,张晓静.黄芪多糖对断奶仔猪免疫功能的影响[J].郑州牧业工程高等专科学校学报,2006,26(1):7-9.
[8] 查占山,钱宝华,郭 峰.红细胞CD35在抗原激活淋巴细胞免疫反应中的作用[J].解放军医学杂志,2006,31(2):104-106.
[9] 张佩君,白丽丽,乔 琦,等.犬红细胞培养上清液对淋巴细胞增殖的影响[J].西北农林科技大学学报:自然科学版,2007,35(4):51-59.
[10] 孔祥峰,胡元亮,宋大鲁,等.黄芪多糖的免疫药理学研究进展[J].中兽医学杂志,2003(3):34-37.
[11] 胡庭俊,程富胜.黄芪多糖对小鼠免疫细胞信号转导相关分子的影响[J].畜牧兽医学报,2005,36(6):616-619.
[12] 张华玉,陈建杰,陶宏卫.黄芪多糖注射液(APS)对雏鸡淋巴细胞免疫功能的影响[J].畜牧兽医科技信息,2007(5):1.
[13] Li H Q,Reeve-Johnson L,Wang J D.Effect of Astragalus polysaccharides on erythrocyte immune adherence of chickens inoculated with infectious bursal disease virus[J].Agri Sci China,2007,6(11):1402-1408.
