毛细管柱内在线反应化学发光测定抗坏血酸
2015-06-10杨维平郑行望
杨维平,郑行望
(1 陕西师范大学 民族教育学院,陕西 西安 710062;2 陕西师范大学 化学化工学院,陕西 西安 710119)
毛细管柱内在线反应化学发光测定抗坏血酸
杨维平1,郑行望2
(1 陕西师范大学 民族教育学院,陕西 西安 710062;2 陕西师范大学 化学化工学院,陕西 西安 710119)
建立了一种毛细管柱内反应毛细管区带电泳分离化学发光检测痕量抗坏血酸的新方法。方法基于酸性重铬酸钾在毛细管柱内与抗坏血酸发生氧化还原反应生成具有化学发光催化活性的Cr(Ⅲ), 通过毛细管电泳分离化学发光法检测Cr(Ⅲ)间接地测定抗坏血酸的含量。电泳缓冲液由0.02 mol/L HAc-NaAc (pH 4.7) 和1×10-3mol/L EDTA溶液组成。对影响分离和检测的各参数都进行了优化实验。抗坏血酸检测限(3σ)为6×10-11mol/L。该方法具有简单、灵敏度高、选择性好等特点,可用于血液中痕量抗坏血酸的测定。
毛细管电泳; 化学发光; 抗坏血酸; 柱内还原
抗坏血酸(维生素C)是一种重要的维生素,其参与一系列重大的生理过程并涉及电子转移反应,胶原蛋白的形成,抗氧化剂活性,铁的吸收,细胞化合物的合成,羟基化作用以及芳香氨基酸的氧化分解代谢作用等。抗坏血酸的测定在临床上,药物以及食品应用上均具有重大的意义。抗坏血酸的检测通常的方法有:酶催化动力学光度法[1], 荧光动力学法[2-3],毛细管电泳(CE)法[4]等。近年来,化学发光法(CL)测定抗坏血酸已有报道[5-7],然而,化学发光法的缺点主要体现在缺乏选择性。将高效率的毛细管电泳(CE)分离技术结合高灵敏度的(电)化学发光检测已成为一种有效的分析方法[8]。
毛细管柱内电泳反应是指在高压电场的作用下,利用分析物区带在毛细管柱内的迁移速度与反应物质区带的迁移速度不同,迁移速度大的物质区带进入迁移速度小的物质区带时, 两个区带物质间相互作用生成新物质的反应。其特点是反应过程在毛细管柱内在线完成并且与毛细管电泳的分离过程同时进行。由于毛细管柱内(In-capillary)反应技术较常规的毛细管柱前 (Pre-capillary) 或毛细管柱后 (Post-capillary)反应技术在重现性及灵敏度等方面均显示出优越性,因而受到极大的关注[9-12]。本工作提出了一种毛细管柱内反应-化学发光测定痕量抗坏血酸的新方法。采用毛细管柱内区带穿通技术(Zone-passing Technique),通过酸性重铬酸钾与抗坏血酸在毛细管柱内在线反应生成Cr(Ⅲ)离子,利用Cr(Ⅲ)离子催化Luminol-H2O2化学发光体系反应,实现柱后抗坏血酸的检测。此方法测定抗坏血酸快速,简便,灵敏度高,所得结果令人满意。
1 实验部分
1.1 仪器与试剂
毛细管电泳-化学发光分析仪由陕西师范大学化学化工学院实验室组装(图1所示)。IFFM-A型化学数据采集分析系统(西安瑞迈电子科技有限公司)。毛细管(河北永年光纤厂):分离毛细管60 cm×75 μm I.D.;反应毛细管15 cm×530 μm I.D.;发光剂注射毛细管25 cm×250 μm I.D.。高速离心机(德国 Hermle 公司);微超滤管(德国 Hermle 公司)。新毛细管使用前用0.1 mol/L NaOH、0.1 mol/L HCl各冲洗10 min,然后再用二次蒸馏水冲洗,注入电泳缓冲液, 静置24 h后备用。
鲁米诺(分析纯,陕西师范大学化学化工学院)5.0×10-2mol/L;过氧化氢(优级纯,上海桃浦化工厂)0.1 mol/L;抗坏血酸(分析纯,西安化学试剂厂)配制成1×10-2moL/L的标准储备液;NaOH-NaHCO3缓冲液:0.1 moL/L,用前稀释适当浓度;HCl溶液:1 mol/L。
化学发光试剂:由0.1 mol/LNaBr、1×10-4mol/L EDTA、1×10-4mol/L的鲁米诺以及1×10-2mol/L过氧化氢溶液的NaHCO3-NaOH的缓冲液(pH 11.5)组成的混合溶液。化学发光试剂溶液通过气动毛细管均匀地注入反应毛细管中。电解缓冲溶液:含1×10-3mol/L EDTA的0.02 mol/L的HAc-NaAc缓冲液。
所有的溶液都用0.45 μm的膜过滤并用超声处理过。
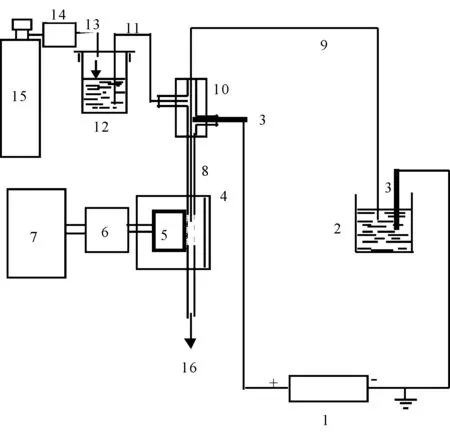
图1 毛细管电泳-化学发光分析仪示意图Fig. 1 Schematic diagram of the CE-CL detector system
1.高压电源;2.电解槽;3.Pt电极;4.检测室;5.光电倍增管;6.放大器;7.计算机;8.反应毛细管;9.电泳毛细管;10.T型连接管;11.CL试剂毛细管;12.CL试剂;13.气流管;14.气流控制系统;15.N2高压瓶;16.废液。
1.2 实验方法

2 结果与讨论
2.1 CE在线分离模式

2Cr3++3C6H6O6+7H2O。


图2 在线柱内反应和毛细管电泳分离模式Fig.2 The procedures of online in-capillary reaction and CE separation
a. 柱端溶液注入顺序:样品,盐酸,重铬酸钾; b. 在电场作用下,样品与酸性重铬酸钾柱内反应生成Cr(Ⅲ)离子的过程。
2.2 分离条件的选择
实验采用NaAc-HAc作为电解缓冲液,研究了其浓度及pH值对分离效果的影响。结果表明,随着NaAc-HAc浓度的增加,分离度也随着增加,但浓度过大时,因保留时间也随之增加导致分子扩散引起峰展宽,分离度反而下降,因此选择NaAc-HAc的浓度为20 mmol/L。pH值为3~6时,随着pH的增加,分离度增大,但pH值过大时,体系的离子强度增大,导致基线不稳,不利于检测;所以选用pH=5.5左右。又研究了电泳电压对分离效果的影响,实验结果表明,电压较低时,分离时间长;随着电泳电压的增大,电流值也随之增大,体系的焦耳热明显增大,影响分离的重现性和检测。本实验采用的分离电压为15 kV。
2.3 化学发光条件的选择
2.3.1 Luminol溶液及其pH值的影响 实验表明,当采用NaOH-NaHCO3缓冲溶液作介质时,体系稳定性好,且当pH值在11.5左右时,发光强度最好,故本实验选用pH值为11.5的NaOH-NaHCO3缓冲溶液作为Luminol及化学发光反应的介质。
2.3.2 发光试剂浓度的影响及其稳定性 实验表明,随着鲁米诺浓度的增加,发光信号增强。当鲁米诺浓度为5×10-4mol/L, 发光信号最强,再继续增大鲁米诺浓度,发光信号反而降低。实验表明,随H2O2浓度改变出现最大峰值发光信号对应的H2O2浓度为0.01 mol/L。对发光反应试剂的稳定性进行考察,实验表明,鲁米诺与过氧化氢的混合溶液在10 h内对反应发光强度的测定无影响,超过10 h后发光强度值略有降低。而发光反应试剂稳定在10 h以内足以满足分析测试所需的时间。

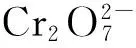

图3 空白液(a)和抗坏血酸(b)的电泳图谱Fig.3 The electrophoregrams for the blank(a) and ascorbic acid(b)
2.4 干扰实验
实验表明,在以20 mmol/L HAc-NaAc及1×10-3mol/L EDTA为电解液的电泳体系中,对于1×10-9mol/L浓度的抗坏血酸溶液,常见金属离子的干扰情况如下:1 000倍量的Pb2+、Ca2+、Al3+、Hg2+,100倍量的Ni2+、Zn2+、Cd2+、Mg2+、Ba2+、Mo(Ⅵ)、Cu2+、Mn2+、Fe3+不干扰测定,1倍量的Cr3+产生正峰,但其迁移时间先于抗坏血酸,因而不干扰抗坏血酸的测定。
2.5 工作曲线、检测限和精密度
在最佳条件下, 测定抗坏血酸的线性范围为1.0×10-10~1.0×10-8mol/L, 线性方程为Y=53.1+1.78×1010X, 相关系数R=0.993。抗坏血酸的检测限为6.0×10-11mol/L。对1×10-9mol/L 的抗坏血酸进行5次测定,迁移时间的相对标准偏差(%)为2.6, 峰高的相对标准偏差(%)为4.5。
2.6 分析方法的应用
取2 mL健康成人血样于微超滤离心管中,在离心机上以10 000 r/min离心10 min后,血浆中的蛋白质等大分子被超滤除去,得到无色血清,然后按实验方法测定血清中抗坏血酸的含量。样品图谱如图4。分析结果列于表1。

图4 血清样品电泳图谱Fig.4 The electrophoregram for the blood serum a.未知峰;b.抗坏血酸峰。

表1 血样中抗坏血酸的测定值*Tab.1 Determination of ascorbic acid in blood serum
*三次实验结果的平均值;D为相对标准偏差。
3 结论
建立了一种毛细管电泳柱内反应-化学发光检测血样中痕量抗坏血酸的新方法。此方法利用毛细管电泳分离的同时,在毛细管柱内以Cr(Ⅵ)作为氧化剂在线氧化抗坏血酸生成对Luminol-H2O2化学发光体系具有催化活性的Cr(Ⅲ)离子,进而柱后间接测定抗坏血酸。此方法用于血样中抗坏血酸的测定,灵敏度高,选择性好,所得结果令人满意。
[1] 张建夫,陈亚红,田丰收,等.酶催化动力学光度法测定抗坏血酸[J].光谱实验室,2010,27(1):213-216.
[2] 陈志兵,史洪伟,王红艳.抑制荧光动力学法测定痕量抗坏血酸[J].分析试验室,2010,29(6):38-40.
[3] 贾华丽,任凯.动力学荧光法测定抗坏血酸[J].光谱实验室, 2011,28(4):1702-1705.
[4] Wang X L, Li L J, Li Z Y, et al. Determination of ascorbic acid in individual liver cancer cells by capillary electrophoresis with a platinum nanoparticles modified electrode[J].Journal of Electroanalytical Chemistry,2014,712(1):139-145.
[5] 吴雄志,王立红,吕晓惠.鲁米诺-溴酸钾体系增敏化学发光法测定抗坏血酸[J].分析试验室,2010,29(6):101-104.
[6] 王虹,杜建修.MnO2纳米溶胶-抗坏血酸化学发光反应的研究[J].分析试验室, 2010,29(12):43-46.
[7] Dong Y P, Gao T T, Chu X F, et al. Flow injection-chemiluminescence determination of ascorbic acid based on luminol-ferricyanide-gold nanoparticles system[J].Journal of Luminescence,2014,154:350-355.
[8] Tao Y W, Zhang X J, Wang J W, et al.Simultaneous determination of cysteine, ascorbic acid and uric acid by capillary electrophoresis with electrochemiluminescence[J].Journal of Electroanalytical Chemistry, 2012, 674(1): 65-70.
[9] Taga A, Suzuki S, Honda S.Capillary electrophoretic analysis of carbohydrates derivatized by in-capillary condensation with 1-phenyl-3-methyl-5-pyrazolone[J]. Journal of Chromatography A,2001,911(2):259-267.
[10] Jankovskiene G, Daunoravicius Z, Padarauskas A. Capillary electrophoretic determination of sulfite using the zone-passing technique of in-capillary derivatization[J]. Journal of Chromatography A,2001,934(1/2):67-73.
[11] Latorre R M, Hernández-Cassou S, Saurina J. Strategies for in-capillary derivatization of amino acids in capillary electrophoresis using 1,2-naphthoquinone-4-sulfonate as a labeling reagent[J]. Journal of Chromatography A,2001,934(1/2):105-112.
[12] Yang W P, Zhang Z Z, Deng W. Speciation of chromium by in-capillary reaction capillary electrophoresis with chemiluminescence detection[J]. Journal of Chromatography A, 2003, 1014: 203-214.
〔责任编辑 王 勇〕
Determination of ascorbic acid based on the combination of capillary electrophoresis and chemiluminescence
YANG Weiping1,ZHENG Xingwang2
(1 School of Ethnic Education,Shaanxi Normal University, Xi′an 710062, Shaanxi, China; 2 School of Chemistry and Chemical Engineering, Shaanxi Normal University, Xi′an 710119, Shaanxi, China)
A sensitive method for the determination of ascorbic acid based on the combination of electrophoresis separation and chemiluminescence was developed.The method was based on the reduction of Cr(Ⅵ) to Cr(Ⅲ) with ascorbic acid occurring inside the capillary and the light emission produced by luminol oxidation by hydrogen peroxide in basic aqueous solution catalyzed by Cr(Ⅲ).Running buffer was composed of 0.02 mol/L HAc-NaAc (pH 4.7) with 1×10-3mol/L EDTA,and parameters affecting CE-CL separation and detection were optimized.The limit of detection for ascorbic acid (3σ) was 6×10-11mol/L.This method offered potential advantages of simplicity, sensitivity, selectivity and applicability to the determination of ascorbic acid in blood samples.
capillary electrophoresis; chemiluminescence; ascorbic acid; in-capillary reaction
1672-4291(2015)03-0043-04
10.15983/j.cnki.jsnu.2015.03.331
2014-12-20
国家自然科学基金资助项目(111752670)
杨维平,男,教授,主要研究方向为毛细管电泳及发光分析。E-mail:wpy@snnu.edu.cn
O657.3
A
