3种葱属蔬菜水提物、醇提物与多糖的抗氧化活性研究
2015-06-10张华峰陈文杰黎梅雨
李 璐,姚 美, 张华峰,陈文杰,黎梅雨
(药用资源与天然药物化学教育部重点实验室,西北濒危药材资源开发国家工程实验室,陕西师范大学 食品工程与营养科学学院,陕西 西安 710119)
3种葱属蔬菜水提物、醇提物与多糖的抗氧化活性研究
李 璐,姚 美, 张华峰*,陈文杰,黎梅雨
(药用资源与天然药物化学教育部重点实验室,西北濒危药材资源开发国家工程实验室,陕西师范大学 食品工程与营养科学学院,陕西 西安 710119)
提取得到了韭菜(Alliumtuberosum)、大葱(Alliumfistulosum)和小葱(Alliumascalonicum)3种葱属蔬菜的水提物、醇提物与多糖,采用苯酚-硫酸比色法测定了3种葱属蔬菜的多糖含量,采用ABTS[2,2-联氮-二(3-乙基-苯并噻唑-6-磺酸)二铵盐]和DPPH(1,1-二苯基-2-三硝基苯肼)方法比较研究了3种葱属蔬菜水提物、醇提物和多糖的抗氧化活性。结果表明,韭菜、大葱和小葱多糖含量的平均值分别为11.40%、22.57%和15.97%。韭菜、大葱、小葱的水提物、醇提物和多糖均具有抗氧化活性,基于量效关系建立的数学模型具有较高的拟合度。3种葱属蔬菜醇提物、水提物的抗氧化活性明显高于多糖。不同种葱属蔬菜的抗氧化活性差异较大,其中韭菜水提物、醇提物和多糖的抗氧化活性最高,ABTS·+自由基清除率的EC50值分别为27.46、15.58、2.05×103,DPPH自由基清除率的EC50值分别为66.41、25.48、3.16×107,韭菜醇提物对ABTS·+自由基的清除能力与维生素C(Vc)接近。韭菜醇提物、水提物的抗氧化活性较高,具有一定的开发利用价值。
抗氧化活性; 葱属蔬菜; 水提物; 醇提物; 多糖
百合科葱属植物韭菜(Alliumtuberosum)、大葱(Alliumfistulosum)和小葱(Alliumascalonicum)既是重要的蔬菜作物,也具有较高的保健功效。据《本草纲目》记载,“正月葱,二月韭”具有医治胸痹急痛、伤寒劳复、风湿身痛、消渴等功效。Lee等[1]证明韭菜中的硫化物可以抑制人类结肠癌细胞增殖并诱导细胞凋亡;Jung等[2]发现大葱中的果聚糖具有抗甲型流感病毒的作用;Sung等[3]证明大葱有助于改善肥胖和代谢失调;Owoyele等[4]发现小葱的乙醇提取物(简称醇提物)可使雄性大鼠的高密度脂蛋白含量降低、白细胞含量升高;Wongmekiat等[5]证明小葱的水提物能够保护雄性大鼠由环孢素A引起的肾损伤;Cheng等[6]发现红皮洋葱(Alliumcepa)提取物的抗氧化活性显著高于黄皮洋葱。现代医学研究表明,正常人体内的自由基生成与清除处于动态平衡状态,当自由基动态平衡被打破时,就会出现各种氧化损伤,从而加速机体衰老并诱发肿瘤等多种疾病[7-8]。研究和开发安全、高效的天然抗氧化剂是食品科学和医学领域的热点课题[9]。韭菜、大葱和小葱风味独特,安全无毒,在我国范围内广泛种植,是我国居民的主要蔬菜。本研究以韭菜、大葱和小葱3种葱属蔬菜为试材,在分离制备水提物、醇提物与多糖的基础上,对其体外抗氧化活性进行比较研究,以期为安全、高效抗氧化剂的发现以及葱属蔬菜资源的深度开发提供参考。
1 材料和方法
1.1 材料与仪器
韭菜、大葱和小葱2013年7月采自陕西省西安市长安区。葡萄糖(纯度>99%)、维生素C(Vc) (纯度>99%)、2,2-联氮-二(3-乙基-苯并噻唑-6-磺酸)二铵盐(ABTS)、1,1-二苯基-2-三硝基苯肼(DPPH)购自Sigma公司。无水乙醇、丙酮、浓硫酸、苯酚、α-萘酚等均采用分析纯,购自西安市斯迈尔试剂仪器经营部。
TU-1810型紫外可见分光光度计,北京普析通用公司;722型可见分光光度计,上海光谱仪器有限公司;JPCQ0328型全数字式超声波清洗机,武汉嘉鹏电子有限公司;DL-4C型低速大容量离心机,上海安亭科学仪器厂;HH-S4型电热恒温水浴锅,北京科伟永兴仪器有限公司。
1.2 实验方法
1.2.1 样品制备
(1) 蔬菜样品处理 韭菜、大葱和小葱叶片经挑选去杂后,用自来水、dH2O依次漂洗,然后切成长约1 cm的小段,在50℃烘干至恒重,粉碎过筛后取20~40目的样品粉末避光保存(备用)。
(2) 水提物制备 取3种样品粉末,分别按照1∶40料液比加入dH2O,在25 ℃超声波辅助提取30 min[10]。离心取上清液,用0.45 μm水系滤膜过滤,冷冻干燥后密封4 ℃保存。
(3) 醇提物制备 取3种样品粉末,分别按照1∶50料液比加入50%乙醇,置50 ℃水浴中浸泡2 h后超声波辅助提取20 min[11]。离心取上清液,用0.45 μm有机系滤膜过滤,冻干后密封4 ℃保存。
(4) 多糖制备 参考文献[10],取3种样品粉末,分别按照1∶40料液比加入dH2O,在100 ℃加热提取3 h后,离心取上清液,加入4倍体积95%乙醇,离心取沉淀,依次用70%乙醇、95%乙醇、无水乙醇、丙酮洗涤沉淀,再用Sevag法进一步纯化,最后在55 ℃烘干得到多糖样品。
1.2.2 多糖的定性与定量分析
(1) 多糖的定性 采用Molish反应[12]定性鉴定多糖。
(2) 多糖的纯度鉴定 参考文献[13],配制1 mg/mL多糖样品溶液,在190~400 nm波长范围内进行扫描,鉴定多糖纯度。
(3) 多糖的含量测定 采用苯酚-硫酸比色法[12,14]测定多糖含量,简述如下:分别量取300 μL 5%苯酚溶液至8支试管中,各加入0.10 mg/mL葡萄糖标准溶液0、50、100、200、300、400、500、600 μL,用dH2O补足体积至1 mL,再各加入2.5 mL浓硫酸,振荡混匀后在20℃水浴中显色反应5 min,然后在490 nm波长下测定吸光度,以葡萄糖标准溶液的浓度x为横坐标、吸光度平均值y为纵坐标绘制标准曲线(图1)。按照相同方法对多糖样品溶液进行显色,通过比色分析即可测定多糖含量。

图1 葡萄糖标准曲线Fig.1 Calibration curve of glucose
1.2.3 自由基清除实验 采用本实验室优化的ABTS·+、DPPH自由基清除实验方法[8]考察3种葱属蔬菜水提物、醇提物及多糖的抗氧化作用。ABTS·+实验简述如下:将等体积的7.4 mmol/L ABTS溶液和2.6 mmol/L过硫酸钾溶液均匀混合,避光反应12 h后稀释得到ABTS·+溶液。实验设样品组和对照组。样品组中,将4 mL ABTS·+溶液加入1 mL样品溶液中,混匀后避光反应6 min,立即在734 nm波长下测定吸光度;第一对照组中,用1 mL dH2O代替1mL样品溶液;第二对照组中,用4 mL无水乙醇代替4 mL ABTS·+溶液。DPPH实验简述如下:用无水乙醇配制0.04 mg/mL的DPPH溶液。实验设样品组和对照组。样品组中,在1 mL样品溶液中加入2 mL DPPH溶液,混匀后避光反应30 min,立即在517 nm波长下测定吸光度;第一对照组用1 mL dH2O代替1 mL样品溶液;第二对照组用2 mL无水乙醇代替2 mL DPPH溶液。自由基清除率的计算公式为:I=(1-(Ax-A2)/A1)×100%。式中:I为多糖对自由基的清除率,A1为第一对照组吸光度,A2为第二对照组吸光度,Ax为样品组吸光度。参考文献[11]计算相对半效剂量(EC50)。
1.2.4 数据分析与统计 运用SPSS 12.0软件统计实验数据,多重比较采用One-Way ANOVA分析和最小显著差数(LSD)的t检验方法,P<0.05表示差异显著,具有统计学意义。
2 结果和分析
2.1 多糖的制备与检测
采用水提醇沉法提取3种葱属蔬菜多糖,采用有机溶剂分级分离法和Sevag法纯化多糖,制得了浅棕色的多糖固体。光谱扫描发现,多糖样品在200 nm波长附近有多糖特征性吸收峰,在260、280 nm及特定紫外区无明显光吸收(图2),表明多糖样品中不含核酸、蛋白质及多酚等杂质[15]。多糖样品的Molish反应呈阳性,说明其中确实含有多糖成分。韭菜、大葱和小葱多糖的含量各不相同,依次为11.40%、22.57%和15.97%(表1),说明葱属蔬菜多糖水平的种间差异较大(P<0.05)。

图2 3种葱属蔬菜多糖样品扫描光谱Fig.2 Scanning spectra of polysaccharides from 3 Allium species

表1 3种葱属蔬菜多糖的含量Tab.1 Contents of polysaccharides in 3 Allium species
注:数值右侧的不同上标表示显著差异。
2.2 对ABTS·+自由基的清除作用
如图3所示,3种葱属蔬菜水提物对ABTS·+自由基的清除能力由大到小依次为韭菜、小葱、大葱,并且清除率与水提物量呈正相关。由表2可知,3种蔬菜醇提物、水提物的ABTS·+自由基清除能力较强,而多糖的清除能力较差。3种蔬菜水提物拟合方程的相关系数(R2)为0.948 2~0.974 6,说明数学模型能较好地反映水提物量与自由基清除率之间的量效关系。韭菜水提物对ABTS·+自由基的清除能力很强,EC50值为27.46,高于Vc,但显著低于小葱和大葱(P<0.05)。

图3 3种葱属蔬菜水提物对ABTS·+自由基的清除作用Fig.3 ABTS·+ radical-scavenging capacities of water extract from 3 Allium species

表2 3种葱属蔬菜的ABTS·+自由基清除活性 及其量效关系数学模型Tab.2 ABTS·+ radical-scavenging activity and mathematical model of dose-effect relationship of 3 Allium species
注:拟合方程中,y为自由基清除率,x为提取物量;EC50为相对半效剂量,其数值受待测物浓度影响(具体计算方法参考文献[11]),EC50数值右侧的不同上标表示显著差异。下表同。
如图4所示,3种蔬菜醇提物均具有较强的ABTS·+自由基清除能力。在醇提物量为60 μL时,韭菜、大葱和小葱的清除率都达到80%。在试验范围内,醇提物的自由基清除能力呈现出明显的剂量依赖性。由表2可知,3种蔬菜拟合方程的相关系数为0.917 3~0.992 7,说明数学模型能较好地反映醇提物量与自由基清除率之间的量效关系。此外,韭菜、小葱、大葱醇提物的EC50值分别为15.58、16.29、19.91,相比于Vc的EC50值(4.18),可知3种葱属蔬菜的醇提物都具有一定的抗氧化活性,其中韭菜醇提物的ABTS·+自由基清除能力与Vc比较接近。

图4 3种葱属蔬菜醇提物对ABTS·+自由基的清除作用Fig.4 ABTS·+ radical-scavenging capacities of ethanol extract from 3 Allium species
如图5所示,3种蔬菜多糖的ABTS·+自由基清除能力也呈现出剂量依赖性。3种蔬菜多糖的ABTS·+自由基清除能力均较差,韭菜多糖的自由基清除能力显著高于大葱和小葱(P<0.05)(表3)。
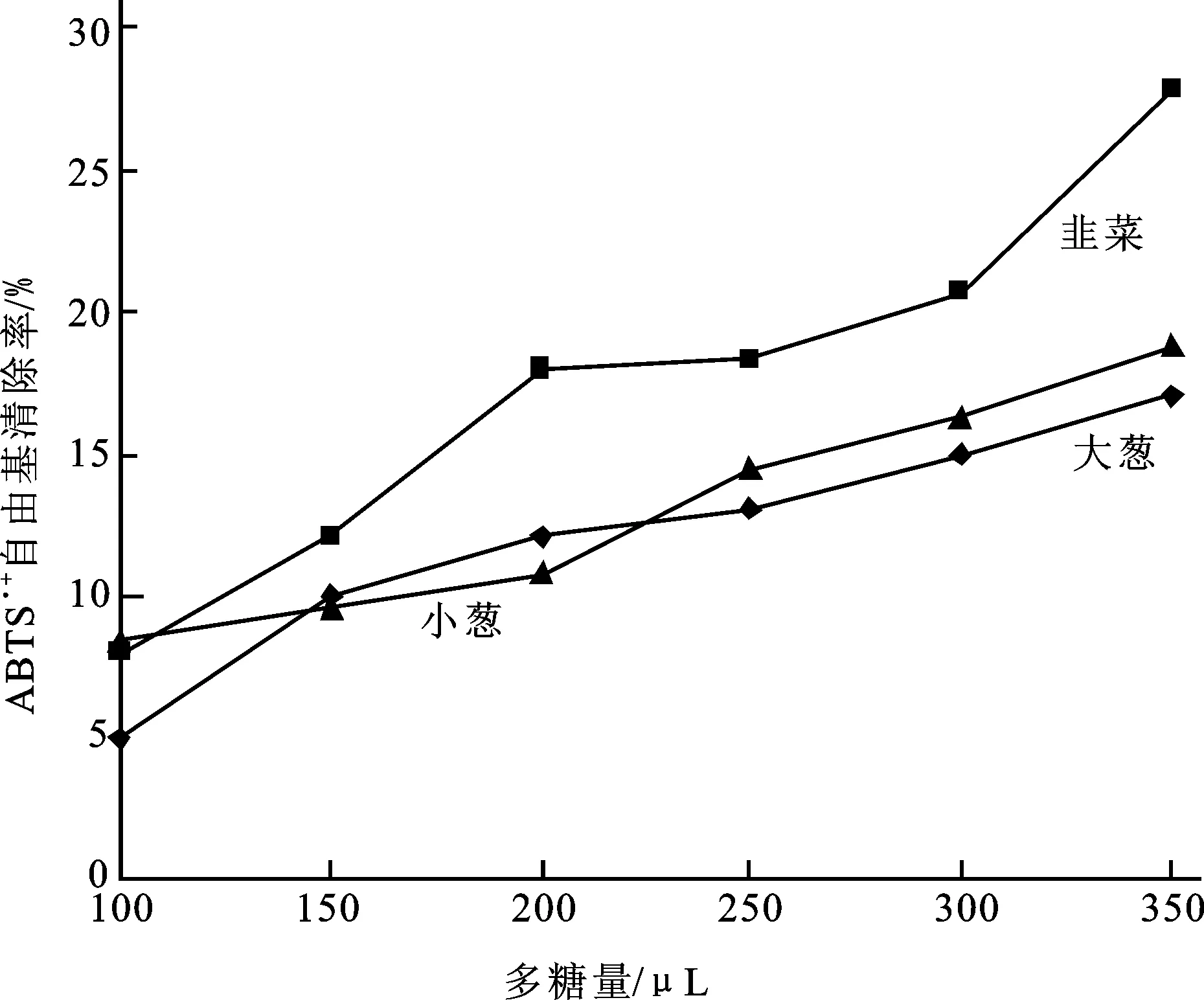
图5 3种葱属蔬菜多糖对ABTS·+自由基的清除作用Fig.5 ABTS·+ radical-scavenging capacities of polysaccharides from 3 Allium species
2.3 对DPPH自由基的清除作用
由表3可知,3种葱属蔬菜水提物、醇提物的DPPH自由基清除能力较强,而多糖的清除能力较差,这与ABTS·+实验的结论相一致(表2)。一般来说,植物水提物中含有较多的酚类化合物,此外还含有少量黄酮类化合物、蛋白质、单宁、糖类、有机酸等[10,16];醇提物中含有较多的黄酮类化合物,此外还含有酚类化合物、蒽醌、萜类化合物、香豆素等[11]。黄酮类化合物和多酚等往往具有较强的抗氧化活性[6-7]。3种葱属蔬菜醇提物、水提物的抗氧化活性显著优于多糖,可能与其中含有较多的黄酮类化合物、多酚有关。3种蔬菜水提物、醇提物、多糖拟合方程的相关系数为0.943 6~0.987 3(表3),说明数学模型能较好地反映提取物量与DPPH自由基清除率之间的量效关系。

表3 3种葱属蔬菜的DPPH自由基清除活性及其量效关系数学模型Tab.3 DPPH radical-scavenging activity and mathematical model of dose-effect relationship of 3 Allium species
如图6所示,3种蔬菜水提物的DPPH自由基清除率随着水提物量的增加而增大,自由基清除能力由大到小依次为韭菜、大葱、小葱。由表3也可看出,大葱和小葱的EC50值约为韭菜的二倍,表明韭菜对DPPH自由基的清除能力远大于大葱和小葱。

图6 3种葱属蔬菜水提物对DPPH自由基的清除作用Fig.6 DPPH radical-scavenging capacities of water extract from 3 Allium species
如图7所示,3种蔬菜醇提物均具有较强的DPPH自由基清除能力。在试验范围内,蔬菜样品的自由基清除率随着醇提物量的增加而升高。在醇提物量为140 μL时,韭菜、大葱和小葱的清除率皆达到92%。由表3可知,韭菜醇提物的EC50值最低(25.48),大葱和小葱次之(EC50值分别为26.77和34.70),表明3种葱属蔬菜中韭菜的DPPH自由基清除能力最强。

图7 3种葱属蔬菜醇提物对DPPH自由基的清除作用Fig.7 DPPH radical-scavenging capacities of ethanol extract from 3 Allium species
如图8所示,3种蔬菜多糖的DPPH自由基清除能力亦呈剂量依赖性。由表3可知,3种蔬菜多糖的DPPH自由基清除能力均明显低于Vc(P<0.05);相对而言,韭菜多糖的抗氧化能力高于小葱和大葱。

图8 3种葱属蔬菜多糖对DPPH自由基的清除作用Fig.8 DPPH radical-scavenging capacities of polysaccharides from 3 Allium species
3 结论
韭菜、大葱、小葱3种葱属蔬菜的水提物、醇提物和多糖均具有一定的抗氧化活性。抗氧化活性具有明显的剂量依赖性,基于量效关系建立的数学模型具有较高的拟合度。醇提物、水提物的抗氧化活性明显高于多糖。在3种葱属蔬菜中,韭菜水提物、醇提物和多糖的抗氧化活性最高,韭菜醇提物对ABTS·+自由基的清除能力与Vc比较接近。大葱多糖含量最高,小葱次之,韭菜最低,但是韭菜多糖的抗氧化活性明显高于大葱和小葱。不同种蔬菜多糖的含量及水提物、醇提物和多糖的抗氧化活性差异较大。总体上看,韭菜醇提物、水提物的抗氧化活性较高,值得进一步研究和开发。
[1] Lee J H, Yang H S, Park K W, et al. Mechanisms of thiosulfinates fromAlliumtuberosumL.-induced apoptosis in HT-29 human colon cancer cells[J].Toxicology Letters, 2009, 188(2): 142-147.
[2] Jung B L, Miyake S, Umetsu R, et al. Anti-influenza A virus effects of fructan from Welsh onion (AlliumfistμlosumL.)[J]. Food Chemistry, 2012, 134(4): 2164-2168.
[3] Sung Y Y, Kim S H, Kim D S, et al. Nutritional composition and anti-obesity effects of cereal bar containingAlliumfistμlosum(welsh onion) extract[J]. Journal of Functional Food, 2014, 6(1): 428-437.
[4] Owoyele B V, Alabi O T, Adebayo J O, et al. Haematological evaluation of ethanolic extract ofAlliumascalonicumin male albino rats[J]. Fitoterapia, 2004, 75(3/4): 322-326.
[5] Wongmekiat O, Leelarugrayub N, Thamprasert K. Beneficial effect of shallot (AlliumascalonicumL.) extract on cyclosporine nephrotoxicity in rats[J]. Food and Chemical Toxicology,2008, 46(5): 1844-1850.
[6] Cheng A, Chen X, Jin Q, et al. Comparison of phenolic content and antioxidant capacity of red and yellow onions[J]. Czech Journal of Food Science, 2013, 31(5): 501-508.
[7] Bursal E, Köksal E. Evaluation of reducing power and radical scavenging activities of water and ethanol extracts from sumac (RhuscoriariaL.)[J]. Food Research International, 2011, 44(7): 2217-2221.
[8] Zhang H F, Zhang X, Yang X H, et al. Microwave assisted extraction of flavonoids from cultivatedEpimediumsagittatum: extraction yield and mechanism, antioxidant activity and chemical composition[J]. Industrial Crops and Products, 2013, 50 (5): 857-865.
[9] Florian C, Reinheld C. Function properties of anthocyanins and betalains in plants food and in human nutrition[J].Trends in Food Science and Technology, 2004, 15(1):19-38.
[10] Yang X, Yu W, Ou Z, et al. Antioxidant and immunity activity of water extract and crude polysaccharide fromFicuscaricaL. fruit[J]. Plant Foods Hum Nutr, 2009, 64(2): 167-173.
[11] Cao J, Xia X, Dai X, et al. Flavonoids profiles, antioxidant, acetylcholinesterase inhibition activities of extract fromDryoathyriumboryanum(Willd.) Ching[J]. Food and Chemical Toxicology, 2013, 55(5): 121-128.
[12] Ye S, Liu F, Wang J, et al. Antioxidant activities of an exopolysaccharide isolated and purified from marinePseudomonasPF-6[J]. Carbohydrate Polymers, 2012, 87(1): 764-770.
[13] Li X L, Zhou A G. Preparation of polysaccharides fromAcanthopanaxsenticosusand its inhibition against irradiation-induced injury of rat[J]. Carbohydrate Polymers, 2007, 67(2): 219-226.
[14] Zhang H F, Niu L L, Yang X H, et al. Analysis of water-soluble polysaccharides in an edible and medicinal plantEpimedium: Method development, validation and application[J]. Journal of AOAC International, 2014, 97(3): 784-790.
[15] Harborne J B, Williams C A. Advances in flavonoid research since 1992[J]. Phytochemistry, 2000, 55(6): 481-504.
[16] Nagai T, Myoda T, Nagashima T. Antioxidative activities of water extract and ethanol extract from field horsetail (tsukushi)EquisetumarvenseL[J]. Food Chemistry, 2005, 91(3): 389-394.
〔责任编辑 宋轶文〕
Antioxidant activities of water extract, ethanol extract and polysaccharides among threeAlliumspecies
LI Lu, YAO Mei, ZHANG Huafeng*, CHEN Wenjie, LI Meiyu
(Key Laboratory of Ministry of Education for Medicinal Resources and Natural Pharmaceutical Chemistry,National Engineering Laboratory for Resources Development of Endangered Crude Drugs in Northwest China,School of Food Engineering and Nutritional Science, Shaanxi Normal University, Xi′an 710119, Shaanxi, China)
After water extract, ethanol extract and polysaccharides,threeAlliumspecies, includingA.fistulosumandA.ascalonicum, contents of polysaccharides in these threeAlliumspecies were determined by phenol-sulfuric acid method, and their antioxidant activities were evaluated by ABTS (2,2′-azino-bis (3-ethyl-benzothiazoline-6-sulfonic acid) diammonium salt) and DPPH (1,1-diphenyl-2-picrylhydrazyl) assays. Average contents of polysaccharides inA.tuberosum,A.fistulosumandA.ascalonicumwere 11.40%, 22.57% and 15.97%, respectively. Both ABTS· +and DPPH radical-scavenging capacities were dose dependent, and mathematical model based on dose-effect relationship had high goodness of fit. Antioxidant activities of water extract, ethanol extract were significantly better than those of polysaccharides. The three species exhibited different antioxidant capacities. Among them, antioxidant activities ofA.tuberosumwere higher. EC50values of ABTS·+radical-scavenging capacity of water extract, ethanol extract and polysaccharides fromA.tuberosumwere 27.46, 15.58, 2.05×103, respectively, and EC50values of DPPH radical-scavenging capacity were 66.41, 25.48, 3.16×107, respectively. In particular, ABTS+radical-scavenging capacity of ethanol extract was relatively close to that of vitamin C(Vc). To sum up, antioxidant activities of ethanol extract and water extract fromA.tuberosumwere relatively high, which showed great potential for exploitation and utilization.
antioxidant activity;Allium; water extract; ethanol extract; polysaccharides
1672-4291(2015)03-0098-06
10.15983/j.cnki.jsnu.2015.03.136
2014-07-08
陕西省科技合作计划项目(2014SJ-01); 陕西师范大学勤助科研创新基金项目(QZYB13043)
李璐,女,硕士研究生,研究方向为食品营养学。E-mail:liluacademic@yahoo.com
*通信作者:张华峰,男,副教授,博士。E-mail:isaacsau@sohu.com
TS255.1
A
