丹参酮ⅡA对新生大鼠缺血缺氧性脑损伤后神经细胞凋亡的保护作用及机制研究
2015-06-09王媛婕刘彦慧廖瑞雪
王媛婕,刘彦慧,廖瑞雪
(天津中医药大学护理学院,天津 300193)
丹参酮ⅡA对新生大鼠缺血缺氧性脑损伤后神经细胞凋亡的保护作用及机制研究
王媛婕,刘彦慧,廖瑞雪
(天津中医药大学护理学院,天津 300193)
丹参酮;缺血缺氧;脑损伤;新生大鼠;caspase-3;神经细胞凋亡
新生儿缺血缺氧性脑损伤(hypoxia ischemic brain damage,HIBD)是引发新生儿死亡及神经系统功能障碍的主要原因之一, 发病率高,严重影响患儿的生存质量。目前国内外治疗HIBD的主要方法为亚低温治疗[2],但该法在降温和复温幅度、方式等方面差异较大,患儿在治疗后死亡率仍高达50%,且伴严重神经系统受损、心肺功能下降及肝肾损害[3],因此,亚低温疗法存在较大的争议和挑战。目前其他单一措施也不能达到完全保护,治疗HIBD的研究就显得十分必要。
大量研究表明,丹参酮ⅡA(tanshinone ⅡA,Tan ⅡA)对脑、心、肾等脏器的缺血缺氧性损伤具有一定的保护作用[3-5]。本研究通过建立HIBD大鼠模型,检测Tan ⅡA对新生大鼠HIBD后神经细胞凋亡及caspase-3蛋白表达的影响,探讨了Tan ⅡA对新生大鼠HIBD的神经保护作用及可能的分子生物学机制,为新药开发提供依据。
1 材料与方法
1.1 材料丹参酮ⅡA磺酸钠注射液(5 g·L-1)(批号:130528);原位细胞凋亡检测试剂盒、DAB检测试剂盒(Roche, USA);Western blot一抗(Abcam, UK);二抗:北京中杉金桥生物技术有限公司;显影剂:天津天陆感光材料厂;混合气体:天津市赛米气体有限公司。
1.2 实验分组及模型制备选7 d龄SPF级Wistar大鼠75只,许可证号:SCXK-(军)2009-003,♀♂不限,体质量12 g左右。每组15只,随机分为5组:假手术组(Sham)、模型组(HIBD)、高(0.08 mg·g-1,TH)、中(0.04 mg·g-1,TM)、低(0.008 mg·g-1,TL)剂量组。按Rice法[6]制备新生大鼠HIBD模型。10%水合氯醛(0.3 mL·100 g-1)麻醉,暴露左侧颈总动脉,分离血管和神经,结扎并缝合伤口。术后送回母鼠处2 h,然后将TH、TM、TL、HIBD新生鼠放入常压缺氧舱(20×30×50 cm,密闭有机玻璃舱),通入8%O2+92%CO2的混合气体,流量2 L·min-1,持续2 h。Sham组仅分离左侧颈总动脉,不结扎,不缺氧。当缺血缺氧组的大鼠出现自发性左旋或夹尾左旋时,则模型建立成功。
按药量/体重比计算给药量,配成终体积0.2 mL的注射液。TH、TM、TL组均于缺血缺氧30 min后腹腔注射1次;Sham组和HIBD组则注射等量的生理盐水。24 h后重复给药一次。
1.3 样品采集术后48 h迅速断头取脑,冰盘上取结扎侧的海马和大脑白质,并等分为三份,取中间份置于4%甲醛溶液(PFA)中固定,另两份置-80℃冰箱保存。
1.4 TUNEL法检测神经细胞凋亡取4%PFA固定的海马组织,制石蜡切片;蛋白酶K(20 mg·L-1溶于Tris/HCl中,pH 7.6)室温孵育30 min,PBS洗2次;加50 μL POD湿盒中37℃孵育30 min,PBS洗3次;加100 μL DAB于室温孵育10 min,PBS洗3次;苏木精复染细胞核,封片。光镜下(20×, 10×)采集图像并统计五个视野的细胞。凋亡率(apoptotic rate, AR)/%=阳性细胞数/(阳性细胞数+阴性细胞数)×100%。
1.5 Western blot法检测脑组织caspase-3蛋白表达取低温保存的大鼠大脑白质组织100 mg,裂解,4℃研磨裂解30 min,3 000 r·min-1离心10 min,上清用BCA法测蛋白浓度,酶标仪测相应的蛋白含量,进行实验。用Image J软件进行图象分析,蛋白表达水平用目的条带与β-actin条带灰度值(optical density,OD)之比的百分数表示。
2 结果
2.1 神经凋亡细胞统计结果分析按Soslow法[7]。 Sham组仅见极少量TUNEL阳性细胞;与Sham组比较,HIBD组可见大量TUNEL阳性细胞(P<0.01);与HIBD组比较,TH、TM及TL组缺血区TUNEL阳性细胞均明显减少(P<0.01);而与TL比较,TH缺血区TUNEL阳性细胞明显减少(P<0.01)。见Tab 1。

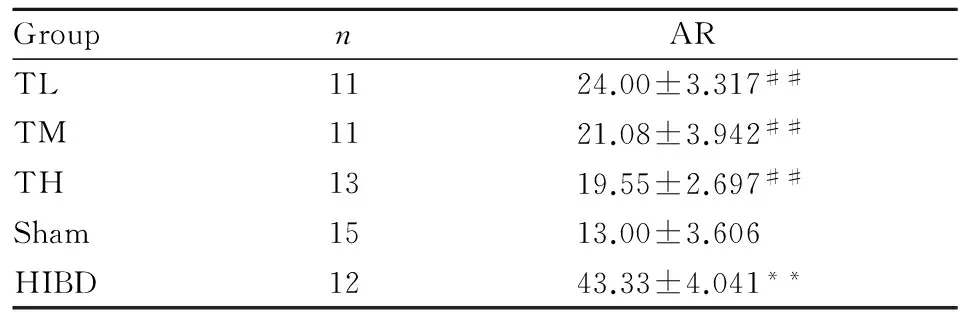
GroupnARTL1124.00±3.317##TM1121.08±3.942##TH1319.55±2.697##Sham1513.00±3.606HIBD1243.33±4.041**
**P<0.01vssham group;##P<0.01vsHIBD group. Due to the rapture of the carotid artery,2 rats were dead in TH group,2 in TM group,3 in TL group and 3 in HIBD group in the process of ischemia surgery. In the process of hypoxia,2 rats were dead in TM group and 1 in TL group due to intolerance of oxygen shortage.
2.2 脑组织中caspase-3蛋白表达Western blot结果显示:与Sham组比较,HIBD组caspase-3蛋白表达明显升高(P<0.01);与HIBD组比较,TL组、TM组及TH组caspase-3蛋白表达逐渐降低,且TH组明显低于TL组(P<0.01)。见Tab 2。
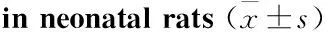

GroupnCaspase-3ODCaspase-3/β-actinODTL110.99±0.071##34.04±2.387##TM110.83±0.059##29.27±2.005##TH130.80±0.069##28.13±2.275##Sham150.71±0.02124.69±1.693HIBD121.41±0.063**47.89±2.722**
**P<0.01vssham group;##P<0.01vsHIBD group
3 讨论
本实验通过TUNEL法检测神经细胞凋亡,发现HIBD组和给药组神经细胞凋亡率明显高于假手术组,证实了缺血缺氧可诱导神经细胞调亡发生。Tan ⅡA组的神经细胞凋亡率明显低于模型组,说明Tan ⅡA有抑制HIBD所致神经细胞凋亡的作用。通过Western blot检测发现,给予Tan ⅡA后新生大鼠脑组织中caspase-3蛋白的表达明显低于HIBD组,且呈一定的剂量效应。说明Tan ⅡA可以通过抑制caspase-3的表达起到抗凋亡作用。
综上所述,Tan ⅡA对新生大鼠HIBD具有保护作用,该保护作用可能是基于Tan ⅡA对于神经细胞凋亡的抑制,也即通过降低caspase-3的表达水平来发挥Tan ⅡA的抗凋亡的作用,从而起到保护神经细胞的作用。在迄今对新生儿HIBD尚无确定的特效神经保护手段的情况下,Tan ⅡA对新生大鼠HIBD神经损伤的保护作用具有较大的研究价值和临床意义。
[1] Liu L, Zhang X, Wang L, et al.The neuroprotective effects of tanshinone ⅡA are associated with induced nuclear translocation of TORC1 and upregulated expression of TORC1, pCREB and BDNF in the acute stage of ischemic stroke [J].BrainResBull,2010, 82(34):228-33.
[2] Tagin M A, Woolcott C G, Vincer M J, et al. Hypothermia for neonatal hypoxic ischemic encephalopathy: an updated systematic review and meta-analysis [J].ArchPediatrAdolescMed, 2012, 166(6): 558-66.
[3] 杨志霞,林 谦,马 利,等.黄芪多糖丹参酮对慢性心衰大鼠MIF表达的调控作用[J].中国药理学通报,2011,27(9):1214-7.
[3] Yang Z X,Lin Q,Ma L,et al. Regulatory effect of astragalan and salviol on macrophage migration inhibitory factor expression in rats with chronic heart failure [J].ChinPharmacolBull, 2011,27(9):1214-7.
[4] Zhang X, He D, Xu L, et al. Protective effect of tanshinone ⅡA on rat kidneys during hypothermic preservation[J].MolMedRep, 2012, 5(2):405-9.
[5] Tang C, Xue H, Bai C, et al. The effects of tanshinone ⅡA on blood-brain barrier and brain edema after transient middle cerebral artery occlusion in rats[J].Phytomedicine, 2010, 17(14):1145-9.
[6] Rice J E,Vannucci R C, Brierley J B. The influence of immaturity on hypoxic-ischemic brain damage in the rat[J].AnnNeurol,1981,9(2):131-41.
[7] Soslow R A, Dannenberg A J, Rush D, et al. Cox-2 is expressed in human pulmonary, colonic, and mammary tumors[J].Cancer, 2000, 89(12):2637-45.
《中国药理学通报投稿与阅读须知》刊登在每年第1期卷首。
Protective effect of tanshinone ⅡA on neurocyte apoptosis in rats with hypoxia ischemic brain damage and its mechanism
WANG Yuan-jie, LIU Yan-hui, LIAO Rui-xue
(SchoolofNursing,TianjinUniversityofTraditionalChineseMedicine,Tianjin300193,China)
tanshinone; hypoxia ischemic; brain damage; neonatal rats; caspase-3; neurocyte apoptosis
时间:2015-3-3 11:08 网络出版地址:http://www.cnki.net/kcms/detail/34.1086.R.20150303.1108.030.html
2014-11-02,
2014-12-13
国家自然科学基金资助项目(No 30973935)
王媛婕(1989-),女,硕士生,研究方向:神经病学,E-mail:yuanjie166@163.com; 刘彦慧(1971-),女,博士,副教授,硕士生导师,研究方向:神经病学,通讯作者,E-mail:yh_liu888@163.com
10.3969/j.issn.1001-1978.2015.03.030
A
1001-1978(2015)03-0443-02
R-332;R284.1;R322.81;R329.25;R722.1;R743.31;R845.22
