罗红霉素对哮喘平滑肌细胞增殖以及微囊蛋白-1及PI3K/Akt的影响
2015-06-09戴元荣李凤琴付玉茹夏梦玲葛翔挺
徐 慧,戴元荣,李凤琴,付玉茹,夏梦玲,葛翔挺
(温州医科大学附属第二医院呼吸科, 浙江 温州 325027)
罗红霉素对哮喘平滑肌细胞增殖以及微囊蛋白-1及PI3K/Akt的影响
徐 慧,戴元荣,李凤琴,付玉茹,夏梦玲,葛翔挺
(温州医科大学附属第二医院呼吸科, 浙江 温州 325027)
目的 研究罗红霉素(RXM)能否通过上调微囊蛋白-1(caveolin-1)的表达来调控PI3K/Akt通路,从而抑制TGF-β1刺激引起的哮喘气道平滑肌细胞(ASMCs)增殖。方法 30只健康♂ SD大鼠随机分为对照组和哮喘组,每组15只,以卵白蛋白(OVA)致敏和激发建立大鼠哮喘模型。将培养的ASMCs进行鉴定后,在哮喘组细胞中分别加入TGF-β1、PI3K/Akt通路抑制剂渥曼宁青霉素(wortmannin)、胆固醇剔除剂β-环糊精(β-CD)以及RXM进行干预,后三组在干预后再用TGF-β1刺激,故分6组:①TGF-β1组、②哮喘组、③正常组、④wortmannin+TGF-β1 组、⑤β-CD+TGF-β1组、⑥RXM+TGF-β1组,用CCK-8法检测哮喘大鼠ASMCs的增殖,Western blot检测ASMCs上caveolin-1、Akt 、p-Akt的表达情况。结果 ①TGF-β1组较正常组和哮喘组细胞增殖明显(P<0.01,P<0.05);RXM 和wortmannin干预组较TGF-β1组细胞增殖减少(均P<0.01)。②与正常组比较,哮喘组、TGF-β1组、β-CD干预组气道平滑肌细胞caveolin-1的表达量明显减少(均P<0.05),TGF-β1组较哮喘组caveolin-1表达量明显减少(P<0.05);与此同时,哮喘组ASMCs较正常组p-Akt的表达量明显增加(P<0.05),TGF-β1组较哮喘组p-Akt表达量明显增加(P<0.05),wortmannin干预组较TGF-β1组p-Akt的表达量明显减少,β-CD干预组较TGF-β1组p-Akt表达量明显增加(P<0.05),RXM干预组较TGF-β1组p-Akt表达量明显减少(P<0.05)。结论 罗红霉素可抑制TGF-β1刺激导致的哮喘大鼠ASMCs的增殖,并上调caveolin-1表达,抑制p-Akt活化。
罗红霉素;微囊蛋白;磷脂酰肌醇3激酶;气道平滑肌细胞;哮喘;气道重塑
气道重塑是支气管哮喘(简称哮喘)发病中的重要环节之一,是难治性哮喘的重要因素,其中气道平滑肌细胞(ASMCs)的增殖发挥了重要作用[1]。罗红霉素(roxithromycin,RXM)是新一代大环内酯类抗生素,经药理研究发现,大环内酯类抗生素除了抗菌作用外,还具有较强的抗炎活性和免疫调节作用[2]。研究发现微囊蛋白-1(caveolin-1)信号通路的激活可能参与气道重构相关的信号转导,抑制哮喘支气管ASMCs[3]。磷脂酰肌醇3激酶/蛋白激酶B(PI3K/Akt)信号途径是介导ASMCs增殖的一条重要通路。我们前期研究发现,PI3K/Akt信号途径在哮喘发病中起着重要作用[4]。所以本实验通过建立哮喘模型,使用RXM进行干预,探讨RXM能否抑制TGF-β1刺激导致的哮喘大鼠ASMCs的增殖,并上调caveolin-1表达,抑制p-Akt活化。
1 材料与方法
1.1 实验动物与试剂
1.1.1 实验动物 SPF级♂SD大鼠30只(温州医学院实验动物中心提供),实验动物许可证SYXK(浙)2010-0150,体质量100~120 g,6~8周龄。随机分为对照组和哮喘组(n=15)。
1.1.2 主要试剂 优级胎牛血清(杭州四季青公司),青霉素-链霉素溶液(江苏碧云天生物工程有限公司),CCK-8试剂盒(日本同仁生化研究所),罗红霉素粉剂、SMα-actin单克隆抗体(Sigma公司,美国),GAPDH抗体、胰酶细胞消化液(江苏碧云天生物工程有限公司),caveolin-1 抗体、p-Akt抗体(Abcam公司,美国),RPMI 1640培养基(HyClone公司,美国)。
1.2 方法
1.2.1 哮喘模型的制备 复制慢性哮喘模型[5],分致敏和激发2阶段。哮喘组分别于d 1和d 8大鼠腹腔注射1 mL OVA/Al(OH)3混合液[内含1 mg OVA和100 mg Al(OH)3]致敏,d 15开始激发,将大鼠置于特制玻璃容器内,雾化吸入含1%OVA的生理盐水8 mL,隔天1次,每次30 min,共8周;对照组用生理盐水代替OVA进行致敏和激发。
1.2.2 肺组织的HE染色 大鼠经末次激发后处死,结扎并游离右肺下叶,将其浸入4%的多聚甲醛溶液中,24 h后石蜡包埋,做病理切片。制备好的切片做HE染色,显微镜下观察。
1.2.3 气道平滑肌细胞的培养和鉴定 培养正常组和哮喘组大鼠支气管ASMCs,ASMCs细胞通过倒置显微镜形态学观察,并经SMα-actin 抗体, SABC 免疫组化法进行鉴定。采用改良组织贴块法培养原代ASMCs,加入含20%胎牛血清的RPMI 1640培养液,置37 ℃、5%CO2孵箱中培养,细胞贴壁生长。加入胰酶细胞消化液进行消化,并采用差速贴壁法纯化细胞,传代细胞用含10%FBS的RPMI 1640培养基培养, 按1 ∶2~3传代,取第3~6代细胞进行实验。
细胞免疫组化法步骤如下:将ASMCs爬片漂洗固定,0.3%Triton-×100作用20 min,漂洗,3%H2O2孵育后加正常山羊血清,37℃孵育30 min,不洗,滴加小鼠SMα-actin(1 ∶200)单克隆抗体,4℃过夜,加生物素化山羊抗小鼠IgG,孵育后加HRP标记链亲和素,再加DAB显色,苏木精复染,脱水,封片后显微镜下观察。
1.2.4 细胞增殖 取3~6代细胞,消化、离心后,用含10%FBS的RPMI 1640培养基将细胞调至浓度为4×106~5×106·L-1的混悬液,然后接种于96孔板,每孔100 μL,待细胞80%~90%融合后,换无血清RPMI 1640继续培养24 h,使细胞同步于G0期,换用含10%FBS的RPMI 1640培养基培养。哮喘组平滑肌细胞分别用TGF-β1、PI3K/Akt通路抑制剂wortmannin、胆固醇剔除剂β-环糊精(β-CD)、RXM进行干预,后3组药物干预后再用TGF-β1刺激,观察平滑肌细胞增殖情况。故细胞随机分为6组:①TGF-β1组、②哮喘组、③正常组、④wortmannin+TGF-β1 组、⑤β-CD+TGF-β1组、⑥RXM+TGF-β1组,其中β-CD作用是破坏caveolae的结构,减少caveolin-1的表达。以上药物所用的终浓度分别为TGF-β1(10 μg·L-1)、wortmannin(10 nmol·L-1)、β-CD(10 mmol·L-1)、罗红霉素(100 mg·L-1)[6-7]。
用CCK8法检测细胞增殖步骤如下:① 接种细胞于96孔板;② 细胞培养:将培养板置于37℃、5%CO2培养箱中培养,培养及分组如上述;③ 显色:培养结束后,每孔加入CCK-8溶液培养2 h;④用酶标仪检测在450 nm处各孔的吸光度。
1.2.5 电镜下观察caveolae的结构 取3~8代哮喘模型大鼠ASMCs,经纯化传代,细胞长至达到80%左右密度。取正常组和哮喘组细胞于37℃、5%CO2孵育箱内孵育48 h后,离心,细胞戊二醛固定后,送电镜室进一步处理,观察各组细胞膜表面caveolae变化情况。
1.2.6 Western blot检测大鼠ASMCs中caveolin-1、p-Akt蛋白的表达 提取细胞总蛋白,将样本稀释、上样、电泳、转膜后,在5%脱脂奶粉封闭液中封闭2 h后洗膜,分别加兔抗大鼠caveolin-1抗体(1 ∶1 000)、p-Akt(1 ∶1 000)、Akt(1 ∶800)及小鼠抗大鼠GAPDH抗体(1 ∶5 000)孵育,4℃冰箱过夜摇床孵育,洗膜;加入辣根过氧化物酶标记山羊抗兔二抗(1 ∶2 000)及山羊抗小鼠二抗(1 ∶3 000),最后ECL试剂盒显色,扫描、显影、洗像。每组实验均重复3次。
1.2.7 统计学处理 应用SPSS 17.0软件进行统计分析。组间差异比较采用单因素方差分析(ANOVA)。
2 结果
2.1 光镜下观察肺组织结构变化光镜显示哮喘组黏膜下、支气管及血管周围大量炎症细胞浸润,气道上皮黏液腺增生,支气管壁明显增厚、管腔狭窄,嗜酸粒细胞增多,见Fig 1。

Fig 1 Pathology of different groups (×400)
A: Control group;B: Asthma group
2.2 ASMCs鉴定① 倒置相差显微镜观察,ASMCs未汇合前多呈梭形或多边形,汇合后部分区域细胞束状排列,起伏状生长,呈典型“峰谷”生长状态。② 免疫细胞化学鉴定:SMα-actin免疫细胞化学染色后,结果显示α-肌动蛋白呈橘黄色丝状物,鉴定为哮喘大鼠ASMCs,见Fig 2。

Fig 2 Identification of ASMCs
A:Immunochemical staining of ASMCs(×200);B: Observation of ASMCs under inverted microscope (×100)
2.3 电镜下观察caveolae形态透射电镜放大12 000倍观察哮喘大鼠ASMCs可见到细胞表面的caveolae结构。正常组caveolae含量丰富,哮喘组caveolae结构破坏。见Fig 3。
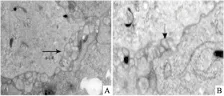
Fig 3 Observation of caveolae in ASMCs by scanning electron microscope (×7 000)
A: Control group;B:Asthma group.
2.4 CCK-8法测各组细胞增殖情况TGF-β1组与正常组、哮喘组比较,OD值均明显增加(P<0.01,P<0.05);与TGF-β1组相比,RXM+TGF-β1组OD值下降(P<0.05),见Tab 1。

GroupOD/%TGF-β1140.3#Asthma100.0Normal53.8**Wortmannin+TGF-β186.5**β-CD+TGF-β1178.8*RXM+TGF-β1109.6*
#P<0.05vsasthma group;*P<0.05,**P<0.01vsTGF-β1 group
2.5 Western blot检测结果p-Akt蛋白的表达在哮喘组增加,TGF-β1组较哮喘组p-Akt表达量明显增加,而用抑制剂wortmannin后p-Akt的活化明显降低,罗红霉素可以明显抑制p-Akt的活化。Caveolin-1在哮喘组和TGF-β1组表达量较正常组降低,经β-CD干预后表达明显降低,经罗红霉素干预后较TGF-β1组表达量增高,两两比较差异均有统计学意义(P<0.05),见Fig 4。
3 讨论
研究表明大环内酯类抗生素除了具有抑制炎症、控制免疫反应等作用外,还能抑制ASMCs的增殖,从而调控气道重塑的发生[8]。本课题组前期的实验结果已表明,在光镜下哮喘组与正常组大鼠支气管基底膜周径差异无统计学意义,管壁总面积、平滑肌面积具有可比性。哮喘组管壁厚度(μm2/μm)、平滑肌厚度(μm2/μm)均明显高于对照组,差异有统计学意义[9]。本研究哮喘组ASMCs加用RXM干预后增殖明显减少,提示RXM可能存在抑制ASMCs增殖的作用,那这种作用是通过何种途径实现的呢?

Fig 4 Expressions of caveolin-1 and p-Akt in ASMCs by Western blot
A:TGF-β1 group;B:Asthma group;C: Normal group;D: Wortmannin+TGF-β1 group;E: β-CD+TGF-β1 group; F: RXM+TGF-β1 group.*P<0.05vsTGF-β1 group
Caveolin-1可以减少气道ASMCs的生长、负性调节气道平滑肌增殖[10]。TGF-β1 被认为是致气道重塑的主要介质,它通过调节ASMCs迁移及增生等多种途径参与哮喘的发病过程[11]。本实验发现,用TGF-β1刺激哮喘ASMCs增殖的过程中,caveolin-1的表达量明显减少,故进一步推测caveolin-1可能在TGF-β1诱导哮喘ASMCs增殖的过程中起着负性调控作用。在本研究中哮喘组ASMCs中加入β-CD破坏caveolae的结构,减少caveolin-1的表达,再用TGF-β1刺激,发现ASMCs增殖明显增加,证实了caveolin-1在TGF-β1诱导哮喘ASMCs增殖的过程中发挥了负性调控的作用。在RXM干预组发现caveolin-1表达明显增加,ASMCs增殖减少,推测罗红霉素能抑制ASMCs的增殖,可能与上调caveolin-1的表达有关。
Park等[12]实验中发现,细胞膜上的caveolin-1的活化可激活PI3K/Akt 通路,而且有研究发现敲除caveolin-1基因可减少TGF-β介导的Akt的磷酸化[13]。本实验发现TGF-β1组ASMCs增殖的过程中,p-Akt的表达量增加,用β-CD干预破坏caveolin-1后,p-Akt表达量较TGF-β1组增加更为明显, ASMCs的增殖也更为明显,RXM干预后,p-Akt表达量下降,ASMCs增殖减少。所以本研究提示RXM减少ASMCs增殖可能与上调caveolin-1,抑制p-Akt活化有关。
此外caveolae作为信号转导中心可能调控较多的信号通路,它们之间是否存在交叉对话,共同调控ASMCs增殖,这些将有待我们进一步的研究。
总之,RXM可能抑制TGF-β1刺激导致的哮喘大鼠ASMCs的增殖,并上调caveolin-1表达,抑制p-Akt活化。本实验从动物实验方面对RXM调控ASMCs增殖的机制进行了探索,为哮喘的防治提供了新策略、开辟了新途径。
[1] Hassan M, Jo T, Risse P A, et al. Airway smooth muscle remodeling is a dynamic process in severe long-standing asthma[J].JAllergyClinImmunol, 2010, 125 (5):1037-45.
[2] Murphy DM,Forrest IA, Curran D, Ward C. Macrolide antibiotics and the airway: antibiotic or non-antibiotic effects[J].ExpertOpinInvestigDrugs, 2010, 19(3):401-14.
[3] Aravamudan B, VanOosten S K, Meuchel L W, et al. Caveolin-1 knockout mice exhibit airway hyperreactivity[J].AmJPhysiolLungCellMolPhysiol, 2012, 303(8): L669-81.
[4] 徐 慧, 戴元荣,夏晓东,等. 地塞米松对PI3K/Akt途径及哮喘大鼠气道炎症的调控[J].浙江医学,2010,32(1):37-39,42.
[4] Xu H, Dai Y R, Xai X D,et al. Regulation of dexamethaaone on PI3K/Akt signal pathway in asthmatic rat airway inflammation[J].ZhejiangMedJ, 2014, 32(1):37-39,42.
[5] Palmans E, Kips J C, Pauwels R A. Prolonged allergen exposure induces structural airway changes in sensitized rats[J].AmJRespirCritCareMed, 2000, 161(2 Pt 1): 627-35.
[6] 吴立琴,戴元荣,李凤琴,等. TGF-β1对哮喘大鼠气道平滑肌细胞增殖的影响研究[J].浙江医学,2014,36(13):1133-6.
[6] Wu L Q,Dai Y R,Li F Q,et al. Effect of TGF-β1 on proliferation of airway smooth muscle cells in asthma rats[J].ZhejiangMedJ, 2014, 36(13):1133-6.
[7] 吴海亚,戴元荣,应斌宇. 罗红霉素通过上调P27kip-1蛋白表达诱导离体哮喘大鼠气道平滑肌细胞凋亡[J].温州医学院学报,2013,43(9):561-6.
[7] Wu H Y, Dai Y R ,Ying B Y. Roxithromycin can induce apoptosis of airway smooth muscle cells from asthmatic rats by up-regulating the expression of P27kip1 proteininvitro[J].JWenzhouMedColl, 2013, 43(9):561-6.
[8] 夏晓东,吴立琴,徐 慧,等. 罗红霉素通过诱导型一氧化氮合酶/一氧化氮途径抑制哮喘大鼠气道炎症[J].中国药理学通报,2009,25(9):1223-7.
[8] Xai X D,Wu L Q,Xu H,et al. Roxithromycin inhibited airway inflammation through pathway of inducible nitric oxide synthase and nitric oxide in rat asthmatic model[J].ChinPharmacolBull, 2009, 25(9):1223-7.
[9] 曾潍贤,戴元荣.微囊蛋白-1对哮喘气道平滑肌增殖的抑制机制及罗红霉素的调控作用[J].中华医学杂志,2013,93(34):2750-4.
[9] Zeng W X,Dai Y R. Functional role of caveolin-1 in airway smooth muscle cells proliferation and regulatory effect of roxithromycin[J].NatlMedJChina,2013, 93(34):2750-4.
[10] Royce S G, Le Saux C J. Role of caveolin-1 in asthma and chronic inflammatory respiratory diseases[J].ExpertRevRespirMed, 2014, 8(3): 339-47.
[11] Todorova L, Bjermer L, Westergren-Thorsson G, Miller-Larsson A. TGFβ-induced matrix production by bronchial fibroblasts in asthma: budesonide and formoterol effects[J].RespirMed, 2011,105(9): 1296-307.
[12] Park J H, Han H J. Caveolin-1 plays important role in EGF-induced migration and proliferation of mouse embryonic stem cells: involvement of PI3K/Akt and ERK[J].AmJPhysiolCellPhysiol, 2009, 297(4):C935-44.
[13] Meyer C, Liu Y, Kaul A, et al. Caveolin-1 abrogates TGF-β mediated hepatocyte apoptosis[J].CellDeathDis, 2013, 4(1): e466.
Effect of roxithromycin on asthma smooth muscle cells proliferation,caveolin-1 and PI3K/Akt pathway
XU Hui, DAI Yuan-rong, LI Feng-qin,FU Yu-ru, XIA Meng-ling,GE Xiang-ting
(DeptofRespiratoryMedicine,theSecondAffiliatedHospitalofWenzhouMedicalUniversity,WenzhouZhejiang325027,China)
Aim To investigate the effect of roxithromycin(RXM) on TGF-β1 induced airway smooth muscle cells(ASMCs) proliferation of asthmatic rats via caveolin-1 and PI3K/Akt pathway.Methods Thirty male adult Sprague-Dawley rats were randomly divided into the normal group and the asthma group. Rat models of chronic asthma were prepared and rats ASMCs were culturedinvitro. The asthmatic ASMCs with TGF-β1, wortmannin (inhibitor of PI3K/Akt pathway), β-cyclodextrin (cholesterol elimination agent)and RXM were interfered.The last three groups were stimulated with TGF-β1.The cells were divided into:①TGF-β1 group,②asthma group,③normal group,④wortmannin+TGF-β1 group, ⑤β-CD+TGF-β1 group,⑥RXM+TGF-β1 group. Cells proliferation in each group was detected respectively with CCK8 method, and the expressions of caveolin-1 and p-Akt protein were detected with Western blot. Results The proliferation of ASMCs in TGF-β1 group increased significantly compared with that in normal group and asthma group(P<0.01,P<0.05).While the ASMCs in the TGF-β1+ wortmannin group, RXM+TGF-β1 group decreased significantly compared with those in TGF-β1 group(P<0.01).The expression of caveolin-1 in ASMCs of asthmatic group,TGF-β1 group, β-CD+TGF-β1 group decreased significantly compared with that in the normal group(P<0.05), and that in TGF-β1 group was less than in asthma group(P<0.05). The expression of p-Akt in ASMCs of asthma group increased significantly compared with that in normal group(P<0.05), and that in TGF-β1 group increased more than that in asthma group(P<0.05),while that in β-CD+TGF-β1 group increased more than that in TGF-β1 group. The expression of p-Akt in RXM+TGF-β1 group was less than that in TGF-β1 group. Conclusion RXM may supress TGF-β1-induced ASMCs proliferation in asthmatic rats, increase the expression of caveolin-1,and depress the activation of p-Akt.
roxithromycin;caveolin-1;PI3K;smooth muscle cells;asthma;airway remodeling
时间:2015-3-3 11:08 网络出版地址:http://www.cnki.net/kcms/detail/34.1086.R.20150303.1108.022.html
2014-10-13,
2014-12-28
浙江省自然科学基金资助项目(No Y2080466);温州市科技局项目(No Y20130351)
徐 慧(1980-),女,硕士,主治医师,研究方向:支气管哮喘发病机制,Tel:0577-88002714,E-mail:xh_tomy@163.com; 戴元荣(1963-),男,硕士,教授,研究方向:支气管哮喘发病机制,通讯作者,Tel:0577-88002714,E-mail:daiyr@126.com
10.3969/j.issn.1001-1978.2015.03.022
A
1001-1978(2015)03-0407-05
R-332;R322.74;R329.24;R562.25;R978.15