五味子提取物对苯并[a]芘诱导的早孕期大鼠胚胎损伤的保护作用及凋亡机制研究
2015-06-09侯海燕陈亚琼
梁 婧,王 华,侯海燕,3,孙 旸,陈亚琼,3
(1. 武警后勤学院附属医院妇产科,天津 300162; 2.天津中医药大学,天津 300193; 3.天津市职业与环境危害防制重点实验室,天津 300162)
五味子提取物对苯并[a]芘诱导的早孕期大鼠胚胎损伤的保护作用及凋亡机制研究
梁 婧1,2,王 华1,侯海燕1,3,孙 旸1,陈亚琼1,3
(1. 武警后勤学院附属医院妇产科,天津 300162; 2.天津中医药大学,天津 300193; 3.天津市职业与环境危害防制重点实验室,天津 300162)
目的 观察五味子提取物对妊娠前苯并[a]芘(BaP)暴露致早孕期大鼠胚胎损伤的防治作用,并探讨其内在机制。方法 将75只♀SD大鼠随机分为5组:正常对照组、BaP模型组、五味子低、中、高剂量组,每组15只。给药15 d后制备孕鼠模型,于妊娠d 9处死孕鼠,记录孕鼠各期体质量、子宫连胚总质量,并计算脏器系数;ELISA试剂盒检测大鼠血清β- CG及PROG水平;荧光定量PCR检测孕鼠胚胎中Bax、Bcl-2和caspase-3 mRNA表达水平;Western blot检测孕鼠胚胎中Bax、Bcl-2和caspase-3蛋白表达水平。结果 ①与对照组相比,模型组大鼠体质量、子宫连胚总系数、大鼠血清β-CG及PROG水平均下降,Bax及caspase-3 mRNA水平及蛋白表达上调,Bcl-2 mRNA水平及蛋白表达下调;② 五味子提取物治疗后,孕鼠体质量、子宫连胚总系数、大鼠血清β-CG及PROG水平较模型组上升,Bax及caspase-3 mRNA水平及蛋白表达下调,Bcl-2 mRNA水平及蛋白表达上调。结论 妊娠前苯并[a]芘暴露可对早孕期大鼠产生胚胎毒性,而五味子提取物可以抑制BaP造成的生殖损伤,这一保护作用可能是通过调节凋亡相关因子来实现的。
五味子提取物;苯并[a]芘;早孕期;胚胎毒性;凋亡;Bax;Bcl-2;caspase-3
随着经济的迅速发展和工业化的不断推进,环境问题日益凸显。环境与生殖健康成为人们热议的话题,环境对胚胎的影响也备受瞩目,成为当下学者关注的热点。化学环境污染物与人类生育能力降低、不良妊娠结局及子代出生缺陷密切相关[1-4]。多环芳烃(polycyclic aromatic hydrocarbons,PAHs)类化合物是人们日常能接触到的一类环境污染物[5],主要来源于不完全燃烧的有机物,如焚烧的垃圾、汽车尾气及烧烤的食物等等[6]。苯并[a]芘(benzo[a]pyrene, BaP)是多环芳烃类环境污染物中典型的一种,可经由呼吸、饮食等多种途径进入母体并透过胎盘屏障,在胚胎发育过程中通过氧化损伤和凋亡等途径产生胚胎毒性,进而影响胚胎的正常发育[7]。五味子是久负盛名的补肾固涩类中药,神农本草经列为上品,具补益强壮之功、奏固涩生津之效,能对人体五脏——心、肝、脾、肺、肾发挥平衡作用,中国药典将其列为补益类和镇静类中药[8]。现代药理研究表明,五味子的主要有效成分具有抗炎、抗凋亡等多种作用[9-11]。我们前期研究发现,妊娠后BaP暴露可以产生早孕期胚胎毒性,本研究采用妊娠前BaP染毒并加用中药五味子提取物灌胃,分组观测妊娠早期SD大鼠的各项指标,旨在明确妊娠前BaP暴露同样对早孕期大鼠胚胎造成生殖损伤,揭示五味子提取物对其早孕期生殖毒性的抑制作用,并对其机制进行初步探讨。
1 材料与方法
1.1 实验动物SPF级健康未生育8周龄SD大鼠150只,♀♂各半。♀鼠入室体质量(200±20) g,由北京华阜康生物科技股份有限公司提供,许可证号:SCXK(京)2009-0004。♀大鼠的发情周期由阴道脱落细胞学检查确定,动周期在4~7 d的♀大鼠备选入组。饲养条件:室温恒定于(22~26)℃,通风,相对湿度55%~65%,光照时间为12 h/d。♀♂鼠分开饲养于标准饲养盒内,每盒5只。饲料为SPF 级繁殖鼠料,食物和纯净水可自由摄取。动物入室后经1周平衡适应期再行后续实验。
1.2 药品、试剂及主要仪器五味子提取物的主要活性成分:五味子总素≥25%,五味子甲素 ≥6.3%,五味子乙素 ≥ 18.0%,五味子醇甲 + 五味子醇乙 + 五味子酯甲 ≥ 0.7%(陕西帕尼尔生物科技有限公司);3,4-Benzopyrene(日本TCI公司,纯度 ≥ 96%);羟甲基纤维素钠(天津市精细化工研究所);体积分数为0.009的氯化钠注射液(河北天成药业);大鼠绒毛膜促性腺激素β(β-CG)ELISA Kit、大鼠孕激素 / 孕酮(PROG) ELISA kit( 武汉华美生物工程有限公司);Hot Start Fluorescent PCR Core Reagent Kits(上海生工);Bax兔抗大鼠多克隆抗体(ab7977)、Bcl-2兔抗大鼠多克隆抗体(ab7973)、caspase-3兔抗大鼠单克隆抗体(ab32351)均为Abcam公司产品;山羊抗兔IgG(H+L)/HRP(北京中杉金桥,ZB-2301);组织蛋白抽提试剂盒(上海生工,BSP003);小型垂直电泳槽、凝胶成像系统、电泳仪(美国BIO-RAD公司);Nanodrop超微量核酸蛋白测定仪(美国Thermo公司)。
1.3 动物分组及处理75只♀鼠随机分为5组,每组15只。大鼠晨起于每日8 ∶00~9 ∶00灌胃。BaP模型组给予BaP 2 mg·kg-1·d,五味子低、中、高剂量组分别给予五味子提取物40、200、1 000 mg·kg-1·d-1+BaP 2 mg·kg-1·d-1,正常对照组给予相同体积的生理盐水。BaP以质量分数为1%羧甲基纤维素钠为助溶剂配成混悬液,配好后4 ℃避光保存。各组药物给药剂量均为1 mL·(100 g)-1。灌胃15 d后,停药并开始制备孕鼠模型,采用性周期筛选合笼法[12],即通过阴道涂片显微镜检(10×10),发现大量椭圆形有核上皮细胞即判断为♀鼠发情前期,将处于发情前期的♀鼠按照♀ ∶♂=1 ∶1比例合笼,自合笼d 2起每天上午8 ∶00开始进行阴道涂片观察( 棉签蘸取氯化钠注射液取大鼠阴道分泌物),并结合脱落的阴栓确定为孕0 d,以此推算孕龄。剔除未造模成功的大鼠,最终从每组组内随机选取10只孕鼠,共50只。各组妊娠大鼠于孕d 9(gestational day 9, GD 9)用颈椎脱臼法处死,并称取孕鼠相关组织器官进行检测。
1.4 观察指标及样品处理观察孕鼠一般状态、外观体征、行为活动及摄食情况,测定♀鼠体质量,给药前、给药d 5、d 10、d 15(给药结束)、GD 0、GD 4及GD 9(处死前)各测定1次。于妊娠d 9处死孕鼠,股动脉取血,静置2 h后,2 500 r·min-1离心5 min,留取血清行大鼠血清β-CG及PROG ELISA检测。切开腹部暴露两侧子宫,将子宫完整切下并剥离周边脂肪组织。称取脏器质量(子宫及胚胎总质量),计算脏器系数,脏器系数/%=脏器质量(wwt,湿重,g) / 体质量(g)×100%。称重后,剥离胚胎组织,观察胚胎组织的外观形态,放入液氮罐中,再转移至-80 ℃冰箱保存备用。
1.5 总RNA提取及Real-time PCR检测孕鼠胚胎Bax、Bcl-2和caspase-3 mRNA各组大鼠胚胎样本加入1 mL的TRIzol提取RNA。取RNA样品,紫外分光光度计测定样品RNA在波长260 nm和280 nm的紫外光吸收值,吸光度A=OD260/OD280,吸光度比值在1.8~2.0之间视为抽提的RNA纯度较高,提取的RNA -80 ℃保存。取6 μL的原始RNA进行反转录反应,cDNA的量是原始浓度稀释10倍进行荧光定量PCR检测(具体操作步骤按照SYBR Green试剂盒说明进行)。所有PCR引物(Primer Premier 5.0软件设计)均由上海生工生物工程技术服务有限公司合成,需要扩增的目的基因引物序列及片段长度见下表(Tab 1):
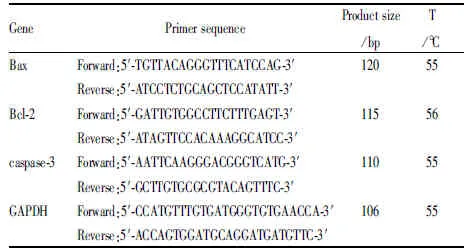
Tab 1 Real-time PCR primer sequence of target gene and product size
用于定量检测的荧光染料在Hot start fluo-PCR mix SYBR Green Ⅰ中已添加,反应体系20 μL:Hotstart Fluo-PCR mix(2×)10 μL,PCR Forward Primer(10 μmol·L-1)1 μL,PCR Reverse Primer(10 μmol·L-1)1 μL,RNase Free dH2O 7 μL,cDNA 1 μL。扩增条件:94 ℃预变性4 min,94 ℃变性30 s,55 ℃退火40 s,72 ℃延伸30 s,72 ℃终延伸10 min。40个循环72 ℃检测荧光信号。完成上述步骤后,把加好样品的96孔板放在Bio-Rad CFX96型荧光定量PCR仪中进行反应,并绘制PCR 产物的融解曲线。每个样品设3个平行孔,目的基因(Bax、Bcl-2和caspase-3)及内参照基因(GAPDH)均采用相对定量,各基因的相对表达水平以2-△△Ct来表示(△Ct = Ct目的基因-Ct GAPDH,△△Ct = △Ct处理组-△Ct对照组)。
1.6 蛋白提取及Western blot检测孕鼠胚胎Bax、Bcl-2和caspase-3蛋白表达各组大鼠脱臼处死后,剖腹剥取胚胎组织提取总蛋白。将胚胎组织用PBS清洗后裂解并研磨,离心取上清测蛋白浓度。Nanodrop超微量核酸蛋白测定仪进行蛋白定量,根据测定的蛋白质浓度,确定待检测蛋白样品上样量为30 μg。取蛋白样品加入4×loading buffer后,100 ℃煮沸变性5 min。以体积分数为0.1的SDS聚丙烯酰胺凝胶电泳分离,分离的蛋白用湿法转移到PVDF膜上。体积分数为0.05脱脂奶粉37 ℃封闭2 h。TBST漂洗后,加入一抗:Bax兔抗大鼠多克隆抗体(1 ∶100稀释)、Bcl-2兔抗大鼠多克隆抗体(1 ∶500稀释)、caspase-3兔抗大鼠单克隆抗体(1 ∶5 000稀释)4 ℃孵育过夜。TBST漂洗后,根据一抗加入对应的二抗,羊抗兔-HRP(1 ∶20 000稀释)室温摇床孵育1 h,洗膜后,采用ECL化学发光法显色、曝光。用凝胶分析软件Image J进行定量分析。
2 结果
2.1 孕鼠及胚胎一般状态观察
2.1.1 孕鼠的一般状态观察 正常对照组及五味子高、中、低剂量组大鼠一般状态好,外观未见明显异常,被毛光泽,活动佳,摄食正常,体重增加,二便正常,未见其他病理反应。模型组大鼠给予BaP染毒后体毛晦暗无光泽,活动差,嗜睡,对外界刺激欠敏感,摄食减少,体重增加不明显或减轻,二便减少。
2.1.2 胚胎一般状态观察 正常对照组及五味子高、中、低剂量组大鼠胚胎大小均匀,色泽良好,外观形态无异常,胚胎表面未见出血点及淤血斑块。模型组大鼠胚胎大小不均,数量少,色泽晦暗,肉眼观体积小于其他各组,且有异常出血点及淤血斑块形成(Fig 1)。
2.2 孕鼠体质量变化情况各组大鼠给药前、给药d 5、给药d 10体质量无明显变化,差异均无统计学意义(P>0.05)。给药d 15、GD 0、GD 4、GD 9,BaP模型组大鼠体质量增长缓慢,明显低于正常对照组及五味子高、中、低三个剂量组,且体质量差异有统计学意义(P<0.05或P<0.01)。正常对照组与五味子低、中、高剂量组四组间比较,大鼠体质量无明显变化,差异无统计学意义(P>0.05),见Fig 2。
2.3 孕鼠脏器系数统计至GD 9,BaP模型组孕鼠的子宫连胚总系数明显低于正常对照组(P<0.01)及五味子高、中、低三个剂量组(P<0.05或P<0.01)。五味子低、中、高剂量组孕鼠子宫连胚总系数水平较模型组明显升高,其中低、中剂量组与模型组相比差异有统计学意义(P<0.05),高剂量组与模型组相比差异有显著性(P<0.01)。正常对照组与五味子低、中、高剂量组四组间比较,孕鼠脏器系数无明显变化,差异无统计学意义(P>0.05),见Fig 3。
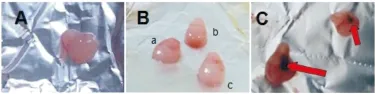
Fig 1 Changes in embryonic morphology of rats found in each group
A:Control group: the embryos were uniform, bright in color, no abnormal bleeding on the surface; B:SCE groups: there was no obvious change on the surface of embryo compared with control group(a:SCE 40 mg·kg-1group; b: SCE 200 mg·kg-1group; c: SCE 1 000 mg·kg-1group); C:Model group: the embryos were unevenly sized, dark and gloomy in color, abnormal blood stasis on the surface.
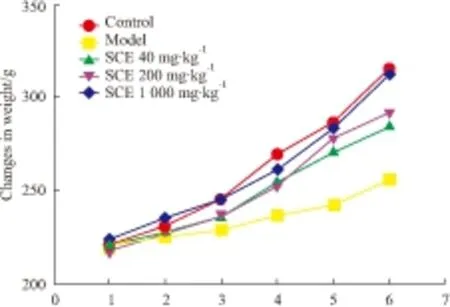
Fig 2 Changes in weight of each group(n=10)
1: Before treatment; 2: Intragastric administration for ten days; 3: Intragastric administration for fifteen days; 4: Gestational day 0(GD 0); 5: Gestational day 4(GD 4); 6: Gestational day 9(GD 9).
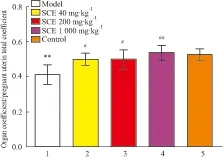
Fig 3 Changes in organ coefficient (pregnant uterine total
1: Model;2, 3 and 4: SCE 40, 200,1 000 mg·kg-1group, respectively; 5:Control.**P<0.01vscontrol group;#P<0.05,##P<0.01vsmodel group.
2.4 孕鼠血β-CG及孕酮水平至GD 9,BaP模型组孕鼠的血β-CG及PROG水平均明显低于正常对照组,差异有统计学意义(P<0.01)(见Fig 4);五味子中、高剂量组大鼠血β-CG水平高于BaP模型组,与BaP模型组相比,中剂量组有统计学差异(P<0.05),高剂量组差异有显著性(P<0.01)(见Fig 4A)。五味子低、中、高剂量组大鼠血PROG水平较模型组明显升高,其中低剂量组与模型组相比差异有统计学意义(P<0.05),中、高剂量组与模型组相比差异有显著性(P<0.01)(Fig 4B)。正常对照组与五味子低、中、高剂量组四组间比较,大鼠血β-CG及孕酮水平无明显变化,差异无统计学意义(P>0.05)。

Fig 4 Changes in levels of serum rat β chorionic
1: Model; 2, 3 and 4: SCE 40, 200, 1 000 mg·kg-1group, respectively; 5: Control;**P<0.01vscontrol group;#P<0.05,##P<0.01vsmodel group.
2.5 孕鼠胚胎Bax、Bcl-2和caspase-3 mRNA表达水平比较 Real-time PCR数据结果表明,与正常对照组大鼠相比,BaP模型组大鼠胚胎中Bax、caspase-3 mRNA表达明显升高(P<0.01);与BaP模型组比较,各剂量五味子组均可不同程度降低Bax、caspase-3 mRNA表达。其中,与模型组相比,低剂量五味子组及中、高剂量五味子组Bax、caspase-3 mRNA明显降低(P<0.05或P<0.01),且趋势一致(Fig 5A、C)。与BaP模型组相比,低剂量五味子组Bcl-2 mRNA表达无明显变化,中、高剂量五味子组Bcl-2 mRNA表达水平明显升高(P<0.05或P<0.01)(Fig 5B)。与正常对照组相比,五味子低、中剂量组Bax mRNA水平升高(P<0.05或P<0.01),五味子高剂量组Bax mRNA水平与正常对照组差异无显著性(P>0.05);正常对照组与五味子低、中、高剂量组四组间比较,孕鼠胚胎Bcl-2及caspase-3mRNA表达水平无明显变化,差异无统计学意义(P>0.05)。

1: Model; 2, 3 and 4: SCE 40, 200, 1 000 mg·kg-1group, respectively; 5: Control. A, B and C was the△△Ct result, respectively.**P<0.01vscontrol group;#P<0.05,##P<0.01vsmodel group.
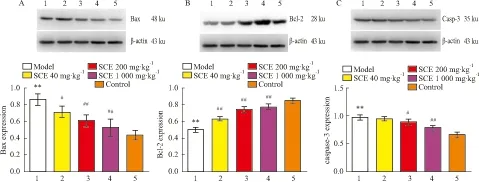
1: Model; 2, 3 and 4: SCE 40, 200, 1000 mg·kg-1group, respectively; 5: Control.**P<0.01vscontrol group;#P<0.05,##P<0.01vsmodel group.
2.6 孕鼠胚胎Bax、Bcl-2和caspase-3蛋白表达水平比较Western blot实验分析结果显示,正常对照组大鼠胚胎中有少量Bax及caspase-3蛋白表达,与正常对照组相比,BaP模型组大鼠胚胎中Bax、caspase-3蛋白表达明显升高(P<0.01);与BaP模型组比较,各剂量五味子组均可不同程度降低Bax、caspase-3蛋白表达。其中,与模型组相比,低剂量五味子组及中、高剂量五味子组Bax蛋白明显降低(P<0.05或P<0.01)(Fig 6A)。低剂量五味子组caspase-3蛋白表达较BaP模型组无明显变化,但中、高剂量五味子组caspase-3蛋白明显降低(P<0.05或P<0.01)(Fig 6C)。由Fig 6B结果显示,正常对照组Bcl-2蛋白表达较高,模型组Bcl-2蛋白表达明显降低(P<0.01),与模型组相比,低、中、高五味子组均可明显升高Bcl-2 蛋白表达(P<0.01)。与正常对照组相比,五味子低、中剂量组Bax蛋白表达水平升高(P<0.05或P<0.01),五味子高剂量组Bax蛋白表达水平与正常对照组比较差异无显著性(P>0.05)。与正常对照组相比,五味子低、中剂量组Bcl-2蛋白表达水平升高(P<0.05),五味子高剂量组Bcl-2蛋白表达水平与正常对照组差异无显著性(P>0.05);正常对照组与五味子低、中、高剂量组四组间比较,孕鼠胚胎caspase-3蛋白表达水平无明显变化,差异无统计学意义(P>0.05)。
3 讨论
在多环芳烃类化合物中,以BaP的分布最广、致癌性最强,其性质稳定,常存在于食品、香烟烟雾及被污染的空气中,可对各种生物体产生广泛的毒性[13]。国内外众多学者对这一典型环境污染物进行了多方面研究,但涉及生殖系统毒性的研究还未广泛开展。我们前期研究发现,BaP对妊娠早期胚胎和绒毛组织具有一定的损伤作用,是孕早期胚胎停育发生的危险因素[14-15]。本研究通过妊娠前经口灌服BaP的给药途径造成大鼠妊娠早期胚胎损伤模型,旨在观察并明确妊娠前期的BaP暴露同样会对妊娠早期的母体及胚胎发育产生毒性作用。实验结果表明,染毒后大鼠体质量增长缓慢,孕鼠子宫连胚总系数明显下降,大鼠血β-CG及孕酮水平明显降低,均显示BaP对大鼠母体及胚胎产生毒性作用,抑制胚胎正常着床及生长发育,对绒毛组织产生了一定的损伤,从而抑制了妊娠期母体体内相关激素的分泌和释放,揭示出妊娠前BaP暴露对孕早期胚胎的毒性作用,同时也显示BaP的生殖毒性在体内是一个慢性蓄积的过程,即使孕早期暴露、妊娠后脱离暴露环境,毒性依旧能持续存在于机体并对其产生各种毒性作用,引起损伤。
明确BaP对胚胎产生的生殖毒性后,我们试图进一步揭示BaP诱导胚胎损伤的深层机制。研究表明,BaP能诱导多种细胞发生凋亡[16-17]。因此,我们设想BaP可以诱导胚胎组织和细胞凋亡,从而引起生殖毒性。在本研究中选择以下典型凋亡指标进行检测:Bcl-2、Bax以及 caspase-3。细胞凋亡是一个复杂的生命过程,凋亡相关蛋白中Bcl-2家族是凋亡的关键调节因子,其中包括抑制凋亡和促进凋亡两类,二者协调作用共同完成凋亡的过程。Bcl-2和Bax这两个同源基因的蛋白水平高低与凋亡调控直接相关:Bcl-2高表达,形成异源二聚体抑制细胞凋亡;Bax高表达,形成同源二聚体促进细胞凋亡[18]。caspase家族在诱导细胞凋亡的过程中也起着关键性作用,是众多凋亡通路的交汇点,也是执行凋亡的最终途径。其中,caspase-3是细胞凋亡过程中最主要的终末剪切酶,在凋亡中发挥至关重要的作用[19]。本研究发现,孕前BaP暴露导致的受损胚胎中促凋亡基因Bax及caspase-3的mRNA水平及蛋白表达上调,抑凋亡基因Bcl-2的mRNA水平及蛋白表达下调,说明BaP可能通过改变Bcl-2、Bax异源二聚体的调控平衡,促进caspase-3的活性,进而诱导早期胚胎发生凋亡。
BaP致胚胎损伤的保护性研究尚少,寻找对抗BaP致胚胎损伤的药物成为焦点。五味子科植物以其在保胎方面独特的优势而备受瞩目,已成为天然产物化学及药理学研究的一个热点。本研究发现五味子中药组经五味子提取物干预后,大鼠孕早期体质量、子宫连胚总系数、大鼠血β-CG及孕酮水平较单纯BaP模型组有明显改善,与正常对照组相比无显著性差异。此外,五味子中药组可以使Bax及caspase-3的mRNA水平及蛋白表达下调,Bcl-2的mRNA水平及蛋白表达上调,协调凋亡因子的平衡,表明五味子提取物对环境污染物BaP所致胚胎毒性具有一定的拮抗作用,抑制胚胎及绒毛组织的凋亡,从而发挥保胎的作用。
[1] Wigle D T, Arbuckle T E, Turner M C, et al. Epidemiologic evidence of relationships between reproductive and child health outcomes and environmental chemical contaminants[J].JToxicolEnvironHealthBCritRev,2008, 11(5-6),373-517.
[2] Ramlau-Hansen C H, Thulstrup A M, Storgaard L, et al. Is prenatal exposure to tobacco smoking a cause of poor semen quality? A follow-up study[J].AmJEpidemiol, 2007,165(12):1372-9.
[3] Ballester F, Estarlich M, Iniguez C, et al. Air pollution exposure during pregnancy and reduced birth size: a prospective birth cohort study in Valencia, Spain[J].EnvironHealth,2010, 9:6.
[4] Pope D P, Mishra V, Thompson L,et al. Risk of low birth weight and stillbirth associated with indoor air pollution from solid fuel use in developing countries[J].EpidemiolRev, 2010,32(1):70-81.
[5] Srogi K. Monitoring of environmental exposure to polycyclic aromatic hydrocarbons: a review[J].EnvironChemLett, 2007, 5(4):169-95.
[6] Zheng Z, Park S Y, Lee M, et al. Effects of benzo(a)pyrene on the expression of heat shock proteins, pro-inflammatory cytokines and antioxidant enzymes in hepatic tumors induced by rat hepatoma N1-S1 cells.[J].JKoreanMedSci, 2011,26(2):222-30.
[7] Kelman B J, Springer D L. Movements of benzo [a] pyrene across the hemochorial placenta of the guinea pig[J].ExpBiolMed, 1982, 169(1):58-62.
[8] 中国药典2010年版.一部[S].2010:61-62.
[8] Ch.P(2010)Vol Ⅰ[S].2010:61-62.
[9] 樊林花,刘田福,郭 民,刘茂林.五味子乙素对染矽尘大鼠肺组织一氧化氮水平和诱导型一氧化氮合酶mRNA表达动态变化的影响[J].中国药理学通报,2011,27(2):225-8.
[9] Fan L H, Liu T F, Guo M, Liu M L. Effect of schisandrin B on dynamic change of content of nitric oxide and mRNA expression of inducible nitric oxide synthase in rat lungs exposed to silica[J].ChinPharmacolBull,2011,27(2):225-8.
[10] 曹 波,牛 聪,卢 涛,等.五味子乙素对UVB辐射诱导HaCat细胞凋亡的抑制作用及其机制[J].中国药理学通报,2014,30(4):523-7.
[10] Cao B, Niu C, Lu T, et al. Protective effect of schizandrin B against oxidative damage of UVB irradiated HaCaT cells and its molecular mechanism[J].ChinPharmacolBull, 2014,30(4):523-7.
[11] Song J X, Lin X, Wong R N, et al. Protective effects of dibenzocyclooctadiene lignans from Schisandra chinensis against beta-amyloid and homocysteine neurotoxicity in PC12 cells[J].PhytotherRes, 2011,25(3):435-43.
[12] 毕晓洁,李 兴,杨国珍,等. 两种大鼠受孕方法及两种判断受孕方法比较[J].贵阳医学院学报,2012,37(6):608-10.
[12] Bi X J, Li X, Yang G Z, et al. Raising the pregnant rate of rats and comparison of methods for inspecting pregnant rats[J].JGuiyangMedColl,2012,37(6):608-10.
[13] Alexandrov K, Rojas M, Satarug S. The critical DNA damage by benzo (a) pyrene in lung tissues of smokers and approaches to preventing its formation[J].ToxicolLett, 2010, 198(1): 63-8.
[14] 侯海燕,陈亚琼.母亲外周血BaP-DNA加合物与孕早期胚胎停育的关系[J].生殖医学杂志,2009,18(2):81-5.
[14] Hou H Y, Chen Y Q.The relationship between maternal blood BaP-DNA adduets and embryonic diapause[J].JReproductMed,2009, 18(2):81-5.
[15]Wu J, Hou H Y, Chen Y Q. Exposure to polycyclic aromatic hydrocarbons and missed abortion in early pregnancy in a chinese population[J].SciTotalEnviron, 2010, 408(11):2312-8.
[16] Kim J Y, Chung J Y, Park J E, et al. Benzo [a] pyrene induces apoptosis in RL95-2 human endometrial cancer cells by cytochrome P450 1A1 activation[J].Endocrinology, 2007, 148(10): 5112-22.
[17] van Grevenynghe J, Sparfel L, Le Vee M, et al. Cytochrome P450-dependent toxicity of environmental polycyclic aromatic hydrocarbons towards human macrophages[J].BiochemBiophysResCommun, 2004, 317(3): 708-16.
[18] Reed J C. Double identity for proteins of the Bcl-2 family[J].Nature,1997, 387(6639): 773-6.
[19] Amna T, Van Ba H, Vaseem M, et al. Apoptosis induced by copper oxide quantum dots in cultured C2C12 cells via caspase 3 and caspase 7: a study on cytotoxicity assessment[J].ApplMicrobiolBiotechnol, 2013, 97(12): 5545-53.
Effect ofSchisandrachinensisextract on benzo[a]pyrene-induced apoptosis in embryo of rat and its mechanisms
LIANG Jing1,2,WANG Hua1,HOU Hai-yan1,3,SUN Yang1,CHEN Ya-qiong1,3
(1.DeptofGynaecologyandObstetrics,AffiliatedHospitalofLogisticsUniversityofPeople’sArmedPoliceForce,Tianjin300162,China;2.TianjinUniversityofTraditionalChineseMedicine,Tianjin300193,China;3.TianjinKeyLaboratoryforPreventionandControlofOccupationalandEnvironmentalHazards,Tianjin300162,China)
Aim To investigate the role ofSchisandrachinesisextract (SCE) in benzo[a]pyrene(BaP)-induced apoptosis in embryo of rat and its underlying mechanism. Methods 75 SD female rats were randomly divided into 5 groups: control group, model group, low dose group, middle dose group and high dose group with 15 rats in each group. After 15 days of gavage, male and female rats were mated in the same cage. On the ninth day of gestation, all the rats were sacrificed. Body of weight and total organ coefficient (pregnant uterine total coefficient) were examined. Levels of serum rat β chorionic gonadotropin and progesterone were determined by ELISA Kits. The mRNA levels of Bax, Bcl-2 and caspase-3 in embryos were determined by real time-PCR, and the expressions of Bax, Bcl-2 and caspase-3 were examined by Western blot. Results ①Compared with control group, the weight of pregnant rats, organ coefficient (pregnant uterine total coefficient), levels of serum rat β chorionic gonadotropin and progesterone in BaP group were decreased significantly, mRNA and protein expression of Bcl-2 decreased dramatically, while mRNA and protein expression of Bax and caspase-3 increased significantly. ②After treatment with SCE the weight of pregnant rats, organ coefficient (pregnant uterine total coefficient), levels of serum rat β chorionic gonadotropin and progesterone were increased, mRNA and protein expression of Bcl-2 increased significantly compared with BaP group, while mRNA and protein expression of Bax and caspase-3 were decreased. Conclusion BaP exposure before pregnancy can generate embryo toxicity in rats. SCE can inhibit the reproductive damage induced by BaP, and this positive effect may be related to the cell apoptosis mechanism.
Schisandrachinesisextract; benzo[a]pyrene; early pregnancy; embryo toxicity; apoptosis; Bax; Bcl-2; caspase-3
时间:2015-3-3 11:08 网络出版地址:http://www.cnki.net/kcms/detail/34.1086.R.20150303.1108.017.html
2014-10-24,
2014-12-28
国家自然科学基金资助项目(No 81273977);天津市自然科学基金资助项目(No 12JCYBJC16200)
梁 婧(1985-),女,博士生,研究方向:环境与优生,E-mail:liangjing19850903@163.com; 王 华(1983-),女,学士,住院医师,研究方向:妇产科超声诊断,并列第一作者,E-mail:w.h6689@163.com; 。 陈亚琼(1956-),女,博士,教授,博士生导师,研究方向:生殖与不孕,通讯作者,Tel:022-60577582,E-mail:chenyq82@hotmail.com
10.3969/j.issn.1001-1978.2015.03.017
A
1001-1978(2015)03-0381-07
R-332;R284.1;R329.25;R321.4;R714.1