Liguzinediol对普萘洛尔诱导的急性心衰豚鼠心功能的影响
2015-06-09章嫡妮卞慧敏
徐 斌,李 育,2,章嫡妮,林 超,钱 星,李 伟,卞慧敏,3
(1.南京中医药大学药学院,2.基础医学院,3.江苏省中药药效与安全性评价重点实验室,江苏 南京 210046)
Liguzinediol对普萘洛尔诱导的急性心衰豚鼠心功能的影响
徐 斌1,李 育1,2,章嫡妮1,林 超1,钱 星1,李 伟1,卞慧敏1,3
(1.南京中医药大学药学院,2.基础医学院,3.江苏省中药药效与安全性评价重点实验室,江苏 南京 210046)
目的 研究Liguzinediol对普萘洛尔所致豚鼠急性心衰模型的治疗作用并评价其效能、效价和治疗指数。方法 静脉注射普萘洛尔建立豚鼠急性心力衰竭(AHF)模型后,分组静脉恒速注射给予Liguzinediol (2.85、5.70、11.40、22.80、45.60、91.20 mg·kg-1)及阳性药盐酸肾上腺素(0.31 mg·kg-1),用RM6240多道生理信号采集处理系统记录给药0、5、10、20、40、60、90和120 min时左心室内压最大上升/下降速率(±dp/dtmax)、左心室内压(LVSP)、动脉收缩压(MSP)、动脉舒张压(MDP)和心率(HR)的变化;计算该药的效能、效价和治疗指数。结果 Liguzinediol (11.40、22.80和45.60 mg·kg-1)能有效升高模型豚鼠+dp/dtmax、LVSP、MSP、MDP和HR,降低-dp/dtmax, Liguzinediol (2.85、5.70 mg·kg-1)作用较弱,ED50约为12.93 mg·kg-1,治疗指数(LD50/ED50)为131,45.60 mg·kg-1已达最大效能,再加大剂量至91.20 mg·kg-1其效应并不能相应增强。结论 Liguzinediol对急性心衰豚鼠的血流动力学指标有明显的改善作用,其安全性比同类药物高。
Liguzinediol;豚鼠急性心力衰竭模型;血流动力学;效价;效能;治疗指数
急性心力衰竭(acute heart failure,AHF)是指由各种心脏疾病导致心功能不全的一种综合征,绝大多数情况下是指心肌收缩力下降,使心排血量不能满足机体代谢需要,器官、组织灌流不足,同时出现体循环和(或)肺循环淤血的表现[1]。急性心力衰竭发病、进展快,并发症多,预后极差,病死和住院率高,已成为危害人类健康的重要问题[2]。目前治疗AHF的药物有正性肌力药、利尿药、血管扩张药等。但这些药物大多安全窗窄,有反射性加快心率、电解质紊乱、心律失常等副作用[3]。Liguzinediol为川芎嗪进行结构修饰而得到的化合物,化学名为 2,5- 二羟甲基 -3,6-二甲基吡嗪[4-6]。前期研究发现,Liguzinediol具有较强的正性肌力作用,且无心律失常等副作用[7]。本实验利用普萘洛尔静脉注射造成急性心力衰竭模型,来观察Liguzinediol对模型豚鼠的心功能影响,并计算其效价、效能和治疗指数,以期为临床用药提供依据。
1 材料与方法
1.1 药品、试剂Liguzinediol(南京中医药大学药学院李伟教授提供,批号:20130506,纯度达99.57%);氯化钠购自南京化学试剂有限公司。普萘洛尔(propranolol)购自Sigma公司。盐酸肾上腺素购自上海和丰制药有限公司。 肝素购自上海如吉生物科技发展有限公司。水合氯醛购自天津市科密欧化学试剂有限公司。
1.2 仪器RM6240 系列多道生理信号采集处理系统购自成都仪器厂。WZS-50F6 注射泵购自浙江浙大医学仪器有限公司。电子天平购自北京赛多利斯天平有限公司。
1.3 实验动物健康普通级豚鼠,体质量340~370 g,购自南京青龙山动物繁殖厂,饲喂全价营养颗粒饲料,自由采食及饮水。动物生产许可证号:SCXK(苏)2012-0008。使用许可证号:SYXK(苏)2010-0006。
2 方法
2.1 普萘洛尔致心衰豚鼠模型的建立体质量340~370 g的豚鼠,10%水合氯醛腹腔麻醉(0.36 g·kg-1),仰卧固定,将豚鼠四肢皮下插入心电图针形电极,输入多导仪I导联心电图(ECG)和心率(HR)。颈部剃毛,于胸锁乳突肌的内侧分离右颈总动脉,左右侧颈外浅静脉,将连接压力换能器的左室导管(内充肝素) 由颈总动脉向近心端方向插入右侧颈总动脉,结扎线稍做固定,撤去动脉夹,此时监视器所示的波型为动脉血压波形,然后向心方向缓慢推入插管,边推边观察监视器波形变化,当监视器上由血压波波形转变为下沿贴近基线 0 mmHg 附近并具有明显的舒张期且峰顶平坦的波形时,提示导管前端已达左心室内,此时再将导管深入0.1~0.3 cm,待波形稳定后将导管固定于胸锁乳头肌上,经压力换能器与多导生理记录仪相连用于记录左室内压最大上升速度(+dp/dtmax)、左室内压最大下降速度(-dp/dtmax)、左室内压(LVSP)和心率(HR)。分离左侧股动脉进行动脉插管,测量动脉收缩压(MSP)和动脉舒张压(MDP)。手术后稳定15 min,实时记录上述指标变化,并由左侧颈外浅静脉注射普萘洛尔20~32 mg·kg-1,当±dp/dtmax降到正常值2/3以下时,使用0.6 mg·kg-1·min-1剂量维持造模。当±dp/dtmax稳定5 min以上,且无明显上升趋势,即视为急性心衰模型复制成功。
将造模后的豚鼠随机分为模型对照组(生理盐水6 ml·kg-1,n=8)、盐酸肾上腺素对照组(盐酸肾上腺素注射液0.31 mg·kg-1,n=8)、Liguzinediol组(2.85、5.70、11.40、22.80、45.60、91.20 mg·kg-1,各组n=8)。待模型稳定5 min,然后进行右侧颈外浅静脉恒定速度推注给药,观察记录豚鼠给药5、10、20、40、60、90、120 min后±dp/dtmax、LVSP、MSP、MDP及HR的变化,并计算变化率。
变化率/%=(给药后值-造模值)/造模值×100%。
3 结果
3.1 Liguzinediol对模型豚鼠+dp/dtmax的影响变化率结果显示:普萘洛尔造模后豚鼠+dp/dtmax下降明显,达到心衰标准(+dp/dtmax下降超过40%,-dp/dtmax上升超过40%),和空白组相比差异显著(P<0.01),在120 min内其波动不明显。盐酸肾上腺素组和Liguzinediol各剂量组均有一定升高+dp/dtmax的作用,其中盐酸肾上腺素组从40 min开始与模型组相比差异显著;Liguzinediol 2.85和5.70 mg·kg-1组在120 min内与模型组比较无显著性差异,11.40 mg·kg-1组在给药120 min、22.80 mg·kg-1组在60和120 min、45.60 mg·kg-1组在60和90 min,以及91.20 mg·kg-1从60到120 min均与模型组相比差异显著(P<0.05),并呈剂量依赖性,在45.60 mg·kg-1时作用达到最大效应强度,剂量增加至91.20 mg·kg-1时效应并没有增强。通过SPSS软件统计分析: ED50=12.33 mg·kg-1,见Tab 1,Fig 1。
3.2 Liguzinediol对模型豚鼠-dp/dtmax的影响变化率结果显示:造模后豚鼠-dp/dtmax显著上升(上升大于40%),和空白组相比差异有显著性(P<0.01)。盐酸肾上腺素组和Liguzinediol各组在各时间点均有降低大鼠-dp/dtmax的趋势,其中盐酸肾上腺素组在给药40 min开始与模型组相比有差异;>Liguzinediol 2.85 mg·kg-1组与模型组相比各时间点均无显著差异,5.7 mg·kg-1组在给药60 min,以及11.4、22.8、45.6、91.2 mg·kg-1组从在60到120 min时,与模型组相比差异均有显著性(P<0.05),并成剂量依赖性,在22.8 mg·kg-1时作用接近最大效应,通过SPSS软件分析:ED50=8.72 mg·kg-1(Tab 2,Fig 2)。

Tab 1 Effect of liguzinediol on +dp/dtmax in a guinea model of propranolol-induced acute heart ±s,n=8)
*P<0.05,**P<0.01vssham;#P<0.05,##P<0.01vsmodel;△△P<0.01vsbefore modeling;▲P<0.05,▲▲P<0.01vsafter modeling

A:Effect of liguzinediol on +dp/dtmaxchange rate in a guinea model of propranolol-induced acute heart failure;B:Effect of liguzinediol on +dp/dtmaxchange rate in a guinea model of propranolol-induced acute heart failure at 120 min
3.3 Liguzinediol对模型豚鼠LVSP的影响模型豚鼠LVSP显著下降,和空白组相比有显著性差异(P<0.01)。变化率结果发现盐酸肾上腺素组和Liguzinediol各剂量组均有一定升高LVSP的作用趋势,其中盐酸肾上腺素组在给药5 min开始显示与模型组相比有显著差异;2.85、5.70和91.20 mg·kg-1组与模型组相比各时间点差异均无显著性。11.40 mg·kg-1在给药90 min, 22.80 mg·kg-1组在60 min、45.60 mg·kg-1在120 min时能观察到LVSP值上升明显,与模型组相比差异有显著性(P<0.05)。通过SPSS软件统计分析:ED50=5.66 mg·kg-1(Tab 3,Fig 3)。
3.4 Liguzinediol对普萘洛尔致心衰豚鼠MSP的影响造模后豚鼠MSP明显下降,和空白组相比差异有显著性(P<0.01)。变化率结果显示盐酸肾上腺素组和Liguzinediol各剂量组MSP均有升高的趋势,其中盐酸肾上腺素组从给药5 min 起与模型组比差异有显著性;Liguzinediol 2.85 mg·kg-1组与模型组各时间点相比差异均无显著性,5.70 mg·kg-1组在给药60和90 min、11.40 mg·kg-1组在5、40、60和90 min时,以及22.80 mg·kg-1组从10 min开始、45.60和91.20 mg·kg-1组从20 min时起MSP开始明显上升,与模型组相比差异有显著性(P<0.05),并呈剂量依赖性,在45.60 mg·kg-1时作用达到最大效应,通过SPSS统计分析: ED50=4.75 mg·kg-1(Tab 4,Fig 4)。

Tab 2 Effect of liguzinediol on -dp/dtmax in a guinea model of propranolol-induced acute heart ±s,n=8)
*P<0.05,**P<0.01vssham;#P<0.05,##P<0.01vsmodel;△△P<0.01vsbefore modeling;▲P<0.05,▲▲P<0.01vsafter modeling
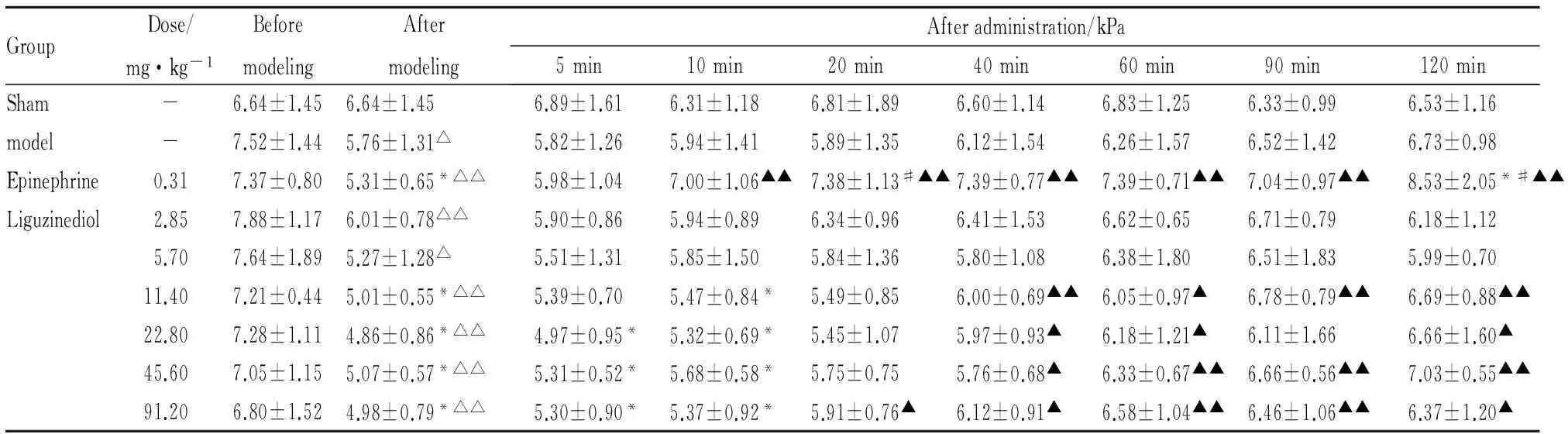
GroupDose/mg·kg-1BeforemodelingAftermodelingAfteradministration/kPa5min10min20min40min60min90min120minSham-6.64±1.456.64±1.456.89±1.616.31±1.186.81±1.896.60±1.146.83±1.256.33±0.996.53±1.16model-7.52±1.445.76±1.31△5.82±1.265.94±1.415.89±1.356.12±1.546.26±1.576.52±1.426.73±0.98Epinephrine0.317.37±0.805.31±0.65*△△5.98±1.047.00±1.06▲▲7.38±1.13#▲▲7.39±0.77▲▲7.39±0.71▲▲7.04±0.97▲▲8.53±2.05*#▲▲Liguzinediol2.857.88±1.176.01±0.78△△5.90±0.865.94±0.896.34±0.966.41±1.536.62±0.656.71±0.796.18±1.125.707.64±1.895.27±1.28△5.51±1.315.85±1.505.84±1.365.80±1.086.38±1.806.51±1.835.99±0.7011.407.21±0.445.01±0.55*△△5.39±0.705.47±0.84*5.49±0.856.00±0.69▲▲6.05±0.97▲6.78±0.79▲▲6.69±0.88▲▲22.807.28±1.114.86±0.86*△△4.97±0.95*5.32±0.69*5.45±1.075.97±0.93▲6.18±1.21▲6.11±1.666.66±1.60▲45.607.05±1.155.07±0.57*△△5.31±0.52*5.68±0.58*5.75±0.755.76±0.68▲6.33±0.67▲▲6.66±0.56▲▲7.03±0.55▲▲91.206.80±1.524.98±0.79*△△5.30±0.90*5.37±0.92*5.91±0.76▲6.12±0.91▲6.58±1.04▲▲6.46±1.06▲▲6.37±1.20▲
*P<0.05,**P<0.01vssham;#P<0.05,##P<0.01vsmodel;△P<0.05,△△P<0.01vsbefore modeling;▲P<0.05,▲▲P<0.01vsafter modeling
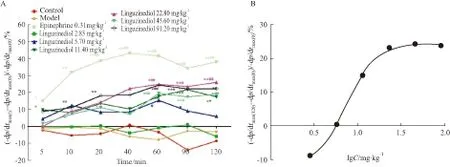
A:Effect of liguzinediol on -dp/dtmaxchange rate in a guinea model of propranolol-induced acute heart failure;B:Effect of liguzinediol on -dp/dtmaxchange rate in a guinea model of propranolol-induced acute heart failure at 120min
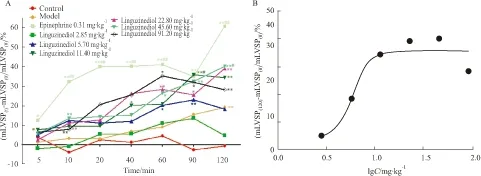
A:Effect of liguzinediol on LVSP change rate in a guinea model of propranolol-induced acute heart failure;B:Effect of liguzinediol on LVSP change rate in a guinea model of propranolol-induced acute heart failure at 120 min
3.5 Liguzinediol对模型豚鼠MDP的影响模型豚鼠MDP下降明显,与空白组相比差异有显著性(P<0.01)。计算变化率发现盐酸肾上腺素组和Liguzinediol各剂量组均有升高MDP的趋势,其中盐酸肾上腺素组在给药5 min开始与模型组相比差异有显著性;Liguzinediol(2.85 mg·kg-1)组与模型组无差异。5.70 mg·kg-1组在给药40、60和 90 min, 11.40 mg·kg-1从40 min开始、22.80 mg·kg-1在20、40、60、120 min、45.60 mg·kg-1组从20 min起,以及91.20 mg·kg-1组从10min开始时与模型组相比差异有显著性(P<0.05),并呈剂量依赖性,在91.2 mg·kg-1时作用达到最大效应强度,通过SPSS软件统计分析:ED50= 14.67 mg·kg-1,见Tab 5,Fig 5。3.6 Liguzinediol对模型豚鼠心率(HR)的影响 造模后豚鼠HR下降明显,与空白组相比差异有显著性(P<0.01)。盐酸肾上腺素组在给药5 min开始显著升高心率,与模型组相比差异有显著性;Liguzinediol 2.85 mg·kg-1组与模型组差异无显著性。11.40 mg·kg-1组在给药90 min, 22.80 mg·kg-1从60 min开始、45.60和91.20 mg·kg-1在90和120 min与模型组相比差异有显著性(P<0.05),并呈剂量依赖性,在91.2 mg·kg-1时作用达到最大效应强度,通过SPSS软件统计分析:ED50= 14.67 mg·kg-1,见Tab 6,Fig 6。

Tab 4 Effect of liguzinediol on MSP in a guinea model of propranolol-induced acute heart ±s,n=8)
*P<0.05,**P<0.01vssham;#P<0.05,##P<0.01vsmodel;△P<0.05,△△P<0.01vsbefore modeling;▲P<0.05,▲▲P<0.01vsafter modeling

Tab 5 Effect of liguzinediol on MDP in a guinea model of propranolol-induced acute heart ±s,n=8)
*P<0.05,**P<0.01vssham;#P<0.05,##P<0.01vsmodel;△P<0.05,△△P<0.01vsbefore modeling;▲P<0.05,▲▲P<0.01vsafter modeling

A:Effect of liguzinediol on MSP change rate in a guinea model of propranolol-induced acute heart failure;B:Effect of liguzinediol on MSP change rate in a guinea model of propranolol-induced acute heart failure at 120min

A:Effect of liguzinediol on MDP change rate in a guinea model of propranolol-induced acute heart failure;B:Effect of liguzinediol on MDP change rate in a guinea model of propranolol-induced acute heart failure at 120min
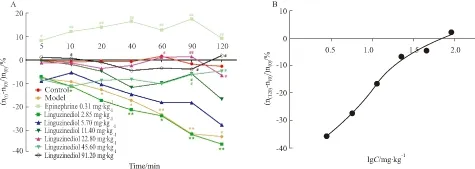
A:Effect of liguzinediol on heart rate change rate in a guinea model of propranolol-induced acute heart failure;B:Effect of liguzinediol on heart rate change rate in a guinea model of propranolol-induced acute heart failure at 120 min
Tab 6 Effect of liguzinediol on HR in a guinea model of propranolol-induced acute heart ±s,n=8)
*P<0.05,**P<0.01vssham;#P<0.05,##P<0.01vsmodel;△P<0.05,△△P<0.01vsbefore modeling;▲P<0.05,▲▲P<0.01vsafter modeling
3.7 Liguzinediol对普萘洛尔诱导的急性心衰豚鼠治疗作用及治疗指数的评价经统计发现Liguzinediol对模型豚鼠±dp/dtmax、MDP作用更为明显,其ED50分别为:12.33、8.72和14.67 mg·kg-1,综合取平均值,ED50约为11.91 mg·kg-1。根据小鼠静脉给药的LD50为1692.2 mg·kg-1[8],计算出治疗指数LD50/ED50约为142。
4 讨论
心力衰竭是指心脏病变使得血液搏出量不能满足组织器官的灌注及肺部淤血等一系列综合症。临床研究发现,因心衰而住院的病例中,大多数是急性心衰患者[9]。因此本实验选择豚鼠急性心衰模型来进行药效学研究。
普萘洛尔是β受体阻断剂,大剂量可以迅速降低血压、心率、心肌收缩力,使心功能达到心衰阈,用恒流泵给予维持剂量,可以使心衰模型稳定[10]。实验结果表明模型豚鼠+dp/dtmax下降超过40%,-dp/dtmax上升超过40%,达到心衰模型的标准,且在120 min内稳定;LVSP、MSP、MDP、HR均明显降低,与文献报道相似[11],而LEVDP较假手术组没有差异,可能由于心功能仍处于代偿期,左心室舒张压未出现明显升高。在给予liguzinediol(11.40、22.80、45.60 mg·kg-1)治疗后,模型动物+dp/dtmax和血压均有不同程度的升高,-dp/dtmax有不同程度的下降,豚鼠血流动力学各项参数均得到改善。前期研究[12-14]也表明liguzinediol对急、慢性心力衰竭模型大鼠均具有较强的正性肌力作用。
本实验阳性药选用β受体激动剂盐酸肾上腺素,其可以拮抗普萘洛尔的作用。在预试时曾选用西地兰注射液作为阳性对照,但结果发现用药后不仅未能纠正心衰,且因发生房室传导阻滞而致心率过慢,导致豚鼠死亡。其原因分析可能是:(1)西地兰对心肌的正性肌力作用反射性兴奋迷走神经。(2)西地兰可以增加心肌对迷走神经的敏感性,使心律在心衰基础上再次降低,导致豚鼠死亡,所以改用盐酸肾上腺素[15]。盐酸肾上腺素作用快速,但由于与普萘洛尔存在竞争关系,效应下降很快,我们选择静脉缓慢推注给药,速度为0.0025 mg·kg-1·min-1。
一线抗心衰药物主要都是通过改善血流动力学和运动耐量来提高患者生活质量,其中加强心肌收缩功能是很重要的治疗方法。常用的正性肌力药有两大类:第1类是通过增加细胞内环化-磷酸腺苷(cAMP)水平而增加心肌收缩力,包括β-受体激动剂、磷酸二酯酶(PDE)Ⅲ抑制剂和腺苷酸环化酶抑制剂。另一类为通过影响离子通道和细胞内钙浓度分布来调节心肌收缩力。这些药物均有不同程度的致心律失常和心脏毒性等副作用[16]。如长期口服PDEⅢ抑制剂米力农会发生心律失常性猝死。而洋地黄类强心苷如地高辛等,有效剂量已接近中毒剂量的60%,个体对药物的敏感性及生物利用度差异大,易发生快速性心律失常、房室传导阻滞、窦性心动过缓等不同程度的毒性反应。Liguzinediol的作用机制不同于现有的强心药,其作用靶点可能是心肌细胞内肌浆网蛋白Ca2+-ATP酶,通过将Ca2+转运至内质网来调节细胞内钙稳态发挥正性肌力作用[17],Larissa等[18]预测,这将是到目前为止治疗心力衰竭最理想的靶点。 我们实验发现,liguzinediol在所有剂量下均未见心律失常发生,经计算其治疗指数约为142,由此可见,相对正性肌力类等抗心衰药物,其毒性小,安全性高,治疗窗宽,相信会有广阔的应用前景。
[1] Veronique Lr. The heart failure epidemic[J].IntJEnvironmentalReasearchandPublicHealth, 2010, 7: 1807-30.
[2] 董吁钢,马跃东. 心力衰竭与血压[J]. 内科理论与实践,2012,7(5):344-7.
[2] Dong Y G, Ma Y D. Heart failure and blood pressure [J].JIntermMedConceptsPract,2012, 7(5): 344-7.
[3] 郭晓曦,张珊珊. 心力衰竭的药物治疗新进展[J]. 心血管病学进展,2010, 31(4):634-7.
[3] Guo X X, Zhang S S. New drug treatment of heart failure [J].AdvCardiovascDis,2010,31(4):634-7.
[4] 陈 磊,李 伟,陈 龙,等. 川芎嗪仲醇类衍生物的合成及其正性肌力活性研究[J]. 中国药学杂志,2013,48(13):23-7.
[4] Chen L, Li W, Chen L, et al. Synthesis and positive inotropic effects of the secondary alcohol derivatives of liguzinediol [J].ChinJDrugsClinRem,2013, 48(13):23-7.
[5] 刘贞兴,李 伟,陈 龙,等. Liguzinediol甲基替代衍生物的合成及其正性肌力活性研究[J]. 中国新药与临床杂志,2014,33(5):357-63.
[5] Liu Z X, Li W, Chen L, et al. Synthesis and positive inotropic effect of methyl-substituted derivatives of Liguzinediol [J].ChinJDrugsClinRem, 2014, 33(5):357-63.
[6] Liu Z X, Li W, Wen H, et al.Synthesis, biological evaluation, and pharmacokinetic study of novel liguzinediol prodrugs [J].Molecules,2013,18(4):4561-72.
[7] 郭 瑶,周 静,卞慧敏,等.川芎嗪衍生物ligzinediol对戊巴比妥钠致急性心力衰竭大鼠血流动力学的影响[J].中国实验方剂学杂志,2012,18(6):170-4.
[7] Guo Y, Zhou J, Bian H M, et al. The effect of ligzinediol on hemodynamics in rats with acute heart failure induced by pentobarbital [J].ChinJExperimentalTraditMedFormul, 2012,18(6):170-4.
[8] 闻 侃,刘 峥,卞慧敏,等. Liguzinediol 的急性毒性[J].中国新药与临床杂志,2011,30(3):234-5.
[8] Wen K, Liu Z, Bian H M, et al. Acute toxicity of Liguzinediol [J].ChinJDrugsClinRem,2011, 30(3): 234-5.
[9] 顾东风,黄广勇,何 江,等. 中国心力衰竭流行病学调查及其患病率[J]. 中华心血管病杂志,2003,31(1):3-6.
[9] Gu D F, Huang G Y, He J, et al. Investigation of prevalence and distributing feature of chronic heart failure in Chinese adult population[J].ChinJCardiol, 2003,31(1):3-6.
[10] Sheldon E l, Sarah E K, James P M, et al. Effects of propranolol treatment on left ventricular function and intracellular calcium regulation in rats with postinfarction heart failure[J].BritishJPharmacol, 1999, 127:1671-9.
[11] 毛新民,兰 怡,王晓雯,等. 温心宝口服液对豚鼠急性心衰左心室功能的影响[J]. 新疆医科大学学报,2002,25(1):22-5.
[11] Mao X M, Lan Y, Wang X W, et al. The effects of Wenxibao oral liquid on left ventricular function of guinea pig with heart failure induced by propranolol [J].JXinjiangMedUniv, 2002, 25(1):22-5.
[12] 章嫡妮,郭 瑶,李卓琼,等. Liguzinediol 对压力超负荷大鼠心室重构的影响[J]. 中国药理学通报,2012,28(12):1699-704.
[12] Zhang D N, Guo Y, Li Z Q, et al. Effect of Liguzinediol on ventricular remodeling in press-overloaded rats[J].ChinPharmacolBull,2012, 28(12):1699-704.
[13] 刘 峥,卞慧敏,陈 龙,等. Liguzinediol 对正常大鼠心脏血流动力学的影响[J].中国药学杂志,2009,44(15):1155-8.
[13] Liu Z, Bian H M, Chen L, et al. Effect of Liguzinediol on cardiac hemodynamics in healthy rats [J].ChinPharmJ,2009, 44(15):1155-8.
[14] 徐 毅,罗卓卡,刘泉明,等. Liguzinediol 的正性肌力作用机制及心脏安全性[J]. 中国药理学与毒理学杂志,2012,26(2):151-6.
[14] Xu Y, Luo Z K, Liu Q M, et al. Positive intropic mechanism of Liguzinediol and heart safety evaluation [J].ChinPharmacolToxicol,2012, 26(2):151-6.
[15] 徐彦立. 西地兰与硝普钠治疗急性左心力衰竭的临床疗效对比分析[J]. 中国现代药物应用, 2014,12(8):98-9.
[15] Xu Y L. Comparative analysis of clinical efficacy cedilanid with sodium nitroprusside treatment of acute left heart failure[J].ChinJModDrugApplication, 2014,12(8):98-9.
[16] Gjesdal K, Feyzi J, Olsson S B. Digitalis: a dangerous drug in atrial fibrillation? An analysis of the SPORTIF III and V data [J].Heart,2008, 94(2):191-6.
[17] Chen L, Xu Y, Li W, et al. The novel compound liguzinediol exerts positive inotropic effects in isolated rat heart via sarcoplasmic reticulum Ca2+ATPase-dependent mechanism [J].LifeSciences,2012, 91: 402-8.
[18] Larissa Lipskaia, Elie R Chemaly, Lahouaria Hadri, et al. Sarcoplasmic reticulum Ca2+ATPase as a therapeutic target for heart failure [J].ExpertOpinBiolTher, 2010, 10(1):29.
Effect of liguzinediol on cardiac function in acute heart failure guinea pig induced by propranolol
XU Bin1,LI Yu1,2,ZHANG Di-ni1,LIN Chao1,QIAN Xin1,LI Wei1,3,BIAN Hui-min1,3
(1.CollegeofPharmacy,NanjingUniversityofChineseMedicine,Nanjing210046,China;2.DeptofPreclinicalMedicine,NanjingUniversityofChineseMedicine,Nanjing210046,China;3.JiangsuKeyLaboratoryforPharmacologyandSafetyEvaluationofChineseMateriaMedicine,Nanjing210046,China)
Aim To study the effect of liguzinediol on cardiac function in acute heart failure (AHF) guinea pig induced by propranolol, and evaluate its efficacy, potency and therapeutic index. Methods The AHF model in guinea pigs was copied by propranolol. Different doses of liguzinediol (2.85, 5.70, 11.40, 22.80, 45.60 and 91.20 mg·kg-1) and adrenaline hydrochloride (0.31 mg·kg-1) were injected intravenously. The changes of the ±dp/dtmax, LVSP, MSP, MDP and HR were recorded by RM6240 system after the administration in 0, 5, 10, 20, 40, 60, 90 and 120min. The efficacy, potency and therapeutic index of liguzinediol were calculated finally. Results Compared with model group, these doses of liguzinediol (2.85, 5.70 and 91.20 mg·kg-1) could significantly increase the +dp/dtmax, MSP, MDP, HR, and decrease-dp/dtmax, and the effect of these doses of liguzinediol (2.85 and 5.70 mg·kg-1) were weak. Through the calculation, the ED50of liguzinediol was about 12.93 mg /kg-1and its therapeutic index (LD50/ED50) was 131. The 45.60 mg·kg-1dose of liguzinediol was its maximum efficiency, and its effect could not improve even the dose was increased to 91.20 mg·kg-1. Conclusion Liguzinediol can significantly improve the hemodynamic parameters in AHF guinea pigs, and it is of more safety than other similar drugs.
liguzinediol; AHF guinea pig model; hemodynamics; efficacy; potency; therapeutic index
时间:2015-3-3 11:08 网络出版地址:http://www.cnki.net/kcms/detail/34.1086.R.20150303.1108.015.html
2014-11-05,
2014-12-27
国家自然科学基金资助项目(No 81072542);教育部博士点基金资助项目(No 20123237110010);江苏省自然科学基金资助项目(No BK2011077);江苏省高校优势学科建设工程资助项目
徐 斌(1989-),男,硕士生,研究方向:心血管药理学,E-mail:xubin89111@sina.com; 卞慧敏(1958-),女,研究员,博士生导师,研究方向:心血管药理学,通讯作者,E-mail:hmbian@sina.com
10.3969/j.issn.1001-1978.2015.03.015
A
1001-1978(2015)03-0367-08
R-332;R322.11;R331.31;R541.61;R972.1