ERK激活对SDF-1引起的大鼠海马神经元 GABA分泌抑制的影响*
2015-06-09张紫娟郭美霞
张紫娟, 郭美霞, 邢 莹
(1. 河南中医学院基础医学院, 郑州450046; 2. 新乡医学院三全学院, 河南 新乡453003;3. 郑州大学医学院生理学教研室, 郑州450003)
ERK激活对SDF-1引起的大鼠海马神经元 GABA分泌抑制的影响*
张紫娟1, 郭美霞2, 邢 莹3△
(1. 河南中医学院基础医学院, 郑州450046; 2. 新乡医学院三全学院, 河南 新乡453003;3. 郑州大学医学院生理学教研室, 郑州450003)
目的:观察细胞外调节激酶(ERK)信号通路激活对基质细胞衍生因子(SDF-1)引起离体培养的大鼠海马神经元γ-氨基丁酸(GABA)分泌的影响。方法:新生SD大鼠海马神经元离体培养, Western blot法观察ERK1/2信号通路的磷酸化水平;ELISA法和RT-PCR技术检测ERK1/2特异性阻断剂PD98059作用于离体培养的海马神经元后GABA分泌的改变;谷氨酸脱羧酶(GAD65/67)和γ-氨基丁酸转运体(GAT)的蛋白表达量及GAD65和GAT-1 mRNA表达水平。结果:SDF-1作用于海马神经元可引起ERK1/2磷酸化水平明显升高,同时加用CXCR4受体阻断剂AMD3100,可阻断SDF1引起的ERK1/2激活;SDF-1可明显抑制离体培养的海马神经元GABA的分泌,同时加用ERK1/2特异性抑制剂PD98059,可部分逆转SDF-1对GABA分泌的抑制作用;SDF-1作用于离体培养的海马神经元,可抑制谷氨酸脱羧酶GAD65和GABA转运体GAT-1 mRNA的生成;ERK抑制剂PD98059可有效翻转SDF-1的作用。Western blot结果发现SDF-1可抑制海马神经元GAT-1和GAD65/67蛋白的表达,加用ERK1/2抑制剂可部分恢复GAT-1和GAD65/67蛋白合成。结论:SDF1作用于离体培养的海马神经元CXCR4,通过激活ERK1/2信号通路进而抑制GAD蛋白表达,可能是其介导GABA分泌抑制的通路之一。
海马神经元;γ-氨基丁酸;细胞外调节激酶;基质细胞衍生因子-1;大鼠
基质细胞衍生因子(stromal cell derived factor,
SDF-1)是骨髓基质细胞产生的CXC类趋化蛋白。已有研究证实,SDF-1及其受体CXR4在海马组织中广泛表达,可以促进海马神经元的迁移和突起延伸。本室最近的实验发现SDF-1可通过作用于CXCR4抑制离体培养的大鼠海马神经元γ-氨基丁酸(γ-aminobutyric acid, GABA)的分泌。有报道在大鼠体内SDF-1作用于CXCR4可引起细胞外调节激酶(extracellular regulating kinase1/2, ERK1/2)信号通路激活,进而调节骨髓间充质干细胞的迁移。但是SDF-1作用于海马神经元CXCR4是否也通过激活ERK而引起GABA分泌的改变,目前尚未报道。为阐述上述问题进行本实验,旨在进一步揭示帕金森病和阿尔茨海默病的发病机理,为其防治提供依据。
1 材料与方法
1.1 试剂
大鼠γ-氨基丁酸ELISA检测试剂盒(上海郎顿生物有限公司),兔抗γ-actin多克隆抗体(Sigma-Aldrich),兔抗ERK1/2抗体和兔抗phospho-ERK1/2 (碧云天),兔抗GAD65/67和GAT抗体(Abbiotec),辣根过氧化物酶标记的山羊抗兔IgG抗体(北京中杉金桥), AMD3100(Sigma),PD980599(Sigma),RevertAid cDNA Kit试剂盒(Fermentas),Taq DNA Polymerase (上海申能博彩公司),GAD65、GAT-1和GAPDH引物由博尚生物公司合成。
1.2 方法
1.2.1 海马神经元的培养及鉴定 新生24 h内的SD大鼠 (河南省实验动物中心提供许可证号SCXK(豫)2010-0002),无菌条件下断头、取脑、分离两侧海马组织,将海马组织置0.25%胰蛋白酶37℃消化5~10 min,过滤单个细胞后置于离心管中1 000 r/min 离心10 min,弃上清,加入DMEM/F12完全培养基(含有15%胎牛血清,2%B27,20 ng/ml EGF和20 ng/ml bFGF)制备成细胞悬液。取少量细胞悬液用台盼兰染色,检查细胞成活率在95%以上,调整细胞密度为1×106cells/ml, 将细胞接种于预先涂有多聚赖氨酸的12孔培养板中,每孔接种细胞悬液1 ml 后,置入37℃含5% CO2的培养箱中培养。3 d后,用含阿糖胞苷培养液替换原种植培养液,抑制神经胶质细胞生长。培养5 d的新生大鼠海马神经元,经神经元特异性烯醇化酶(NSE)免疫组织化学方法进行神经元鉴定以及测定神经细胞数量。
1.2.2 实验分组 离体培养的SD大鼠海马神经元随机分为六组(n=4):对照组( control)、SDF-1组(细胞培养至第5天培养液中加入100 mg/L SDF-1,终浓度为 50 μg/L作用6 h)、AMD3100组(细胞培养至第5天培养液中加入100 mmol/L AMD3100,终浓度为 50 μmol/L作用30 min)、PD98059组(细胞培养至第2天培养液中加入200 mmol/L PD98059,终浓度为 100 μmol/L作用3 d)、SDF-1+AMD3100组和SDF-1+PD98059组也做相应的处理,采用六孔培养板在同样实验条件下进行培养。
1.2.3 Western blot 检测SDF-1对细胞外调节激酶(ERK1/2)信号通路的磷酸化水平的影响以及PD98059阻断ERK1/2信号通路后GAD和GAT蛋白的表达变化 清除各组细胞培养液,PBS冲洗三遍,每孔加入50 μl细胞裂解液提取各组细胞蛋白,浓度一致后以50 μg蛋白上样,用10%的SDS、PAGE胶垂直电泳分离电泳1 h后转至PVDF膜,用含5%脱脂奶室温封闭1 h,加1∶1 000稀释的一抗过夜,TBS清洗3次,每次5 min,加入1∶2 000辣根过氧化物酶标记的抗体室温孵育2 h,再用TBS清洗3次,ECL发光剂于暗室中曝光和显影。所用内参为β-actin,条带灰度分析使用Quantity One软件系统。
1.2.4 ELISA方法检测ERK1/2特异性阻断剂PD98059分别作用于离体培养的海马神经元后观察GABA分泌的改变 收集对照组、SDF-1组、PD98059组和SDF-1+PD98059组海马神经元培养上清液,分别于包被了GABA抗体的酶标板中加入10 μl培养上清液,常规ELISA方法检测GABA的浓度。450 nm波长检测吸光度,并根据标准曲线计算出相应的GABA含量。
1.2.5 RT-PCR检测PD98059阻断ERK1/2信号通路后GAD65和GAT-1mRNA表达水平 参照Trizol法提取对照组、SDF-1组、PD98059组和SDF-1+PD98059组的总RNA,以用紫外分光光度计测定RNA的浓度和纯度并调成等浓度后,取500 ng总RNA,经逆转录酶转录成cDNA,以cDNA为模板进行PCR扩增。引物序列如下:GAD65PCR反应条件为94℃预变性1 min后, 94℃ 30 s、58℃ 30 s、72℃ 1 min,共31个循环, 72℃延伸4 min。GAT-1 PCR反应条件为: 94℃预变性2 min后, 94℃ 30 s、61℃ 30 s、72℃ 1 min,共35个循环, 72℃延伸10 min。反应产物经 1.5 %琼脂糖凝胶电泳后经电泳凝胶成像分析系统采集图像, 测定灰度值。以GAD65、GAT-1与参照基因GAPDH灰度值之比作为GAD65、GAT-1 mRNA的相对表达量。
Tab. 1 Primer sequences used for GAD and GAT-1 detection by RT-PCR
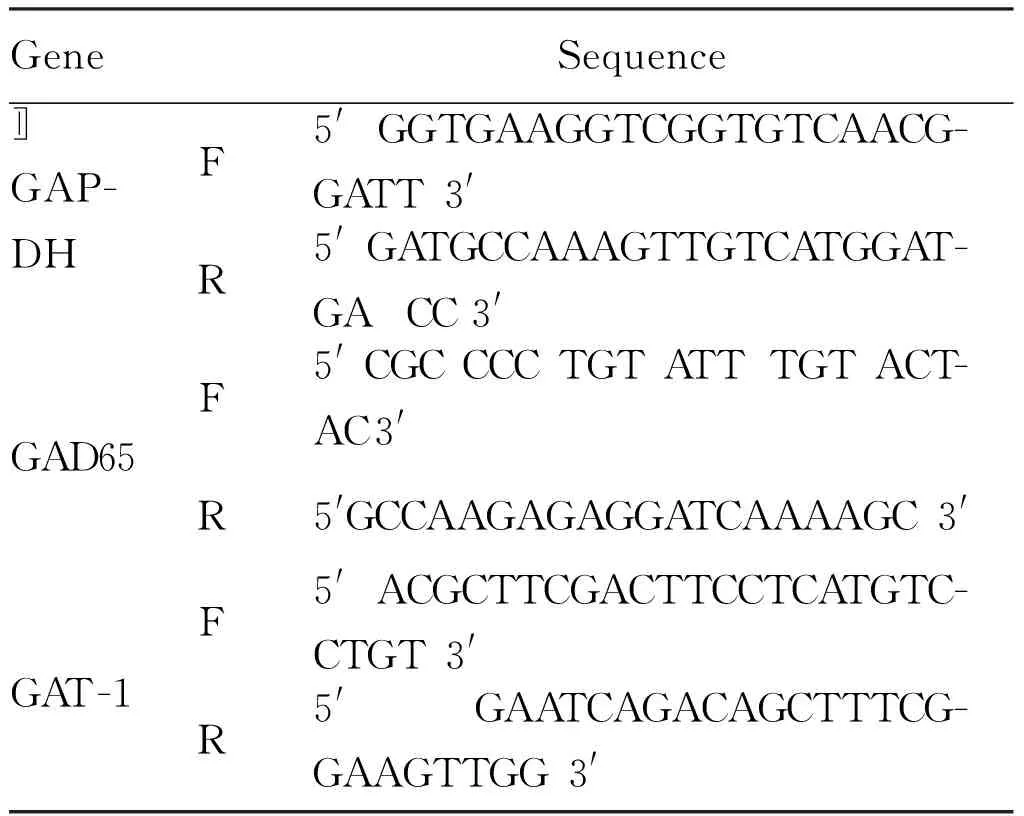
GeneSequenceGAP-DHF5'GGTGAAGGTCGGTGTCAACG-GATT3'R5'GATGCCAAAGTTGTCATGGAT-GACC3'〛GAD65F5'CGCCCCTGTATTTGTACT-AC3'R5'GCCAAGAGAGGATCAAAAGC3'GAT-1F5'ACGCTTCGACTTCCTCATGTC-CTGT3'R5'GAATCAGACAGCTTTCG-GAAGTTGG3'
1.3 统计学处理

2 结果
2.1 离体培养大鼠海马神经元形态学观察
体外接种的海马神经元最初呈圆形或锥形,均匀分散生长。24 h后基本可贴壁,开始出现小的突起,部分细胞呈梭形。3 d后细胞生长加快,细胞明显变大,细胞膜完整清晰,胞体发亮,周边有光晕,神经元突起增多。细胞培养5 d后胞体、树突及轴突生长迅速,交织成网,细胞呈现融合性生长(图1A)。神经元特异性烯醇化酶NSE鉴定,体外培养的海马神经元70%以上表达阳性(图1B)。

Fig. 1 Morphological characteristics of hippocampus neurons A: Hippocampus neurons (×100);B: NSE expression in hippocampus neurons (×40)
2.2 SDF-1对海马神经元中ERK信号通路的影响
Total-ERK无明显变化的情况下,对照组灰度比值为(0.80±0.03)而SDF-1组灰度比值为(0.94±0.05),两者相比有显著差异性(P<0.05,图2)。说明在离体培养的海马神经元中SDF-1激活了ERK信号通路。SDF-1+AMD3100组灰度比值为(0.68±0.27),与SDF-1组相比有显著差异(P<0.05)。SDF-1与受体CXCR4结合后,激活了下游信号ERK信号通路,但是并未出现ERK磷酸化过程完全阻断,提示SDF-1可能与CXCR4之外的其他受体结合,改变ERK的磷酸化过程。
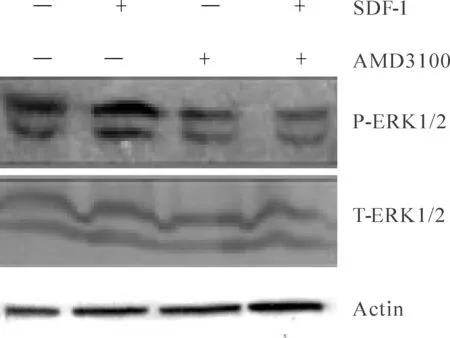
Fig. 2 Phosphorylation of ERK1/2 signaling pathway induced by SDF-1
2.3 ERK1/2信号转导通路对SDF-1介导的分泌GABA的影响
SDF-1组的GABA含量与对照组GABA含量明显下降(P<0.05),这和研究已经证实了的在离体培养的海马神经元中SDF-1通过其受体CXCR4抑制了神经递质GABA的分泌结论相一致。SDF-1+PD98059组的GABA含量相对于只加入SDF-1的实验组GABA含量有所上升,可以部分逆转SDF-1对GABA分泌的抑制作用,结果表明ERK1/2信号转导通路直接参与了SDF-1介导的海马神经元神经递质GABA的分泌。


GroupGABAControl722.39±37.46SDF-1566.62±69.15*PD98059740.32±43.15*SDF-1+PD98059613.94±96.66#
SDF-1: Stromal cell derived factor
*P<0.05vscontrol group;#P<0.05vsSDF-1 group
2.4 ERK信号通路对SDF-1介导的对 GAD和GAT的mRNA和蛋白的表达的影响。
RT-PCR检测PD98059阻断ERK1/2信号通路后GAD65和GAT-1 mRNA的表达。GAT-1/GAPDH灰度比值表示GAT-1 mRNA相对表达程度;GAD65/GAPDH比值表示GAD-65 mRNA相对表达程度。结果显示:SDF-1通过ERK信号通路抑制GAD65和GAT-1 mRNA的表达。GAT-1和GAD65 mRNA灰度比值SDF-1组与SDF-1+PD98059组有显著差异性(图3)。
Western blot检测GAD和GAT蛋白在PD98059阻断ERK1/2信号通路后的表达,GAT/Actin灰度比值表示GAT蛋白相对表达程度;GAD/Actin比值表示GAD蛋白相对表达程度。结果显示与对照组相比,SDF-1组GAD和GAT蛋白降低(P<0.05);与SDF-1组相比,SDF-1+PD98059组GAD蛋白表达升高和(P<0.05),而GAT蛋白表达量升高,不具有统计学意义(图4)。
3 讨论
帕金森病和阿尔茨海默病等是常见的老年性疾病,但其发病机制尚不明确。存在遗传因素、兴奋性毒性、氧化应激、环境毒素等假说[1],基质细胞衍生因子SDF-1由Shirozu等[2,3]首先克隆发现。研究表明SDF-1和其受体CXCR4在海马组织中广泛表达,并且参与小脑、海马和大脑新皮质的发育[4],提示其对神经系统有调控作用。ERK1/2信号通路主要通过影响细胞周期机制来调节细胞增殖[5]。ERK1/2最先由Ray和Sturgill在1988年从3T3-L1脂肪母细胞中纯化出来的,是细胞外信号与核反应间信息传递的共同通路[6]。ERK1/2信号转导通路的激活与海马的长时程增强(LTP)和学习记忆功能密切相关[7]。有研究证明大鼠学习记忆能力和癫痫发作程度与海马内P-ERK1/2表达量呈同向性。许多研究已经证实在离体培养的人脐带血干细胞中SDF-1/CXCR4可以活化ERK信号转导通路[8]。但是在离体培养的大鼠海马神经元中SDF/CXCR4如何激活ERK信号通路的机制还不清楚。为了进一步研究在离体培养的海马神经元中SDF-1对ERK磷酸化的影响,以及ERK信号转导通路与神经递质GABA分泌的关系。
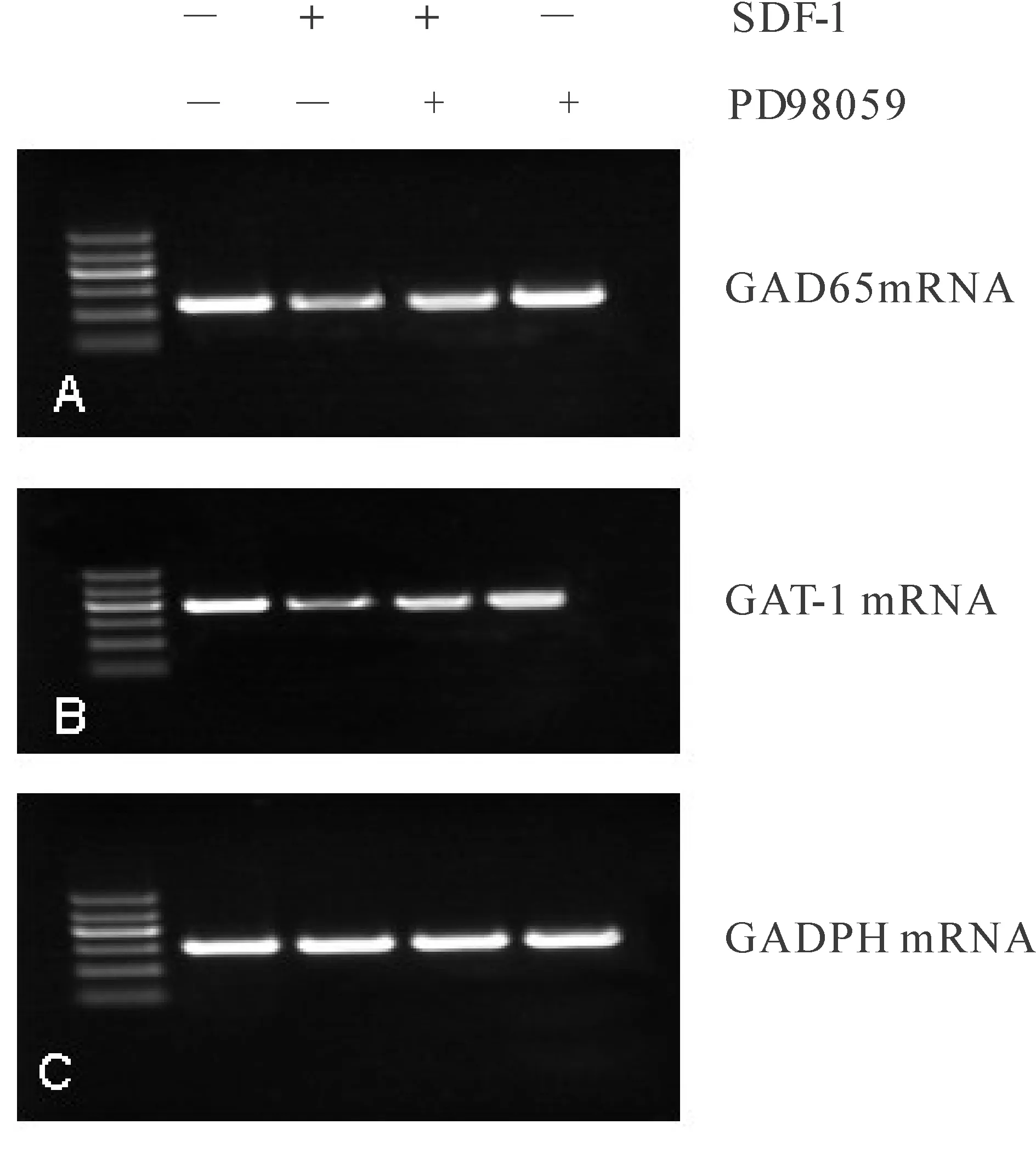
Fig. 3 Effect of SDF-1 on GADPHmRNA and GAT-1mRNA after blocked ERK signaling pathway
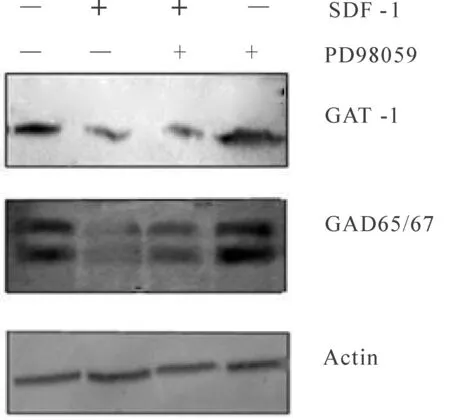
Fig. 4 Effect of ERK signaling pathway on the protein expression of GAT-1 and GAD65/67 induced by SDF-1
GABA是一种重要的抑制性神经递质,参与调节突触可塑性,对学习记忆起负调节作用。本实验室的研究证实在离体培养的大鼠海马神经元中SDF-1通过CXCR4受体活化细胞内通路可以引起乙酰胆碱(Ach)分泌的增加和GABA分泌的减少。但是期间的信号通路是否与ERK有关,尚未见报道。本实验中选用离体培养的大鼠海马神经元作为实验材料,将其分泌的GABA作为观察指标,以观察ERK信号转导通路的激活对SDF-1引起的神经元GABA分泌的影响及机制。结果证明了ERK1/2信号转导通路可能参与了SDF-1/CXCR4对神经元GABA分泌的影响。
SDF-1通过与其相应受体CXCR4结合使细胞内Ca2+大量释放降低细胞内的腺苷酸环化酶cAMP,来活化多种信号通路,包括PI3K 、核转录调控因子NFKB和MAPK/ERK1/2等信号通路[10]。这暗示SDF-1/CXCR4除了通过ERK1/2信号转导通路影响离体培养的GABA的分泌还有其他信号通路的参与。
为进一步研究离体培养的海马神经元中SDF-1/CXCR4通过ERK信号通路直接介导神经递质GABA的分泌。PD98059可以通透细胞,选择性抑制MEK1/2,从而抑制ERK1/2的磷酸化和激活,用PD98059可以确定在生物反应中是否有ERK1/2信号通路的参与。
GABA是中枢神经系统内最重要的抑制性氨基酸类神经递质,GABA在神经末梢中由谷氨酸经谷氨酸脱羧酶(GAD)脱羧后生成。神经系统中谷氨酸的含量丰富,大约是GABA含量的四倍,GABA的合成主要受GAD含量的影响,所以GAD在脑内的分布与GABA的浓度呈正相关。SDF-1/CXCR4通过ERK1/2信号通路对GABA分泌的影响,采用选择研究GAD和GAT-1在转录水平和翻译水平的表达。结果SDF-1抑制GAD65/67的mRNA蛋白表达水平,PD98059引起GAD65/67的mRNA表达水平升高及蛋白表达量升高,说明ERK信号通路通过影响GABA的合成而影响了GABA的分泌。而在同时加入SDF-1和PD98059后GAT-1在mRNA和蛋白表达存在变化,但这种变化可能是由于阻断ERK信号通路引起的也可能是由于GABA分泌的变化,为保持神经元兴奋性的正常,GAT-1表达量随之降低。具体机制还有待进一步的探讨。
本实验观察到SDF-1使ERK1/2磷酸化水平升高即活化ERK1/2信号通路。SDF-1通过细胞膜表面相应受体CXCR4引起胞内GABA分泌的减少,而同时加入ERK1/2阻断剂PD98059,可使GABA分泌出现部分逆转性升高,这提示GABA的分泌可能与ERK1/2信号转导通路有关。进一步的实验证明SDF-1抑制GAD65/67和GAT-1 mRNA和蛋白表达水平,同时加入PD98059引起GAD65/67和GAT-1 mRNA表达水平升高及蛋白表达量升高,这说明ERK1/2 参与了SDF-1介导的GABA的合成和转运。这提示GABA的分泌与ERK1/2信号通路有关,但是该阻断剂并不能完全阻断SDF-1刺激GABA的分泌,说明SDF-1下游可能有其他通路参与。
有关帕金森病和阿尔茨海默病的神经保护作用仍旧是难点,虽然干细胞的干预带来了一线曙光[12],但是由于干细胞分化的可控性极其复杂,其在临床应用尚存在许多困难[13]。因此,直接观察大鼠海马神经元信号转导通路的作用仍是研究的热点。并且经研究证实,在离体培养的大鼠海马神经元中ERK1/2信号转导通路参与了SDF-1对GBAB分泌的影响。为帕金森和阿尔茨海默病等疾病的防治提供新的途径。
[1] 刘重斌, 王 瑞, 潘慧斌, 等. 番茄红素对帕金森模型小鼠氧化应激损伤及神经行为的影响[J]. 中国应用生理学杂志, 2013, 29(4): 380-383.
[2] Shirozu M, Nakano T, Inazawa J,etal. Structure and chromosomal localization of the human stromal cell-derived factor 1 ( SDF1) gene[J].Genomics, 1995, 28(3): 495-500.
[3] Ichii M, Oritani K, Yokota T,etal. Stromal cell-free conditions favorable for human b lymphopoiesis in culture[J].JImmunolMethods, 2010, 359(1-2): 47-55.
[4] Luo YG, Cai JL, Xue HP,etal. Functional SDF 1 a/ CXCR4 signaling in the developing s pinal c ord[J].JNeurochem, 2005, 93(2): 452~462.
[5] Lavoie JN, Allemain GL, Brunet A,etal. Cyclin D1 expression is regulated positively by the p42/p44 MAPK and negatively by the p38/HOGMAPK pathway [J].JBiolChem, 1996, 271(34): 20608-20616.
[6] Creamer D, Allen MH, Sousa A,etal. Localization of endothelial proliferation and microvascular expansian in active plaque psoriasis[J].BrJDermatol, 1997, 136(6): 859-865.
[7] Maroun M, Richter-Levin G. Local circuit plasticity in the rat dentate gyrus: characterization and aging-related impairment [J].Neurosci, 2002, 112(4): 1001-1007.
[8] Ryu CH, Park SA, Kim SM,etal. Migration of human umbilical cord blood mesenchymal stem cells mediated by stromal cell-derived factor-1/CXCR4 axis via Akt, ERK, and p38 signal transduction pathways[J].BiochemBiophuysResCommun, 2010, 398(1): 105-110.
[9] 刘素芳, 李长生, 王丽君, 等. GXCL12对大鼠海马培养细胞GABA和乙酰量碱分泌的影响及其机制[J]. 神经解剖学杂志, 2011, 27(3): 258-262.
[10]Kucia M, Jankowski K, Reca R.etal. CXCR4-SDF-1 signalling, locomotion, chemotaxis and adhesion[J].JMolHistol, 2004, 35(3): 233245.
[11]邢 莹, 张紫娟, 景 莹, 等. 大鼠海马神经干细胞体外培养分化过程中钾电流的变化[J]. 中国应用生理学杂志, 2008, 24(4): 306-309
[12]赵钢勇, 崔 蕾, 高 娟, 等. BDNF 基因工程细胞对 帕金森大鼠纹状体多巴胺及其代谢物影响的研究[J]. 中国应用生理学杂志, 2013, 29(1): 82-85.
[13]王冬梅, 赵 丹, 殷盛明, 等. 蝎源活性肽对早期帕金森病大鼠强啡肽改变的保护作用[J]. 中国应用生理学杂志, 2015, 31(2): 120-122.
ERK activation effects on GABA secretion inhibition induced by SDF-1 in hippocampal neurons of rats*
ZHANG Zi-juan1, GUO Mei-xia2, XING Ying3△
(1. Basic Medical College of Henan University of Traditional Chinese Medicine, Zhengzhou 450046; 2. Three Full College Xinxiang Medical University, Xinxiang 453003; 3. Department of Physiology, Medical School of Zhengzhou University, Zhengzhou 450003, China)
Objective: To investigate the effect of extracellular regulating kinase (ERK) signaling pathway on the secretion of γ-aminobutyric acid(GABA) in cultured rat hippocampal neurons induced by stromal cell derived factor-1(SDF-1). Methods: The hippocampal neurons of newborn SD rats were cultured and identified in vitro; the phosphorylation level of ERK1/2 was examined by Western blot; ELISA was used to detect the effect of PD98059, a ERK1/2 specific blocker on GABA secretion of cultured hippocampal neurons and Western blot were adopted to measure the protein expression levels of glutamate decarboxylase (GAD65/67) and gamma aminobutyric acid transporter (GAT) ; after blocking ERK1/2 signaling pathway with PD98059; RT-PCR was used to detect the mRNA expression levels of GAT-1 and GAD65 after treated with PD98059. Results: The levels of ERK1/2 phosphorylation were increased significantly by SDF1 acting on hippocampal neurons, and CXCR4 receptor blocker AMD3100,could inhibit SDF-1 induced ERK1/2 activation; SDF-1 could inhibit the secretion of GABA in cultured hippocampal neurons, and ERK1/2 specific inhibitor PD98059, could partly reverse the inhibition of GABA secretion by SDF-1. The effects of SDF-1 on cultured hippocampal neurons was to decrease the mRNA genesis of glutamic acid decarboxylase GAD65 and GABA transporter GAT-1, besides, ERK inhibitor PD98059 could effectively flip the effect of SDF-1. The results of Western blot showed that SDF-1 could inhibit the protein expression of GAT-1 and GAD65/67 in hippocampal neurons and the inhibition of GAT-1 and GAD65/67 protein expression could be partially restored by ERK1/2 blocker. Conclusion: SDF-1 acts on the CXCR4 of hippocampal neurons in vitro, and inhibits the expression of GAD by activating the ERK1/2 signaling pathway, and this may represent one possible pathway of GABA secretion inhibition.
hippocampal neuron; GABA; ERK; SDF-1
国家自然科学基金资助项目(31000514)
2015-01-19 【修回日期】2015-06-10
R338.2
A
1000-6834(2015)05-443-05
10.13459/j.cnki.cjap.2015.05.015
△【通讯作者】Tel: 13525549156; E-mail: xingyingprofessor@126.com
