妊娠甲状腺功能减退症孕妇基于促甲状腺素水平调整左甲状腺素剂量变化规律观察
2015-06-09张智慧闫朝丽侯俊秀刘敏
张智慧,闫朝丽,侯俊秀,刘敏
论著·临床
妊娠甲状腺功能减退症孕妇基于促甲状腺素水平调整左甲状腺素剂量变化规律观察
张智慧,闫朝丽,侯俊秀,刘敏
目的 探讨妊娠甲状腺功能减退症(HT)孕妇各期左甲状腺素(L-T4)治疗达标剂量的变化规律。方法 妊娠甲状腺功能减退孕妇38例,按妊娠前是否合并甲状腺功能减退症病史分组,妊娠前合并甲状腺功能减退者为A组(n=16);既往无甲状腺功能减退病史,妊娠早期初次筛检发现甲状腺功能减退者为B组(n=22)。分别观察2组孕妇治疗期间药物剂量的调整及开始药物替代治疗前后甲状腺功能相关指标的变化。结果 (1)与入组时比较,A组于妊娠2个月、3个月、6个月及9个月L-T4剂量增加(t值分别为-3.929、-5.692、-2.935、-4.496,P均<0.05),则 B组无明显变化(P>0.05);在妊娠月份相同(2个月~9个月)的条件下,A 组所需的L-T4剂量明显高于B组(t值分别为2.300、4.565、2.962、6.041、4.627、2.271、4.965、6.039、2.936,P均<0.05)。(2)妊娠早期即需要增加L-T4剂量,妊娠各期L-T4剂量与入组时增加的百分比与甲减发生原因有关:桥本甲状腺炎后甲减中L-T4剂量于妊娠1个月、2个月时增加(t值分别为-2.809及-3.261,P均<0.05);特发性甲减中L-T4剂量于妊娠1个月及2个月时明显增加(t值分别为-3.320及-4.459,P均<0.05)。(3)妊娠期甲减L-T4替代治疗的达标剂量受基线时TSH水平的影响,根据TSH的水平调整L-T4的剂量,甲状腺激素的需要量于中晚期调整剂量逐渐趋于稳定。结论 妊娠前期或妊娠早期应尽快明确甲状腺功能,对合并甲状腺功能减退孕妇应尽快按照指南的要求调整L-T4的剂量于妊娠早期达标。
妊娠;甲状腺功能减退;左甲状腺素剂量
妊娠相关的甲状腺疾病是常见病,妊娠合并临床甲状腺功能减退症(clinical hypothyroidism,CH)临床甲减的发病率为0.3%~0.5%,合并亚临床甲状腺功能减退症(subclinical hypothyroidism,SCH)亚临床甲减的发病率为2%~3%[1]。在妊娠过程中,母体甲状腺可出现一系列适应性生理变化,包括甲状腺组织增大、甲状腺血流量增多、甲状腺激素水平和甲状腺免疫微环境的特异性改变等,上述伴随妊娠的生理变化对母婴健康至关重要。据报道,尚未确诊的妊娠期SCH的发病率约3%~15%[2,3]。妊娠期甲状腺功能减退(hypothyroidism,HT)可引起母体及胎儿的不良结果。对于母体而言,贫血、先兆子痫、胎盘早剥、产后大出血等并发症增多,手术产率增高;对胎儿及新生儿而言,可发生早产、低体质量儿、新生儿呼吸窘迫综合征、死胎及后代神经智力发育损伤等[4,5]。左旋甲状腺素(levothyroxine,L-T4)半衰期长,是目前治疗妊娠甲减的首选药。现观察妊娠期甲减及甲减合并妊娠的孕妇于妊娠早期、妊娠中期、妊娠晚期及分娩后服用L-T4达标剂量的变化,旨在指导临床用药提高疗效。
1 资料与方法
1.1 临床资料 2013年12月—2014年11月在我院门诊应用L-T4治疗的甲减孕妇38例,妊娠7周以内,既往均无甲状腺疾病史及其他自身免疫性疾病史,无恶性肿瘤史,无服用影响甲状腺功能的药物史,无其他临床严重疾病的现患史,均为单胎妊娠。筛查指标:血清促甲状腺素(thyroid stimulating hormone,TSH) >妊娠特异参考值的上限(97.5%),甲状腺过氧化物酶抗体(thyroid peroxidase antibody,TPOAb) >正常值参考范围,游离甲状腺素(free thyroxine,FT4)﹤妊娠期特异参考值下限(2.5%)或正常[6]。临床或亚临床甲减诊断标准:(1)有甲减的症状和体征;(2)甲状腺功能检查TSH增高, 伴有FT4下降或正常[7]。妊娠期甲减的病因:(1)桥本甲状腺炎24例;(2)甲状腺癌术后2例;(3)特发性甲减12例。年龄22~38(29.1±4.1), 体质量指数16~27(23.4±6.8)kg/m2;按妊娠前是否合并甲状腺功能减退症病史分组,妊娠前已知甲状腺功能减退为甲减合并妊娠组即A组16例,年龄22~34 (28.9±3.6)岁,桥本甲状腺炎8例,甲状腺癌术后2例,特发性甲减6例;孕检时初发甲减为妊娠合并甲减组即B组22例,年龄22~38 (28.6±4.4) 岁。孕前甲状腺激素水平正常,早孕检查时初发甲状腺功能减退,桥本甲状腺炎16例,特发性甲减6例。
1.2 选择标准 入组条件:(1)妊娠前已知患有甲状腺功能减退,现补充L-T4治疗;(2)孕检初发的甲状腺功能减退;(3)按照中国甲状腺疾病指南推荐的标准均采用电化学发光免疫测定法(electrochemiluminescence immunoassay,ECL)(罗氏)评估甲状腺功能减退孕妇。TSH参考范围妊娠早期为 0.05~5.17 mU /L、妊娠中期为0.39~5.22 mU /L、妊娠晚期为0.60~6.84 mU /L[6]。排除标准:(1)促甲状腺素瘤,甲状腺激素抵抗综合征,席汉综合征,肾上腺功能减退和胃复安等药物影响;(2)除甲状腺疾病外合并其他免疫性疾病史,合并垂体及其他内分泌疾病史。
1.3 用药方法 按照“妊娠和产后甲状腺疾病诊治指南”[6]于妊娠早期调药。L-T4治疗剂量设计的基本依据是血清TSH升高的程度,TSH>2.5 mU/L时,L-T4的初始剂量为50 μg/d;TSH>8 mU/L时,L-T4的初始剂量为75 μg/d;TSH>10 mU/L时,L-T4的初始剂量为100 μg/d。甲减合并妊娠后应立即增加L-T4剂量,具体方法:每周立即额外增加2 d的剂量(即较妊娠前增加25%~30%);临床甲减孕妇产后治疗目标血清TSH为妊娠早期(T1期)0.1~2.5 mU/L、妊娠中期(T2期)0.2~3.0 mU /L和妊娠晚期(T3期) 0.3~3.0 mU /L,L-T4剂量应降至孕前水平,每隔2~4周复查甲状腺功能指标,根据TSH及FT4水平调整L-T4剂量。
1.4 观测内容 于孕妇入组时、妊娠早期(选取孕1个月、2个月、3个月)、妊娠中期(选取孕6个月)、妊娠晚期(选取孕9个月)、分娩后1个月检测甲状腺功能相关指标(TSH、FT4)以及L-T4剂量。
2 结 果
2.1 不同妊娠期L-T4剂量的变化 与入组时相比,妊娠2个月、3个月、6个月及9个月 A组孕妇L-T4剂量增加(P<0.05);分娩后1个月变化不明显(P>0.05);而B组妊娠各月及分娩后1个月L-T4剂量变化不明显(P>0.05);A组与B组妊娠各月L-T4剂量增加相比差异有显著意义(P<0.05)。见表1。
2.2 不同妊娠期TSH的变化 与入组时相比,A组孕妇于妊娠2个月、3个月、6个月、9个月及分娩后1个月应用TSH剂量差异无统计学意义(P>0.05)。而B组孕妇,于妊娠2个月及3个月差异无明显意义(P>0.05);妊娠6个月、9个月及分娩后1个月TSH与入组时相比差异有统计学意义(P<0.05);A组与B组相比入组时差异有显著意义(P<0.05),其余月份差异无显著意义(P>0.05)。见表2。
TSH在妊娠3个月时已降至目标值,之后整个妊娠期,TSH的水平也基本平稳,达标后各个妊娠月份之间比较差异无统计学意义(P>0.05)。其中2例患者分别于妊娠2个月TSH值低于0.06 mU/L,均为外院就诊的甲减合并妊娠患者,但未减少L-T4的剂量。A组孕妇TSH与入组时相比在整个孕期变化不明显,这可能与孕前即予以足够剂量L-T4有关,B组中,与入组时相比,妊娠早期变化不显著,妊娠中期、晚期及分娩后1个月变化较为显著。
2.3 不同原因妊娠期甲状腺功能减退症各月份L-T4剂量比较 与入组时比较,妊娠过程中桥本甲状腺炎甲减L-T4剂量在妊娠早、中、晚期增加的百分比分别为61.46%、53.88%、6.03%、4.04%,产后L-T4减少至入组时剂量的22.92%;而特发性甲减在妊娠早、中、晚增加的百分比分别为433.32%、375.00%、166.68%、200.00%,产后L-T4减少至入组时剂量的50.00%。在桥本甲状腺炎后甲减组中,与入组时比较,妊娠1个月及2个月L-T4剂量的变化有明显差异(P<0.05),妊娠3个月、6个月、9个月及分娩后1个月差异无统计学意义(P>0.05);在特发性甲减组中,与入组时比较,妊娠1个月及2个月差异有显著意义(P<0.05),妊娠3个月、6个月、9个月及分娩后1个月L-T4剂量的变化无统计学意义 (P>0.05)。见表3。
2.4 在外院未进行系统治疗个别患者的用药调整 本组中有6例孕妇在妊娠前未加量,其中特发性甲减4例,桥本甲状腺炎后甲减2例。均于妊娠4周时 TSH显著升高(>22.0 mU/L),特发性甲减分别予以L-T4剂量平均约150 μg,后期剂量基本维持稳定。桥本甲状腺炎后甲减5例根据TSH水平增加L-T4剂量,但于妊娠中、晚期又减量。
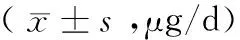
表1 2组孕妇不同妊娠期L-T4使用剂量比较
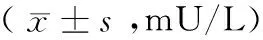
表2 2组孕妇不同妊娠期TSH变化情况比较
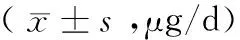
表3 不同原因甲减在妊娠各期L-T4剂量的对比
3 讨 论
“中国妊娠和产后甲状腺疾病诊治指南”已经明确指出:临床甲减及亚临床甲减可增加不良妊娠结局和后代神经智力发育损害的风险,必须接受治疗。且妊娠期临床甲减接受治疗后对儿童智力发育无影响,无需额外监测,同时L-T4达标治疗可显著提高亚临床甲减孕妇后代的智力。L-T4起始剂量50~100 μg/d,根据孕妇的耐受程度增加剂量,尽快达标[7]。对于严重临床甲减的孕妇,在开始治疗的数天内给予2倍替代剂量,使甲状腺功能尽快恢复正常。因此,妊娠期甲减的治疗显得尤为重要,早期达标则更是重中之重。然而不同的病因及发病时间都会对L-T4剂量的调整产生影响。
本结果发现,孕前甲减组中,与入组时比较,L-T4剂量妊娠早期、妊娠中期、妊娠晚期差异均有统计学意义,分娩后L-T4剂量需要量与入组时相比较差异无统计学意义,符合妊娠期甲状腺功能减退症于分娩后L-T4剂量应减量至孕前剂量。同时也提示了孕前甲减组L-T4剂量在整个妊娠期调整剂量变化显著。妊娠期甲减组中,与入组时比较,妊娠早期、妊娠中期、妊娠晚期、分娩后1个月L-T4剂量差异无统计学意义,L-T4剂量调整在整个孕期变化不明显,提示妊娠期甲减于入组时基于TSH水平调整剂量并予以足够剂量后于孕早期达标,之后整个孕期L-T4剂量需要量较平稳。孕前甲减组与妊娠期甲减组相比,2组之间相同妊娠月份L-T4所需的剂量不同,孕前甲减组所需的剂量明显高于妊娠期甲减组,差异有统计学意义(P<0.05)。这可能是由于孕前已诊断甲减的孕妇甲状腺破坏更严重,应激状态下分泌能力有限,代偿能力低,故L-T4的需要量比孕前未发现甲状腺功能异常的孕妇更高[8]。同时孕前甲减组孕妇在妊娠早、中、晚各期服用L-T4的剂量较入组时明显增加,尤其特发性甲减,但桥本甲状腺炎甲减在妊娠早期增加剂量明显,中、晚期在早期TSH达标后增加剂量不明显,基本与入组时一致[9]。之前也有些研究报道与妊娠前比较妊娠早期,L-T4的剂量无明显差异,妊娠中期及妊娠晚期,L-T4剂量增加[10,11],这些报道结果不尽一致的原因可能与其选择甲减病因不同有关。上述结果显示妊娠期甲减L-T4替代治疗的达标剂量受基线时TSH水平的影响,这一点是完全符合指南的[12]。但本组中有8例桥本甲状腺炎L-T4的起始剂量却小于相对应的TSH值,同时另外有3例桥本甲状腺炎孕妇,起始L-T4虽不足指南起始量,但可以稳定维持至分娩后,这或许与桥本甲状腺炎后甲减甲状腺本身残留甲状腺组织较多, 尚有部分代偿能力有关,但考虑本组中样本量较小,还需进一步观察[7]。故证实HT孕妇妊娠期间需调整L-T4用量, 但甲减的病因不同, 所需替代的L-T4量亦不同。
本结果发现,入组时2组L-T4用量差异无统计学意义;开始补充治疗后,随着妊娠周数的增加,L-T4需要量逐渐增加,到妊娠4个月后,L-T4剂量调整的幅度变小,可能与母体的需要量已经不再增加,并且胎儿的甲状腺已经有了一定的分泌功能有关[13]。指南中指明正在治疗的妊娠中甲减妇女,妊娠后L-T4剂量需要增加大约30%~50%,在本组中也是可以得到证实的。2组之间妊娠周数相同,但L-T4所需的剂量不同,甲减合并妊娠组所需的剂量明显高于妊娠合并甲减组,差异有统计学意义,这也是符合指南的。因此,在妊娠期甲减的治疗过程中妊娠期甲减与甲减合并妊娠的L-T4替代治疗是有差异的。
研究表明,在妊娠早期HT的治疗过程中,即使TSH水平稍低于参考值下限,一般也不必担心L-T4过量而减量,可以观察1~2周后再次随诊。一般来说,妊娠早期的FT4高于妊娠晚期,而妊娠晚期TSH高于妊娠早、中期。分析原因:(1)孕妇血清HCG的浓度在10~12周(妊娠早期)达到高峰,HCG与TSH有相同的α亚单位,相似的β亚单位和受体亚单位,高水平HCG可刺激甲状腺分泌甲状腺激素,反馈性抑制垂体TSH分泌,使血清TSH水平降低20%~30%。使TSH水平下限较非妊娠妇女平均降低0.4 mU/L,20%孕妇可以降至0.1 mU/L以下。一般HCG每增高1万U/L,TSH降低0.1 mU/L。 血 清HCG水平增加,TSH水平降低发生在妊娠8~14周,妊娠10~12周是下降的最低点。(2)妊娠中晚期,由于胎儿生长对碘的需求增加,容易导致孕妇甲状腺激素合成减少(尤其是FT4降低),进一步的下丘脑—垂体—甲状腺轴的反馈作用致中晚期孕妇TSH增加[14]。
综上所述,HT孕妇在保证碘摄入充足条件下, 由于胎儿生长、新陈代谢增加, 甲状腺对促甲状腺激素反应性降低等因素, 对TH需要量增加, 必须保证足够的L-T4摄入, HT患者妊娠期间L-T4治疗剂量增加,从而大大减低由于甲状腺激素不足所导致的妊娠并发症及胎儿呆小症的发生[15,16]。同时,在妊娠早期尽早明确甲状腺功能,对HT孕妇尽早予以L-T4支持治疗,确保于妊娠3个月时可达标,从而有效消除HT带来的不良妊娠结局。
1 单忠艳.妊娠合并甲状腺功能减退症的进展和争论[J].内科理论与实践,2010,5(2):125-129.
2 NegroR, Stagnaro-GreenA. Diagnosis and management of subclinical hypothyroidism in pregnancy[J].BMJ,2014,349(10):4929.
3 Blatt AJ, Nakamoto JM, Kaufman HW. National status of testing for hypothyroidism during pregnancy and postpartum[J].Clin Endocrinol Metab, 2012,97(7):77-84.
4 De Vivo A.Mancuso A,Giacobbe A,et a1.Thyroid function in women found to have early pregnancy loss[J].Thyroid,2010,20(6):33-637.
5 刘娜,边旭明,高劲松,等.妊娠合并甲状腺功能减退症或亚临床甲状腺功能减退症77例临床分析[J].中华围产学杂志,2009,12(3):186-188.
6 中华医学会内分泌学分会,中华医学会同产医学分会.妊娠和产后甲状腺疾病诊治指南[J].中华内分泌代谢杂志,2012,28(5):354-371.
7 山秀杰,孙中华. 甲状腺功能减退患者妊娠期间甲状腺激素治疗剂量的变化研究[J].中国妇幼保健,2010,25(27):3884-3886.
8 王与.妊娠期亚临床甲减患者甲状腺激素治疗剂量调整临床观察[J].海南医学院学报,2012,18(12):1755-1757.
9 陈卫平,邓晓峰,徐应波,等.妊娠期甲状腺功能减退的临床研究[J].昆明医科大学学报,2012,33(10):123-125.
10 王允峰,杨慧霞.妊娠合并甲状腺功能减低患者的临床分析[J].中华妇产科杂志,2007,42(3):157.
11 单忠艳,于晓会,滕卫平,等.妊娠期甲状腺功能减退症的研究进展[J].国际内分泌代谢杂志,2008,28(5):289-293.
12 苏恒,任秀莲,马杉,等.亚临床甲状腺功能减退症孕妇左旋甲状腺素治疗剂量及影响因素的探讨[J].中华内分泌代谢杂志,2012,28(10):826-828.
13 Julia Hubaveshka, Luba Freja Michaelsson, Birte Nygaard.The dose of levothyroxine in pregnant women with hypothyroidism should be increased by 20%~30% in the first trimester[J].DAN MED J,2014,61(12):A4959.
14 Moreno-Reyes R, Glinoer D, Van Oyen H, etal. High prevalence of thyroid disorders in pregnant women in a mildly iodine-deficient country: a population-based study[J].Clin Endocrinol Metab,2013,98(3):694-701.
15 Speer G .The impact of thyroid function in women of reproductive age: infertility,pregnancy?and the postpartum period[J].Orv Hetil,2013,154(51):20-23.
16 于晓会,王薇薇,滕卫平,等.左旋甲状腺素治疗妊娠亚临床甲减妇女对后代神经智力发育影响的前瞻性研究[J].中华内分泌代谢杂志,2010,26(11):921-925.
Observation of hypothyroidism during pregnancy in pregnant women with thyroid stimulating hormone level adjustment of levothyroxine dose variation
ZHANGZhihui*,YANZhaoli,HOUJunxiu,LIUMin.*PostgraduateofInternalMedicine,InnerMongoliaMedicalUniversity,Hohhot010059,China
Correspondingauthor:YANZhaoli,E-mail:aliceyzl@126.com
Objective To investigate levothyroxine (L-T4) variation of standard dose treatment for hypothyroidism during each stage of pregnancy (HT) women.Methods Thirty-eight cases of pregnancy and hypothyroidism women, according to before pregnancy whether complicated with hypothyroidism, they were divided into group A with history of early hypothyroidism(n=16);group B with no previous history of early hypothyroidism but primary screening druing pregnancy found hypothyroidism (n=22). The changes of drug dosage adjustment and thyroid function before and after substitution treatment were observed in the 2 groups of pregnant women.Results (1) Compared with before enrollment, group A’s L-T4was increased at 2 months, 3 months, 6 months and 9 months of pregnancy (t=-3.929,t=-5.692,t=-2.935,t=-4.496,P<0.05), the group B had no significant changes (P>0.05);at the same month of pregnancy(2 months to 9 months),group A required higher dose of L-T4than that in group B (t=2.300,t=4.565,t=2.962,t=6.041,t=4.627,t=2.271,t=4.965,t=6.039,t=2.936,P<0.05).(2) In early pregnancy, it is needed to increase the L-T4doses, and hypothyroidism during pregnancy increase the percentage of L-T4dose and related to the etiology: Hashimoto's thyroiditis: after hypothyroidismm L-T4dose of 1 months, 2 months of pregnancy were increased (t=-2.809,t=-3.261, respectively,P<0.05); idiopathic hypothyroidism, L-T4doses at 1 months and 2 months of pregnancy were increased significantly (t=-3.320,t=-4.459, respectively,P<0.05).(3) The effects of standard dose of L-T4alternative treatment were affected by baseline TSH levels, according to TSH level to adjust L-T4dose, requirement of thyroid hormone in the middle and late period were gradually stabilized.Conclusion The first trimester of pregnancy or in early pregnancy, thyroid function should be determined as soon as possible, for pregnant women with hypothyroidism, in accordance with the guidelines, L-T4doses should be reached the standard as soon as possible in early pregnancy.
Pregnancy; Hypothyroidism;Levothyroxin dosages
内蒙古自治区自然科学基金项目(No.2012MS1131)
010059 呼和浩特,内蒙古医科大学内科学研究生(张智慧);内蒙古医科大学附属医院内分泌科 (闫朝丽、侯俊秀、刘敏)
闫朝丽,E-mail:aliceyzl@126.com
10.3969 / j.issn.1671-6450.2015.05.008
2015-01-16)
