用微卫星技术研究珠江流域三个野生大眼鳜群体的遗传多样性*
2015-06-07杨慧荣欧阳徘徊李桂峰孙际佳赵会宏王紫钰
杨慧荣,欧阳徘徊,2,李桂峰,孙际佳,赵会宏,张 勇,夏 雨,王紫钰,刘 丽,2
(1.华南农业大学动物科学学院,广东广州510642;2.华南农业大学动物科学学院//广东省农业动物基因组学与分子育种重点实验室,广东广州510642;3.中山大学生命科学大学院,广东广州510275;4.中山大学水生经济动物研究所//广东省水生经济动物良种繁育重点实验室,广东广州510275)
大眼鳜 (Siniperca kneri)属鲈形目 (Perciformes),鮨科 (Serranidae),鳜属 (Siniperca),俗称桂花鱼、白桂等,是一种具有重要经济价值的凶猛肉食性鱼类,分布于中国长江及其以南水系,为中国特有种[1]。由于经济的快速发展,大眼鳜的野生种质资源受到了很大程度上的压迫,种质资源呈现一定程度的下降趋势。近期研究表明,在广东的东江、西江、北江等水系的干流,大眼鳜已成偶见种,仅在一些大型湖泊和水库中还有一定的种群数量,但大多已不能构成渔业产量[1-2]。为了保护珠江水系中的大眼鳜种质资源和促进淡水渔业的长久发展,需要摸清珠江水系中大眼鳜野生群体的家底,对该物种的保护提供理论依据。
因大眼鳜为我国特有种,国外对其研究并不多见,NCBI(The National Center for Biotechnology Information, 网 址 http://www.ncbi.nlm.nih.gov/)仅11篇文献关于大眼鳜的报道,无一研究涉及其群体遗传。国内学者早期研究主要集中在形态[3]、食性[4]、年龄、生长[5]、养殖[6]、繁殖[7]等基础生物学方面。有关其群体遗传多样性研究,仅见赵金良等[8]、王伟伟等[9]和吴旭等[10-11]分别应用线粒体 DNA(Mitochondrial DNA,Mt DNA)、扩增片段长度多态性 (Amplified Fragment Length Polymorphism,AFLP)和微卫星标记 (simple sequence repeat,SSR)技术进行了遗传结构分析,均集中在长江流域的翘嘴鳜群体,而有关珠江流域的大眼鳜群体,尙未见报道。
微卫星遗传标记已经在渔业群体遗传学方面得到广泛的应用[12-16]。本研究选取珠江水系西江干流广西三江段 (右江、左江及红水河)野生大眼鳜群体,利用微卫星分子标记技术进行遗传多样性研究,比较三个地理群体的遗传多样性状况,旨在查明大眼鳜的遗传多样性状况和群体遗传结构、分析其遗传变异,为该物种多样性保护提供必要的遗传背景资料和数据支持 (图1)。
1 材料与方法
1.1 材料
广西右江大眼鳜35尾采自白色市江段,左江大眼鳜40尾采自左江崇左市江段,红水河大眼鳜野生群体37尾采自合山市江段 (表1),共112尾,均为野生群体。现场取背肌,无水乙醇固定,置换3次,使其完全脱水,剩余组织福尔马林保存备查。

图1 珠江流域大眼鳜采集江段示意图 (3色代表不同江段,星形代表采集地点)Fig.1 The schematic diagram of Pear River for S.kneri sampled.Three colors represented different water areas,and stars represented the places sampled
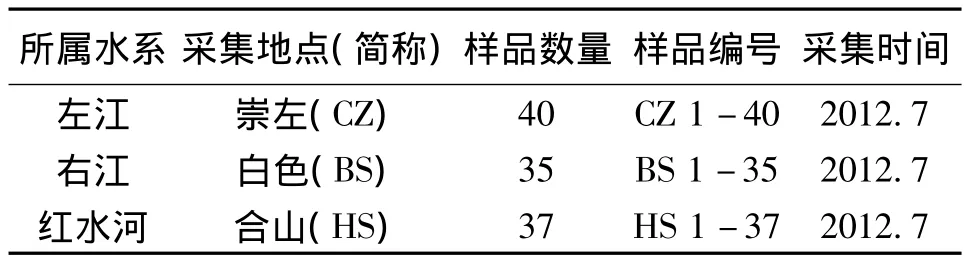
表1 实验样品采集信息Table 1 Experimental materials
1.2 方法
基因组DNA的提取参考文献 [17]的方法。本实验利用传统的酚-氯仿法抽提大眼鳜肌肉组织的基因组DNA,所有抽提所得的基因组DNA都要经过w=1%琼脂糖凝胶电泳检测基因组DNA的完整性,并利用NanoDrop ND2000C分光光度计测定A260/280与 A260/230。
利用现代生物信息技术,通过NCBI网站 (http://www.ncbi.nlm.nih.gov/.)查找大眼鳜的已知相关序列,然后用微卫星序列搜索软件SSR Hunter来搜索具有微卫星位点的序列,最后利用引物设计软件Primer Premier 5.0设计微卫星引物21对,以S命名;依据匡刚桥等[18]报告鳜属鱼类的微卫星引物,选取了其中18对引物来筛选,以P命名;依据吴旭等[10-11]报告的翘嘴鳜微卫星10对,利用10对来筛选,以C命名。所有引物由invitrogen公司合成。最终从49对引物中筛选到19对用于本研究大眼鳜SSR分析。
然后利用PCR技术,按25 μL PCR反应体系,其中:Taq Polymerase(2.5 U/μL)0.25 μL,上游引物和下游引物 (10 μmol/L)各1 μL,2×PCR Reaction Mix 12.5 μL,模板 DNA(25 ng/μL)2 μL,无离子超纯水8.25 μL。扩增条件为:94℃预变性5 min,然后进入40个循环 (94℃ 30 s、退火温度50 s、72℃ 1 min),最后72℃延伸10 min。每次PCR反应均设不含模板DNA的空白对照。PCR结束后,用w=1%的琼脂糖凝胶电泳及w=6%的变性聚丙烯酰胺凝胶电泳 (PAGE),漂洗、银染、显色、终止显色、扫描记录6个步骤得到最终的微卫星DNA电泳图。
1.3 数据分析
根据PAGE电泳图,利用图片分析软件Gelpro 32结合人工判断对19个位点在3个群体103尾大眼鳜的微卫星片段大小进行分析;并利用软件POPGENE 1.32和软件PIC-CALC计算3个群体的遗传多样性数据,从而得到19个位点在总群体及3个群体的遗传结构进行分析并计算得出遗传参数:总群体观测等位基因数 (Na)、多态信息含量(PIC)、观测等位基因数 (Na*)、有效等位基因数 (Ne*)、Shannon's Index(I)、观测纯合子(Obs_Hom)、观测杂合子 (Obs_Het)、期望纯合子 (Exp_Hom*)、期望杂合子 (Exp_Het*)、Nei期望杂合度 (Nei**)、遗传杂合度(Ave_Het)、群体内近交系数 (Fis)、总近交系数(Fit)、群体间分化系数 (Fst)、基因流 (Nm)、遗传距离 (D)。并采用Nei's遗传距离进行UPGMA聚类分析。
2 结果和分析
2.1 基因组DNA
部分大眼鳜样品基因组DNA在w=1%琼脂糖凝胶电泳见图2,可见,各泳道条带均在15000 bp以上,基因组DNA纯度高、完整无剪切,进一步采用了分光光度计测定A260/A280为1.8~2.0,A260/A230为2.3~2.4,确定该基因组DNA可用作后续微卫星DNA分析 (表2)。
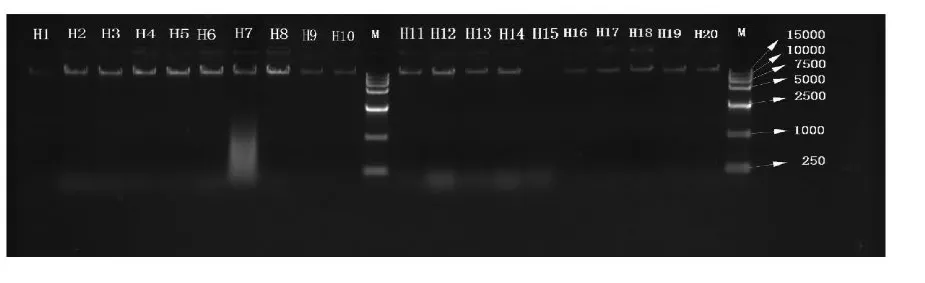
图2 部分大眼鳜基因组DNA琼脂糖电泳图谱Fig.2 A portion of the agarose electrophoresis of genomic DNA of S.kneri Lane M represented DNA marker,and the rest represented genomic DNA of S.kneri(M为DNA相对分子质量标准marker,其余为大眼鳜DNA)

表2 19对可用引物名称、引物序列、微卫星重复序列及PCR反应退火温度Table 2 The primer name,pimer sequence,repetitive sequence and aealing temperature of 19 pairs of primers adopted
2.2 微卫星DNA引物筛选
从49对引物中筛选出了19对适用于本实验的微卫星引物,其中:18个座位的核心序列是完全型,有5个座位点的核心序列是四碱基重复序列;1个座位点的核心序列是三碱基重复;12个座位点的核心重复序列是两碱基重复;有1个座位点核心序列是复合型,即为 (GA)11… (GT)… (GA)6;最佳退火温度范围在49~61℃之间。引物信息见表2。
2.3 群体遗传参数
19个微卫星位点总群体的等位基因数范围在5~33个之间,一共检测到370个等位基因,19个位点的PIC值范围在0.447~0.947之间。3个群体19个微卫星位点的等位基因数范围在2~26个之间,19个位点的PIC值范围在0.1202~0.9393之间,绝大部分是属于高度多态位点 (PIC>0.5)。
大眼鳜总群体19个位点的观察杂合度范围的平均观测等位基因数、平均有效等位基因数及平均香农指数分别为19.4737、10.5007、2.3998;总群体的平均观测纯合子、平均观测杂合子、平均期望纯合子、平均期望杂合子、平均Nei期望杂合度、平均遗传杂合度分别为0.6927、0.3073、0.1431、0.8569、0.8518、0.7206,表明大眼鳜总群体19个微卫星位点的遗传多样性较为丰富。比较大眼鳜3个群体19个位点观测等位基因数、香农指数I、平均观测杂合度均为红水河群体>左江群体>右江群体;平均期望杂合子度、Nei期望杂合度和平均遗传杂合度均为红水河群体>右江群体>左江群体。3群体19个位点的平均遗传参数比较结果表明,红水河群体的遗传多样性比较丰富(Ave_Het=0.7715),而左江群体和右江群体相对较低,并且二者之间遗传多样性水平较为接近(0.6921、0.6983)。
总群体固定指数表明:大眼鳜总群体在19个基因作为表现为杂合子严重缺失,显著偏离Hardy-Weinberg平衡。而大眼鳜左江群体、右江群体及红水河群体在某些位点上存在杂合过剩,而在大部分位点上存在杂合子缺失。
19个位点3群体间的遗传分化指数 (0.15>Fst=0.1539<0.25)属于中等遗传分化水平,群体内杂合子缺失严重,群体内的近交系数Fis为0.5761;各座位的基因流分布范围较广 (0.1474~8.9091),平均Nm值为1.3745。C1座位有最大的基因流,Nm=8.9091,而座位P18有最小的基因流,Nm=0.1474。
通过软件POPGENE1.32,采用Nei's遗传距离进行UPGMA聚类分析,由表3可知:右江群体和左江群体之间遗产距离最小 (1.0954),其次是右江群体和红水河群体的遗传距离 (1.1),遗传距离最远的是左江群体和红水河群体之间 (1.49)。遗传相似度也同样表明了3个不同地理群体之间的遗传关系。由图3可知:左江群体和右江群体首先聚为一支,再与红水河群体聚为一支,结合3群体的地理位置分布,3群体的遗传距离和遗传相似度跟3个群体的地理位置息息相关。
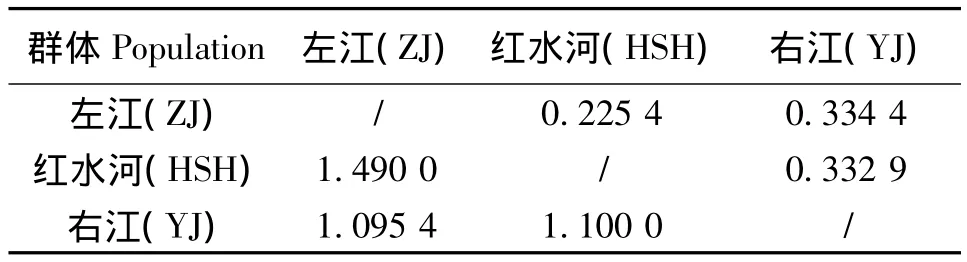
表3 3个群体间Nei's氏遗传距离 (对角线下方)和遗传相似度 (对角线上方)Table 3 The Nei's population genetic distances(lower triangle)and similarities(upper triangle)of S.kneri from three different water areas in Pearl River

图3 3个不同水域大眼鳜UPGMA分子系统树Fig.3 The molecular phylogenetic tree of S.kneri from three water areas in Pearl River by UPGMA method based on the Nei's genetic distances
3 讨论
利用生物信息学方法,自行设计了21对大眼鳜微卫星DNA引物,通过筛选获得了4对可应用于本实验的引物。4对引物对应的微卫星DNA的重复序列均为完全型,其微卫星DNA的重复序列分别为 (AC)9、(AC)39、(CA)13、 (AGG)8;重复序列次数最高达39次,最低也有8次;4个微卫星DNA的PCR最适退火温度范围是49~53℃,相对于通用引物的退火温度,自行设计的引物退火温度较低;根据PIC结果可知,本实验所开发的4个针对大眼鳜总群体的微卫星DNA标记属于高度多态性位点。与其他研究者所采用的获得微卫星引物方法相比较[10-11,18-20],本实验采用生物信息学获得微卫星DNA引物的方法,可大大降低实验成本及提高实验效率。
19个微卫星位点的总群体固定指数Fix范围为0.0014~1.0000,表明19个位点在总群体内表现为杂合子缺失,其对环境的应对能力有所下降。遗传参数统计结果表明,总群体观测等位基因数(na=19.4737)、香农指数 (I=2.3998)、平均杂合度 (Ave_Het=0.7206)、多态信息含量(0.447<PIC<0.947)均显示:在哈温平衡下,总体遗传多样性水平较为丰富。但3个群体的遗传多样性存在差异,红水河群体的遗传多样性最丰富(Ave_Het=0.7715),而左江群体和右江群体相对较低,并且二者之间遗传多样性水平较为接近(0.6921、0.6983)。动植物的遗传多样性受其生活史特性、繁育方式、地理分布、居群生境、物种的进化地位等很多因素的影响,统计分析表明,长寿命、广域分布、远交、动物取食传播的物种具有较高的遗传多样性[21]。可能因为左江和右江地区地质结构类似,且相对复杂,鱼类生活环境较差,均属于珠江流域干流上的支流[22],与外源群体间的基因交流缺乏,左江、右江群体较高的近交系数也证明了这点;而红水河水域位于广西省自然保护区内,稳定性较好,基因库资源丰富,人为干扰因素少,渔业自然资源保存较好,且处于珠江的干流[22-23],便于与其他群体进行基因交流。
大眼鳜3群体间遗传分化指数Fst为0.1539,介于0.15和0.25之间,属于中等遗传分化水平,有15.39%的遗传变异来自于群体间,84.61%的遗传变异来自于群体内,说明不同群体之间的差异主要来自群体个体间的变异。遗传分化指数与基因流呈负相关,遗传分化程度越低,表明基因流越顺畅[24]。根据 Hamrick 等[25]和 Slatkin[26]的观点,若每代迁入个体数Nm>1,基因流就足以抵制遗传漂变的作用,也同时防止了种群分化的发生;若Nm<1,基因流不足以抵制群体内因漂变引起的遗传分化,即有限的基因流可以促使群体发生遗传分化[25-26]。本研究各座位的基因流Nm分布范围较广 (0.1474~8.9091),平均 Nm值为1.3745,表明基因流基本顺畅,但群体内近交系数较高(Fis=0.5761),容易引起遗传结构的变化。Nei's遗传距离的聚类结果表明左江群体与右江群体首先聚为一支,再与红水河聚为一支。3个群体的聚类分析表明,大眼鳜微卫星分子标记的群体聚类与群体的地理分布呈现相关性:左江和右江的地理距离较近,且在南宁境内相连,两群体交流频繁,不存在地理隔离导致的生殖隔离,同为一个小群体,但相对左江和右江,红水河水域相对独立,与左江和右江无近缘水网相交联,另外,大眼鳜属定居性鱼类,其自然群体可以在近缘水体中自然繁殖,故红水河大眼鳜群体与左江和右江群体因地理隔离而导致了相应的生殖隔离[27],体现出了适度的遗传距离和遗传分化。
人类对珠江流域的利用极大地改变了河流水文,而地理环境的被迫改变必将影响鱼类种质资源的遗传多样性。李向阳等[28]在珠江水电开发对河流生态的影响及对策研究中,表明河流水文改变会对生物多样性产生直接影响。本实验所选取的3个江段修建的水电站对大眼鳜3个群体遗传多样性的影响不容忽视。对此,在进行水电站建设的同时,设计水电站鱼类增值放流站,增设鱼类洄游游道、建设相应的库区自然保护区等措施[29-30],降低水电站对库区鱼类资源造成的地理隔离、群体自交严重或基因交流匮乏的现象。
下一步的研究,有必要对珠江各流域大眼鳜进行更加全面深入地资源调查和群体遗传多样性研究,以期为大眼鳜种质资源的保护和合理利用提供更加可靠的科学依据。
[1]刘凌志,李桂峰,陈石娟,等.广西龟石水库大眼鳜的年龄与生长特征[J].中国水产科学,2012(2):229-236.
[2]刘凌志,陈石娟,卢薛,等.广西龟石水库鱼类资源调查研究[J].广西科学,2010(4):391-395.
[3]黄建华,李加儿,刘匆,等.鲑点石斑鱼和大眼鳜鳃的扫描电镜观察[J].动物学研究,2005(1):82-88.
[4]李红敬.珠江水系大眼鳜的食性研究[J].水利渔业,2008(4):66-68.
[5]李骏珉,杨明胜,陶正发.翘嘴鳜与大眼鳜生长速度对比试验报告[J].淡水渔业,1987(2):37-38.
[6]梁友光,田玲,刘友亮.大眼鳜幼鱼的耗氧量[J].水利渔业,1988(5):50-53.
[7]陈军,郑文彪,伍育源,等.鳜鱼和大眼鳜鱼年龄生长和繁殖力的比较研究[J].华南师范大学学报:自然科学版,2003(1):110-114.
[8]赵金良,李思发,蔡完其,等.长江水系不同水体鳜mtDNA控制区序列的遗传分析[J].湖泊科学,2007(1):92-97.
[9]王伟伟,赵金良,李思发,等.斑鳜不同地理群体遗传变异的AFLP分析[J].水生生物学报,2009(2):304-309.
[10]吴旭,严美姣,李钟杰.肖四海湖野生和人工放流鳜群体遗传结构分析[J].水生生物学报,2010(3):562-568.
[11]吴旭,严美姣,李钟杰.长江中下游不同地理种群鳜遗传结构研究[J].水生生物学报,2010(4):843-850.
[12]徐莉,赵桂仿.微卫星DNA标记技术及其在遗传多样性研究中的应用[J].西北植物学报,2002(3):714-722.
[13]孙效文,张晓锋,赵莹莹,等.水产生物微卫星标记技术研究进展及其应用[J].中国水产科学,2008(4):689-703.
[14]ARTOMONOVA V S.Genetic markers in population studies of atlantic salmon Salmo salar L:analysis of DNA sequences[J].Genetika,2007,43(4):437-50.
[15]姜彦超,苏建通,董颖,等.俄罗斯鲟雌核发育诱导及其后代的微卫星分析[J].中山大学学报:自然科学版,2012,5(4):102-111.
[16]陈省平,丁少雄,陈嘉慧.赤点石斑鱼群体遗传结构的微卫星分析[J].中山大学学报 :自然科学版,2012,51(3):83-89.
[17]J萨姆布鲁克,D W 拉塞尔.分子克隆实验指南[M].3版.北京:科学出版社,2002.
[18]匡刚桥,刘臻,鲁双庆,等.FIASCO法筛选鳜鱼微卫星标记[J].中国水产科学,2007(4):608-614.
[19]IRANAWATI F,JUNG H,CHAND V,et al.Analysis of genome survey sequences and SSR marker development for siamese mud carp,Henicorhynchus siamensis,using 454 pyrosequencing[J].Int J Mol Sci,2012,13(9):10807-10827.
[20]刘丽,刘海情,郭昱嵩,等.蛇鳄龟微卫星标记的开发及一个养殖群体的遗传多样性分析[J].水生生物学报,2013,37(4):669-677.
[21]HAMRICK J L,GODT M J W.Effects of life history traits on genetic diversity in plant species[J].Philosophical Transactions of the Royal Society in London,Series B,1996,351:1291-1298.
[22]周解,黄玉玲,梁华.广西江河渔业自然水环境及水系分布概况[J].广西水产科技,2003,4:16-19.
[23]谭杏芬.红水河——我国水能资源的宝库[J].中国民族,1985(12):46.
[24]WRIGHT S.Evolution and the genetics of populations.vol.4.Variability within and among natural populations[C].Chicago:University of Chicago Press,1978.
[25]HAMRICK J L,GODT M J W,SHERMAN-BROYLES L S.Gene flowamong plant populations:evidence from genetic markers[C]//HOCH P C,STEPHNON A G ,eds.Experimental and molecular approaches to plant biosystematics.Missouri Botanical Garden,1995:215-232.
[26]SLATKIN M.Gene flow in natural populations[J].AnnualReview of Ecology and Systematics,1985,16:393-430.
[27]MA G C,TSAO H S,LU H P,et al.AFLPs congruent with morphological differentiation of Asian common minnow Zacco(Pisces:Cyprinidae)in Taiwan[J].Zoologica Scripta,2006,3(4):341-351.
[28]李向阳,陈枫.珠江水电开发对河流生态的影响及对策研究[J].人民珠江,2009(1):17-19.
[29]王德良,辜娇峰.广西红水河自然保护区动物资源调查和保护对策[J].常德师范学院学报:自然科学版,2003,(2):49-56.
[30]员春晖,吕相龙.红水河桥巩水电站鱼类增殖放流站工艺设计[J].中国高新技术企业,2011(34):53-55.
