MSAP在水稻害虫白背飞虱中的应用研究*
2015-06-07陈佳林周晓穗梁士可李广宏王方海
张 梅,陈佳林,周晓穗,梁士可,李广宏,王方海
(中山大学有害生物控制与资源利用国家重点实验室//昆虫学研究所,广东广州510275)
甲基化敏感的扩增多态性分析方法 (MSAP)主要用来检测样品DNA的甲基化情况,它是在扩增片段长度多态性技术的基础上,结合用甲基化敏感的限制性内切酶消化处理样品基因组的技术建立起来的。该方法相对其它测定DNA甲基化程度的技术有如下优点:①可在全基因组范围内检测CCGG位点的胞嘧啶甲基化情况;②不需知道被测样品的DNA序列信息,因此可用于DNA序列未知的生物。在高等动物和许多植物上已大量应用[1-3],但在昆虫上尚未发现应用该方法的相关报道。
DNA甲基化是表观遗传修饰的主要形式,在植物和高等动物上已有大量报道,目前在果蝇、蚜虫、家蚕、甘蓝夜蛾等昆虫中也已发现基因组中存在DNA甲基化现象[4-5]。在蚂蚁基因组中,DNA甲基化这种表观遗传修饰的现象也已得到证实,且蚂蚁不同种属间在DNA甲基化谱上存在一定的差异[6]。Patalano 等[7]在 Current Opinion in Cell Biology上曾撰文指出社会性昆虫的多型现象与DNA甲基化相关。因此,昆虫中不仅存在大量DNA甲基化现象,且在调控昆虫生长发育和多型性等方面发挥着重要作用。
白背飞虱Sogatella furcifera(Horvath)为水稻重要害虫,其成虫有长翅型和短翅型两种类型。长翅型成虫具有远距离迁飞的能力,可以大范围内迁移扩散;短翅型成虫则具有产卵量大且产卵期长等特点,可以使种群数量在短期内快速增长。因此,成虫的长、短翅型比率发生动态是预测稻飞虱数量的一个重要参数[8-9]。长期以来人们一直致力于研究稻飞虱的性别分化和繁殖机理以及翅型分化,一旦取得重要突破,将有助于开发新的方法控制该种害虫的危害。
本研究首先对MSAP方法进行改进,使其可以应用在身体较小的昆虫样品中,并用白背飞虱为材料,对雌雄性别和长短翅型个体分别进行了DNA甲基化式样检测,结果发现无论是雌雄性别间还是长短翅型间,DNA甲基化式样都存在一定的差异,为今后进一步从DNA甲基化的角度探讨性别分化和翅型转换的机理打下良好的基础,同时也为今后在其它昆虫中应用MSAP方法提供一定的借鉴和指导。
1 材料和方法
1.1 供试昆虫
白背飞虱采自广州市华南农业大学水稻试验田内。挑选部分雌雄成虫及长翅型和短翅型雌成虫为供试昆虫。
1.2 基因组DNA的提取
分别采集白背飞虱长翅型雄成虫、长翅型雌成虫和短翅型雌成虫各20头,用微型玻璃匀浆器匀浆抽提基因组DNA,储存在-20℃的冰箱中待用,具体方法参照TaKaRa公司的基因组DNA提取试剂盒的方法和步骤。
1.3 基因组DNA的酶切
MSAP方法主要参照Xiong等[10]的研究报道,使用了两种对甲基化敏感性不同的限制性内切酶HpaⅡ和Msp I,以及内切酶EcoRⅠ,并进行了部分修改。选取每样品基因组DNA 100 ng,分别用EcoR I/Msp I或 EcoR I/Hpa II酶切组合 (TaKaRa公司)在37℃下酶切20 h,随后在66℃的恒温下处理20 min使酶灭活,未甲基化的CCGG位点被切割成黏性末端,而甲基化的位点则未被切割。具体酶切体系为15 μL:样品DNA 100 ng,10倍缓冲液1.5 μL,EcoR I酶 (15 U/μL)0.15 μL,Msp I酶 (10 U/μL)或 Hpa II酶 (10 U/μL)0.2 μL,灭菌水补足体积至15 μL。
1.4 接头及引物的配制
合成了 Elink1、Elink2和 HMlink1、HMlink2共4个单链序列 (见表1),分别将这些单链序列DNA配制成浓度为 500 pmol/μL的溶液,将互补的单链序列分别取100 μL配对混匀后于56℃孵育2 min,然后以每2 min递降2℃的速度逐步冷却到10℃,使其自身退火形成E接头和HM接头备用。引物分为预扩增引物E0、HM0和选择性扩增引物E1、HM1-HM3(见表1)。将预扩增引物配制成500 ng/μL的母液、选择性扩增引物配制成质量浓度为300 ng/μL的母液备用。分别取预扩增引物和选择性扩增引物的母液4 μL,加水36 μL配制成50 ng/μL和30 ng/μL的质量浓度待用。

表1 MSAP方法中所使用的接头和引物序列Table 1 Sequences of primers and adapters used for MSAP
1.5 DNA片段与接头连接
选取各样品的酶切产物15 μL,分别加入E接头和HM接头各1 μL,在T4 DNA连接酶 (TaKa-Ra公司)(350 U/μL)作用下,16℃连接14 h,随后于65℃下恒温处理30 min使T4 DNA连接酶失活。按照DNA片段纯化试剂盒 (TaKaRa公司)纯化上述连接产物。
1.6 连接产物的PCR扩增
将上述各样品连接产物用ddH2O稀释10倍,取2 μL作为模板,加入1 μL质量浓度为50 ng/μL的E0和HM0引物,在LA Taq酶 (TaKaRa公司)(5 U/μL)作用下进行PCR预扩增。20 μL的反应体系,94℃ 1 min,94℃ 30 s,56℃ 30 s,72℃ 1 min,25个循环,72℃ 10 min,4℃ forever。
预扩增产物用ddH2O稀释20倍后,取2 μL作为模板,加入E1引物和HM1-3中的任一引物各1 μL,在LA Taq酶 (TaKaRa公司)(5 U/μL)作用下进行PCR选择性扩增。20 μL的反应体系,94℃1 min,94℃ 30 s,65℃ 30 s(每个循环降0.7℃),72℃ 1 min,13循环;94℃ 30 s,56℃ 30 s,72℃1 min,23个循环,72℃ 10 min,12℃ forever。
1.7 非变性聚丙烯酰胺凝胶电泳
将最终得到的各样品选择性扩增产物进行非变性聚丙烯酰胺凝胶电泳,凝胶质量分数为6%,先50 V恒压电泳20 min,再经130 V恒压电泳2.5h。电泳完毕后,小心分开两玻璃板,将固着有聚丙烯酰胺凝胶的亲水玻璃板放入预先准备好的φ=10%的醋酸固定液中浸泡。随后进行银染,具体银染方法参照文献[11]。
1.8 数据分析
在MSAP方法中,常用到DNA内切酶Msp I和Hpa II,这2种酶虽然都能识别和分解同样的5'-CCGG-3'位点,但对DNA甲基化的敏感性不同。根据EcoRI+MspI或 EcoRI+HpaII组合的酶切样品的扩增产物电泳图谱,可以将5'-CCGG-3'位点的甲基化式样分为以下4种类型 (表2)。I:HpaII(H)和MspI(M)泳道中均出现条带,表明2条DNA链中的1条里面胞嘧啶被甲基化,或没有甲基化发生,通常被看作未甲基化;II:条带只出现在HpaII泳道中,在MspI泳道中没有条带,表明2条DNA链中的1条外面胞嘧啶被甲基化,通常被看作半甲基化;III:条带只出现在MspI泳道中,在HpaII泳道中没有条带,表明2条DNA链中的里面胞嘧啶均被甲基化,通常被看作全甲基化;IV:在MspI和HpaII泳道中均没有条带出现,表明2条DNA链中的外面胞嘧啶均被甲基化。
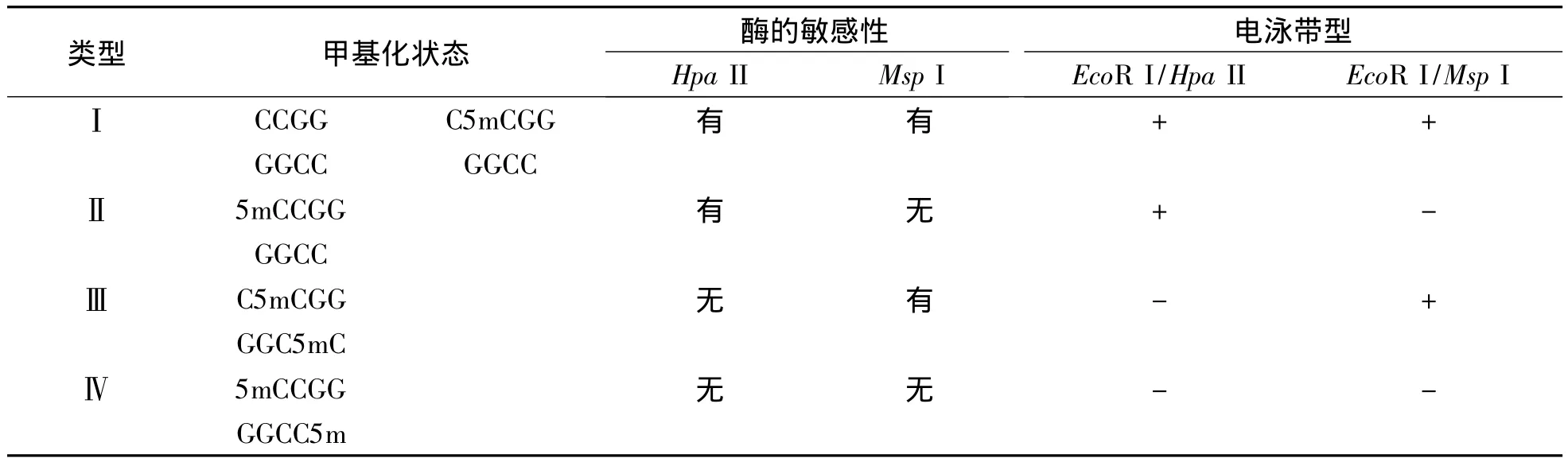
表2 基因组DNA被Hpa II和Msp I酶切后呈现出的甲基化类型1)Table 2 Methylation patterns of genomic DNA digested by Hpa II and Msp I
2 结果与分析
2.1 MSAP方法的改进
MSAP方法主要由 Xiong等[10]于1999年发展起来,该方法主要包括DNA提取、双酶切、接头连接、两轮PCR、电泳等几个步骤。我们参照了Xiong等的方法,对部分环节进行了适当改进,使其适用于体型很小的昆虫,并用白背飞虱具体进行了实验,结果比较理想。我们主要在如下5个方面进行了部分改进 (见表3):①DNA提取采用了Takara基因组纯化试剂盒,不仅提取时间大为缩短,且获得的基因组DNA纯度较高;②酶切时基因组DNA用量从原方法的2 μg减少到100 ng,这样不但减少了酶的用量,节约成本,且更适合体形较小、难以收集大量样本材料的多数昆虫;③酶切时间比原先增加了14 h,这样使得基因组DNA被酶解得更彻底;④接头连接时间从原先的4 h增加到14 h,这样可以让多数相关DNA片段连上接头;带,这样就不需要使用放射性标记的引物,减少了放射性操作和污染。

表3 MSAP方法被改进的5个方面Table 3 Five aspects of MSAP improved in our method
2.2 白背飞虱雌、雄成虫的MSAP图谱
利用改进后的方法,对白背飞虱雌雄成虫的基因组DNA进行了MSAP分析,利用3对引物组合E1HM1、E1HM2和E1HM3,扩增到很多条带,多数介于100~600 bp之间 (图1),显示出的带型表明在白背飞虱雌雄成虫中既有全甲基化的5'-CCGG-3'位点,也有半甲基化的5'-CCGG-3'位点。同时还发现白背飞虱雌雄成虫间的带型存在一定差异,说明雌雄虫间基因组的甲基化式样应有所不同。那么基因组甲基化式样的差异会不会影响白背飞虱的雌雄性别分化?还需今后进一步深入研究。

图1 雌雄白背飞虱样品的MSAP电泳图Fig.1 MSAP electrophoretogram of male and female sampless of Sogatella furcifera引物组合为E1HM1,E1HM2和E1HM3;H:由EcoRI+HpaII酶解;M:由EcoRI+MspI酶解;雄:雄虫样品;雌:雌虫样品;Mark:DNA相对分子质量标准;I:未甲基化条带;II:半甲基化条带;III:全甲基化条带
2.3 白背飞虱雌成虫长、短翅型的MSAP图谱
利用改进后的方法,也对白背飞虱雌成虫长、短翅型的基因组DNA进行了MSAP分析,利用3对引物组合,扩增到的条带多数介于100~300 bp之间 (图2),显示出的带型既有全甲基化的5'-CCGG-3'位点,也有半甲基化的5'-CCGG-3'位点。同时还发现长翅型样品和短翅型样品的带型存在明显差异,说明不同翅型间虫体基因组的甲基化式样应有所不同。那么DNA的甲基化有没有参与白背飞虱翅型分化的调控?如果参与的话,其具体调控机制又是什么?还有待今后深入研究。
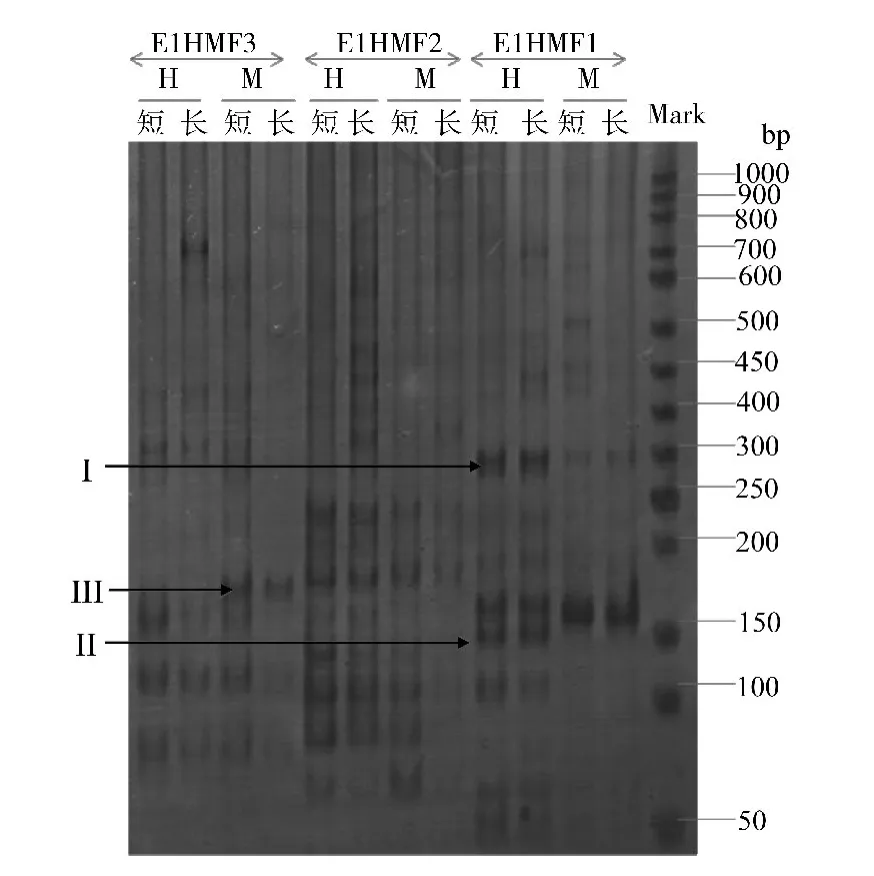
图2 长、短翅白背飞虱样品的MSAP电泳图Fig.2 MSAP electrophoretogram of samples from macropterous and brachypterous female adults of Sogatella furcifera引物组合为E1HM1,E1HM2和E1HM3;H:由EcoRI+HpaII酶解;M:由EcoRI+MspI酶解;短:短翅型雌虫样品;长:长翅型雌虫样品;Mark:DNA相对分子质量标准;I:未甲基化条带;II:半甲基化条带;III:全甲基化条带
3 讨论
MSAP是在扩增片段长度多态性技术基础上建立起来的主要用来检测样品DNA甲基化情况的一种方法,特别适用于全基因组范围内检测CCGG位点的胞嘧啶甲基化情况,在高等动物和许多植物上已广泛应用。DNA甲基化是表观遗传修饰的主要形式,在脊椎动物和高等植物上已有大量研究成果[1,12],然而,在无脊椎动物昆虫中甲基化的研究相对较晚,文献报道主要集中于这几年[5],目前尚未有在昆虫中应用MSAP方法的报道。为了能将MSAP方法应用于体型较小的昆虫,对该方法进行了部分改进:采用Takara试剂盒提取样品DNA、降低酶切时基因组DNA用量、增加酶切和接头连接时间、用银染方法取代放射显影技术 (具体见结果中的描述)。利用改进后的方法,在白背飞虱中进行了具体实验,成功获得了与性别或长短翅型相关联的MSAP图谱,这为将来在其它昆虫中使用该方法研究基因组DNA甲基化情况提供了一定借鉴和指导价值。
本研究成功获得了白背飞虱雌雄性别和长短翅型的MSAP图谱,发现无论是雌雄性别间,还是长短翅型间,其基因组DNA甲基化式样都存在一定的差异,说明DNA甲基化可能参与了性别和翅型分化的调控。这为今后从DNA甲基化的角度研究白背飞虱性别和翅型分化的调控机制打下了良好的开端。
[1]XIAO J,SONG C,LIU S,et al.DNA methylation analysis of allotetraploid hybrids of red crucian carp(Carassius auratus red var.)and common carp(Cyprinus carpio L.)[J].PLoS ONE,2013,8:e56409.
[2]KARAN R,DELEON T,BIRADAR H S,et al.Salt stress induced variation in DNA methylation pattern and its influence on gene expression in contrasting rice genotypes[J].PLoS ONE,2012,7:e40203.
[3]ZHANG X,GE X,SHAO Y,et al.Genomic change,retrotransposon mobilization and extensive cytosine methylation alteration in Brassica napus introgressions from two intertribal hybridizations[J].PLoS ONE,2014,8:e56346.
[4]XIANG H,ZHU J,CHEN Q,DAI F,et al.Single baseresolution methylome of the silkworm reveals a sparse epigenomic map[J].Nature Biotechnology,2010,28:516-520.
[5]DREWELL R A,LO N,OXLEY P R,et al.Kin con fl ict in insect societies:a new epigenetic perspective[J].Trends in Ecology and Evolution,2012,27(7):367-373.
[6]BONASIO R,LI Q,LIAN J,et al.Genome-wide and caste-speci fl c DNA methylomes of the ants Camponotus fl oridanus and Harpegnathos saltator[J].Current Biology,2012,22:1-10.
[7]PATALANO S,HORE T A,REIK W.Shifting behaviour:epigenetic reprogramming in eusocial insects [J].Current Opinion in Cell Biology,2012,24:367-373.
[8]张琼秀,孙梓暄,李广宏,等.外源激素对褐飞虱翅型分化的影响[J].中山大学学报:自然科学版,2007,46(3):76-78.
[9]张琼秀,孙梓暄,李广宏,等.三种外源激素对白背飞虱翅型分化的影响[J].生态学报,2008,28(12):5994-5998.
[10]XIONG L,XU C,SAGHAI M A,et al.Patterns of cytosine methylation in an elite rice hybrid and its parental lines,detected by a methylation-sensitive amplification polymorphism technique [J].Molecular and General Genetic,1999,261:439-446.
[11]BASSAM B J,CAETANO-ANOLLES G,GRESSHOFF P M.Fast and sensitive silver staining of DNA in polyacrylamide gels[J].Anallytical Biochemistry,1991,196:80-83.
[12]WANG H,FENG Q,ZHANG M,et al.Alteration of DNA methylation level and pattern in sorghum(Sorghum bicolor L.)pure-lines and inter-line F1 hybrids following low-dose laser irradiation [J].Journal of Photochemistry and Photobiology B:Biology,2010,99:150-153.
