Cu-Co-Al复合氧化物在N2O分解反应中的催化活性
2015-06-06张海杰徐秀峰
张海杰,王 建,窦 喆,徐秀峰
(烟台大学 化学化工学院,山东 烟台 264005)
环 境 与 化 工
Cu-Co-Al复合氧化物在N2O分解反应中的催化活性
张海杰,王 建,窦 喆,徐秀峰
(烟台大学 化学化工学院,山东 烟台 264005)
以金属硝酸盐为原料、柠檬酸为络合剂,采用溶胶-凝胶法和高温焙烧法制备了系列CuxCo1-xCoAlO4复合氧化物催化剂,并采用浸渍法制备了相应的K改性催化剂,将这些催化剂用于N2O分解反应,考察了催化剂组成和K负载量对活性的影响。采用N2物理吸附(BET)、XRD和H2-TPR等技术对催化剂的结构进行了表征。实验结果表明,Cu0.1Co0.9CoAlO4催化剂的活性较高。表征结果显示,系列CuxCo1-xCoAlO4复合氧化物均为尖晶石型结构。在550 ℃下N2O连续进行分解反应600 min,有氧无水气氛中Cu0.1Co0.9CoAlO4和0.03K/Cu0.1Co0.9CoAlO4(K与(Cu+Co)的原子比为0.03)催化剂上的N2O转化率分别为77.0% 和92.8%;而在有氧有水气氛中Cu0.1Co0.9CoAlO4和0.03K/Cu0.1Co0.9CoAlO4催化剂上的N2O转化率分别为14.5%和36.2%。与Cu0.1Co0.9CoAlO4催化剂相比,0.03K/Cu0.1Co0.9CoAlO4催化剂具有较高的活性和稳定性。
铜-钴-铝复合氧化物催化剂;钾改性催化剂;一氧化二氮分解;溶胶-凝胶法
生产己二酸、硝酸等工业过程排放的N2O,温室效应潜值达310,存留时间约120 a,是《京都议定书》限制排放的温室气体之一。催化分解法是消除N2O的有效方法,即在催化剂作用下,将N2O分解为对环境无毒、无害的N2和O2[1-10]。在各种类型的催化剂中,尖晶石型金属氧化物是近年来研究较多的一类催化剂,特别是Co3O4等钴系氧化物对于N2O分解反应的活性较高[11-12],在此基础上,Yan等[13-14]用Ni2+、Mg2+或Zn2+取代Co3O4中的部分Co2+,制备了组成适宜的钴系复合氧化物,催化活性明显提高。经研究还发现,在钴系复合氧化物表面负载某些助剂可进一步提高催化剂活性,如Abu-Zied等[15]在MgxCo1-xCo2O4表面负载K,催化剂活性大幅提高。Maniak等[16]用不同钾盐溶液浸渍Co3O4制备K改性催化剂时发现,用K2CO3浸渍Co3O4得到的改性催化剂活性较高。本课题组也曾做过相关工作,制备了CuxCo1-xCo2O4尖晶石型二元复合氧化物及K改性催化剂,用于催化分解N2O[17]。目前,有关钴系三元复合氧化物催化分解N2O的研究报道较少。
为提高钴系复合氧化物的稳定性,并简化催化剂的制备过程,本工作以金属硝酸盐为原料、柠檬酸为络合剂,采用溶胶-凝胶法和高温焙烧法制备了不同组成的CuxCo1-xCoAlO4尖晶石型三元复合氧化物及K改性催化剂,并将催化剂用于N2O分解反应,考察了催化剂组成、K负载量等对催化分解N2O活性和稳定性的影响;并采用N2物理吸附(BET)、XRD和H2-TPR等技术对催化剂的结构进行了表征。
1 实验部分
1.1 Cu-Co-Al复合氧化物的制备
按要求的化学计量比配制总金属离子浓度为1 mol/L的Co(NO3)2,Al(NO3)3,Cu(NO3)2混合溶液,配制1 mol/L的柠檬酸溶液。将柠檬酸溶液滴加至金属盐的混合溶液中,剧烈搅拌,滴完后持续搅拌30 min。将母液在65 ℃下旋转蒸发至生成透明的胶状物,120 ℃下干燥12 h,800 ℃下焙烧4 h,制得催化剂,记为CuxCo1-xCoAlO4,其中x=0,0.1,0.2。
制备CoAl2O4的过程与上述方法相似,其中,原料为Co(NO3)2和Al(NO3)3的混合溶液。
1.2 K改性Cu0.1Co0.9CoAlO4催化剂的制备
配制不同浓度的K2CO3溶液,室温下等体积浸渍Cu0.1Co0.9CoAlO4各24 h,120 ℃下干燥12 h,800 ℃下焙烧4 h,制得K改性催化剂,记为yK/ Cu0.1Co0.9CoAlO4,其中,y为K与(Cu+Co)的原子比(取值0.02,0.03,0.05,0.10)。
1.3 N2O分解反应
N2O分解反应在固定床反应器中进行,如不特殊说明,反应气的体积组成为2%N2O-4%O2-Ar(Ar为平衡气,下同)。进行有氧有水条件的活性评价时,反应气的体积组成为2%N2O-4%O2-8.8%H2O-Ar。气体总流量140 mL/min,催化剂用量1 g。采用程序升温控制仪控制反应炉温,每个温度下恒温反应30 min,反应尾气经六通阀进样,采用GC-920型气相色谱仪(上海海欣色谱仪器公司,固定相为Porapak Q,TCD检测,载气为H2)分析N2O的剩余浓度,计算N2O转化率。
催化剂稳定性实验:以10 ℃/min的速率从室温升至550 ℃,恒温反应10 h,检测不同反应时刻N2O的浓度,计算N2O转化率。
1.4 催化剂的表征
采用日本岛津公司的XRD-6100型X射线衍射仪对试样进行XRD表征,Cu Kα射线,石墨单色器,管电压40 kV,管电流30 mA,闪烁计数器记录衍射强度。
采用美国Quantachrome公司的NOVA3000e型多点氮吸附仪测定试样的比表面积,测试前试样在300 ℃、减压下干燥2 h,N2为吸附质,-196 ℃下吸附,室温下脱附,用BET公式计算试样的比表面积。
采用北京彼奥德公司的PCA-1200型化学吸附仪对试样进行H2-TPR实验,试样用量约80 mg。测试前对试样进行预处理,在Ar中从室温以10 ℃/ min的速率升至500 ℃,恒温吹扫30 min,然后冷却至室温。关闭Ar气,打开10%H2-Ar混合气,流量20 mL/min,再以10 ℃/min的升温速率升至900℃,TCD记录耗氢信息。
2 结果与讨论
2.1 不同组成Cu-Co-Al复合氧化物的结构特征与催化活性
图1给出了不同组成Cu-Co-Al复合氧化物的XRD谱图。
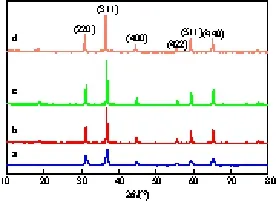
图1 不同组成Cu-Co-Al复合氧化物的XRD谱图Fig.1 XRD patterns of composite Cu-Co-Al oxides with different compositions.a CoAl2O4;b CoCoAlO4;c Cu0.1Co0.9CoAlO4;d Cu0.2Co0.8CoAlO4
由图1可见,不同组成的Cu-Co-Al复合氧化物均呈现出尖晶石型结构(220),(311),(400),(511),(440)等晶面的特征衍射峰。对比不同试样的衍射峰强度可见,CoAl2O4的衍射峰强度较弱,根据Scherrer方程可推断其晶粒较小,这与其比表面积较高(见表1)是一致的,而CoCoAlO4,Cu0.1Co0.9CoAlO4,Cu0.2Co0.8CoAlO4的比表面积很低,衍射峰强度很强,晶粒较大。

表1 不同组成Cu-Co-Al复合氧化物的比表面积Table 1 BET specific surface area of the composite Cu-Co-Al oxides with different compositions
不同组成Cu-Co-Al复合氧化物上N2O的转化率见图2。由图2可见,Cu0.1Co0.9CoAlO4催化剂的活性较高。文献[1-10]报道,N2O分解反应遵循氧化-还原机理(Red-ox),即N2O分解过程中,N2O分子在催化剂表面活性位上吸附,N—O键活化而断开,生成N2和吸附态氧原子,后者相互结合并从表面活性位上脱附下来,生成产物O2。该反应的速率控制步骤为催化剂表面氧的脱除。可以认为,催化剂表面金属粒子与氧的作用强度与催化活性密切相关。图3给出了不同组成Cu-Co-Al复合氧化物的H2-TPR谱图。对图3进行解析可知:1)Cu0.1Co0.9CoAlO4和Cu0.2Co0.8CoAlO4在200~300 ℃区间的还原峰归属于试样中游离态CuO的还原(Cu2+→Cu0),相比较而言,Cu0.2Co0.8CoAlO4在此温度区间的峰面积(耗氢量)大于Cu0.1Co0.9CoAlO4,表明Cu0.2Co0.8CoAlO4中游离态的CuO多于Cu0.1Co0.9CoAlO4中游离态的CuO。2)CoCoAlO4,Cu0.1Co0.9CoAlO4,Cu0.2Co0.8CoAlO43个试样在400~600 ℃区间的还原峰归属于Co3+还原为Co2+(Co3O4→CoO),600~800 ℃区间的还原峰归属于Co2+还原为Co0(CoO→Co),800~900 ℃区间的还原峰归属于其中CoAl2O4和CuAl2O4的Co2+和Cu2+的还原。需注意的是,CoAl2O4试样中Co2+的还原温度很高(接近900 ℃),表明其中Co2+很难还原,故CoAl2O4催化剂的活性很低。3)理论推测CoCoAlO4中Co3+还原为Co2+和Co2+还原为Co0的耗氢量比应为1∶4,这与图3(b)谱线的相应峰面积之比基本一致。同时,CoCoAlO4中Co3+还原为Co2+和 Co2+还原为Co0的两个耗氢峰没有交叉,表明这两步还原反应分离清晰。不同的是,Cu0.1Co0.9CoAlO4和Cu0.2Co0.8CoAlO4中Co3+还原为Co2+的耗氢峰与Co2+还原为Co0的还原峰发生了交叠,两步还原反应连续进行;且Cu0.1Co0.9CoAlO4和Cu0.2Co0.8CoAlO4在400~600 ℃区间的还原峰面积大于CoCoAlO4,表明Cu0.1Co0.9CoAlO4和Cu0.2Co0.8CoAlO4中部分Co2+的还原温度发生前移。可以认为,由于铜离子的促进作用,使得Cu0.1Co0.9CoAlO4和Cu0.2Co0.8CoAlO4中钴离子的还原性优于CoCoAlO4中钴离子的还原性,故Cu0.1Co0.9CoAlO4和Cu0.2Co0.8CoAlO4的催化活性高于CoCoAlO4。
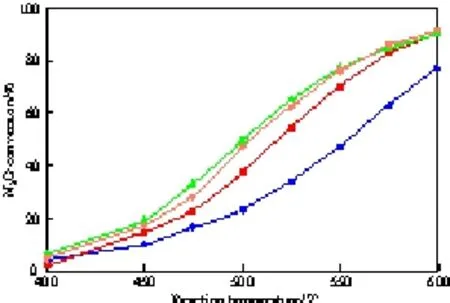
图2 不同组成Cu-Co-Al复合氧化物上N2O的转化率Fig.2 N2O conversion on the composite Cu-Co-Al oxides with different compositions.Reaction conditions:reactant gases 2%N2O-4%O2-Ar(volume fraction,Ar:equilibrium gas,the same below),flow rate 140 mL/min,catalyst 1 g.CoAl2O4;CoCoAlO4;Cu0.1Co0.9CoAlO4;Cu0.2Co0.8CoAlO4
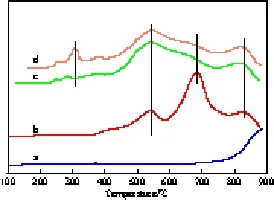
图3 不同组成Cu-Co-Al复合氧化物的H2-TPR谱图Fig.3 H2-TPR curves of the composite Cu-Co-Al oxides with different compositions.a CoAl2O4;b CoCoAlO4;c Cu0.1Co0.9CoAlO4;d Cu0.2Co0.8CoAlO4
2.2 K改性催化剂的结构特征与活性
由2.1节的实验结果可知,对于有氧气氛的N2O分解反应,组成为Cu0.1Co0.9CoAlO4的催化剂活性较高。为进一步提高催化剂活性,在其表面浸渍K2CO3溶液,制备不同K负载量的改性催化剂。
yK/Cu0.1Co0.9CoAlO4催化剂的XRD谱图见图4。由图4可见,K改性催化剂中未发现钾物种的衍射峰,只有尖晶石物相的特征晶面衍射峰。这可能由于K的负载量不高且均匀分散在催化剂表面所致。yK/Cu0.1Co0.9CoAlO4催化剂的比表面积测试结果(见表2)表明,助剂K的加入使得催化剂的比表面积略有降低。
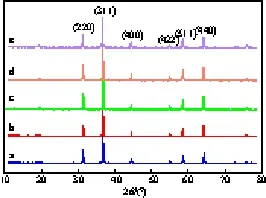
图4 yK/Cu0.1Co0.9CoAlO4催化剂的XRD谱图Fig.4 XRD patterns of yK/Cu0.1Co0.9CoAlO4catalysts. y=n(K)∶n(Cu+Co).a Cu0.1Co0.9CoAlO4;b 0.02K/Cu0.1Co0.9CoAlO4;c 0.03K/Cu0.1Co0.9CoAlO4;d 0.05K/Cu0.1Co0.9CoAlO4;e 0.10K/Cu0.1Co0.9CoAlO4
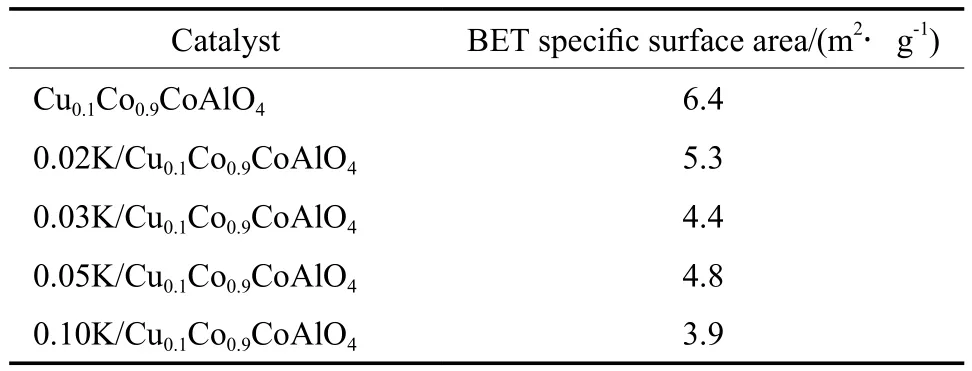
表2 yK/Cu0.1Co0.9CoAlO4催化剂的比表面积Table 2 BET specific surface areas of yK/Cu0.1Co0.9CoAlO4catalysts
图5给出了yK/Cu0.1Co0.9CoAlO4催化剂上N2O的转化率。由图5可见,随K负载量的增加,催化剂活性先升高后降低,其中,y=0.03的K改性催化剂活性较高。图6是yK/Cu0.1Co0.9CoAlO4催化剂的H2-TPR谱图。由图6可见,K改性催化剂中无游离态CuO(铜物种以复合氧化物的形式存在)。与Cu0.1Co0.9CoAlO4催化剂相比,K改性催化剂在400~600 ℃区间的还原峰(Co3+→Co2+)均向低温方向移动,其中,y=0.03的催化剂还原温度较低,0.03K/Cu0.1Co0.9CoAlO4催化剂的活性较高,表明添加适量的助剂K弱化了催化剂表面的Co—O键,使氧物种的脱除易于进行,从而促进N2O分解反应的进行。
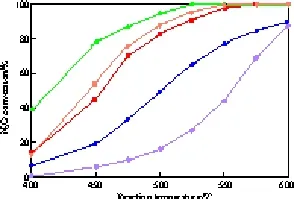
图5 yK/Cu0.1Co0.9CoAlO4催化剂上N2O的转化率Fig.5 N2O conversions on the yK/Cu0.1Co0.9CoAlO4catalysts. Reaction conditions: reactant gases 2%N2O-4%O2-Ar,flow rate 140 mL/min,catalyst 1 g.Cu0.1Co0.9CoAlO4;0.02K/Cu0.1Co0.9CoAlO4;0.03K/Cu0.1Co0.9CoAlO4;0.05K/Cu0.1Co0.9CoAlO4;0.10K/Cu0.1Co0.9CoAlO4

图6 yK/Cu0.1Co0.9CoAlO4催化剂的H2-TPR谱图Fig.6 H2-TPR curves of the yK/Cu0.1Co0.9CoAlO4catalysts. a Cu0.1Co0.9CoAlO4;b 0.02K/Cu0.1Co0.9CoAlO4;c 0.03K/Cu0.1Co0.9CoAlO4;d 0.05K/Cu0.1Co0.9CoAlO4;e 0.10K/Cu0.1Co0.9CoAlO4
2.3 有氧有水气氛中K改性催化剂的活性与稳定性
由2.2节的实验结果可看出,0.0 3 K/ Cu0.1Co0.9CoAlO4催化剂对于有氧气氛的N2O分解反应有较高活性,因此考察了该催化剂在有氧有水气氛中的活性和稳定性,实验结果见图7和图8。由图7可见,反应气含水时,0.03K/Cu0.1Co0.9CoAlO4催化剂的活性明显降低,这可能由于水分子在催化剂表面吸附活化,生成的羟基基团与表面活性位结合,与N2O发生了竞争吸附,抑制了N2O的活化和分解[14]。
由图8可见,550 ℃连续反应600 min,有氧气氛中Cu0.1Co0.9CoAlO4和0.03K/Cu0.1Co0.9CoAlO4催化剂上的N2O转化率分别为77.0%和92.8 %,而有氧有水气氛中Cu0.1Co0.9CoAlO4和0.03K/Cu0.1Co0.9CoAlO4催化剂上的N2O转化率分别为14.5%和36.2 %。相比较而言,在Cu-Co-Al复合氧化物表面负载适量的助剂K,可显著提高催化剂的稳定性。
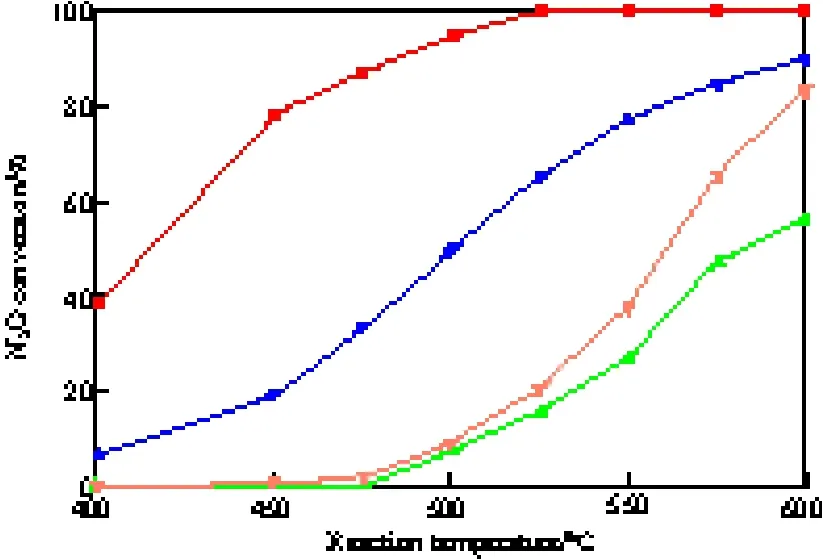
图7 有氧有水气氛中K/Cu0.1Co0.9CoAlO4催化剂的活性Fig.7 N2O conversion over K/Cu0.1Co0.9CoAlO4in the presence of oxygen and steam.Reaction conditions:reactant gases 2%N2O-4%O2-(0 or 8.8%)H2OAr, flow rate 140 mL/min,catalyst 1 g.Cu0.1Co0.9CoAlO4(O2);0.03K/Cu0.1Co0.9CoAlO4(O2);Cu0.1Co0.9CoAlO4(O2+H2O);0.03K/Cu0.1Co0.9CoAlO4(O2+H2O)
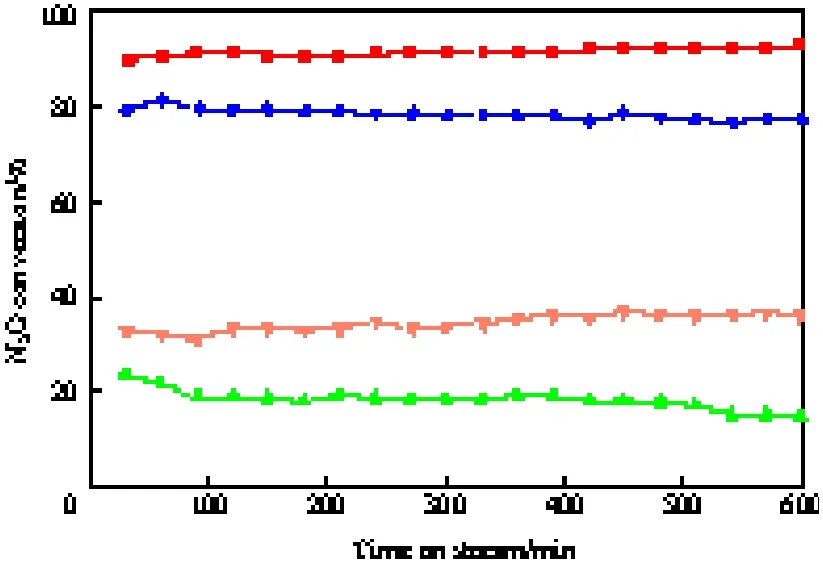
图8 有氧有水气氛中K/Cu0.1Co0.9CoAlO4催化剂的稳定性Fig.8 Stability of the K/Cu0.1Co0.9CoAlO4catalyst for the N2O decomposition in the presence of oxygen and steam.Reaction conditions:reactant gases 2%N2O-4%O2-(0 or 8.8%)H2OAr, flow rate 140 mL/min, catalyst 1 g, 550 ℃.Cu0.1Co0.9CoAlO4(O2);0.03K/Cu0.1Co0.9CoAlO4(O2);Cu0.1Co0.9CoAlO4(O2+H2O);0.03K/Cu0.1Co0.9CoAlO4(O2+H2O)
3 结论
1)采用溶胶-凝胶法及800 ℃下焙烧法制备的系列CuxCo1-xCoAlO4复合氧化物催化剂,表征结果显示,系列CuxCo1-xCoAlO4复合氧化物均为尖晶石型结构。
2)对于有氧气氛的N2O分解反应,Cu0.1Co0.9CoAlO4催化剂的活性较高。
3)在Cu0.1Co0.9CoAlO4表面浸渍K2CO3溶液,高温焙烧制得K改性催化剂,在有氧无水和有氧有水气氛的N2O分解反应中,均表现出较高的活性。与Cu0.1Co0.9CoAlO4催化剂相比,K改性催化剂的稳定性显著提高。
[1] 冯鸣,姬长春,李明明,等. 助剂负载量和焙烧温度对K/ CuAl复合氧化物催化分解N2O性能的影响[J]. 石油化工,2012,41(7):830 - 834.
[2] Ohnishi C,Asano K,Iwamoto S,et al. Alkali-Doped Co3O4Catalysts for Direct Decomposition of N2O in the Presence of Oxygen[J]. Catal Today,2007,120(2):145 - 150.
[3] Asano K,Ohnishi C,Iwamoto S,et al. Potassium-Doped Co3O4Catalyst for Direct Decomposition of N2O[J]. Appl Catal,B,2008,78(3/4):242 - 249.
[4] Pasha N,Lingaiah N,Babu N S,et al. Studies on Cesium Doped Cobalt Oxide Catalysts for Direct N2O Decomposition in the Presence of Oxygen and Steam[J]. Catal Commun,2008,10(2):132 - 136.
[5] Xue Li,Zhang Changbin,He Hong,et al. Catalytic Decomposition of N2O over CeO2Promoted Co3O4Spinel Catalyst[J]. Appl Catal,B,2007,75(3/4):167 - 174.
[6] Xue Li,Zhang Changbin,He Hong,et al. Promotion Effect of Residual K on the Decomposition of N2O over Cobalt-Cerium Mixed Oxide Catalyst[J]. Catal Today,2007,126(3/4):449 - 455.
[7] Xue Li,He Hong,Liu Chang,et al. Promotion Effects and Mechanism of Alkali Metals and Alkaline Earth Metals on Cobalt-Cerium Composite Oxide Catalysts for N2O Decomposition [J]. Environ Sci Technol,2009,43(3):890 - 895.
[8] Shen Qun,Li Landong,Li Jinjun,et al. A Study on N2O Catalytic Decomposition over Co/MgO Catalysts[J]. J Hazard Mater,2009,163(2/3):1332 - 1337.
[9] Cheng Hongkui,Huang Yanqiang,Wang Aiqin,et al. N2O Decomposition over K-Promoted Co-Al Catalysts Prepared from Hydrotalcite-Like Precursors[J]. Appl Catal,B,2009,89(3/4):391 - 397.
[10] Xu Xiaoling,Xu Xiufeng,Zhang Guotao,et al. Preparation of Co-Al Mixed Oxide Supported Gold Catalysts and Their Catalytic Activity for N2O Decomposition[J]. J Fuel Chem Technol,2009,37(5):595 - 600.
[11] Russo N,Fino D,Saracco G,et al. N2O Catalytic Decomposition over Vatious Spinel-Type Oxides[J]. Catal Today,2007,119(1/4):228 - 232.
[12] Stelmachowski P,Maniak G,Kotarba A,et al. Strong Electronic Promotion of Co3O4Towards N2O Decomposition by Surface Alkali Dopants[J]. Catal Commun,2009,10(7):1062 - 1065.
[13] Yan Liang,Ren Tong,Wang Xiaolai,et al. Catalytic Decomposition of N2O over MxCo1-xCo2O4(M=Ni,Mg) SpinelOxides [J]. Appl Catal,B,2003,45(2):85 - 90.
[14] Yan Liang,Ren Tong,Wang Xiaolai,et al. Excellent Catalytic Performance of ZnxCo1-xCo2O4Spinel Catalysts for the Decomposition of Nitrous Oxide[J]. Catal Commum,2003,4(10):505 - 509.
[15] Abu-Zied B M. Nitrous Oxide Decomposition over Alkali-Promoted Magnesium Cobaltite Catalysts[J]. Chin J Catal,2011,32(2):264 - 272.
[16] Maniak G,Stelmachowski P,Kotarba A,et al. Rationales for the Selection of the Best Precursor for Potassium Doping of Cobalt Spinel Based deN2O Catalyst[J]. Appl Catal,B,2013,136/137:302 - 307.
[17] Dou Zhe,Zhang Haijie,Pan Yanfei,et al. Catalytic Decomposition of N2O over Potassium-Modified Cu-Co Spinel Oxides [J]. J Fuel Chem Tech,2014,42(2):238 - 245.
(编辑 李明辉)
Catalytic Activity of Composite Cu-Co-Al Oxides in N2O Decomposition
Zhang Haijie,Wang Jian,Dou Zhe,Xu Xiufeng
(School of Chemistry and Chemical Engineering,Yantai University,Yantai Shandong 264005,China)
A series of composite CuxCo1-xCoAlO4oxides were prepared from the metal nitrates by sol-gel method and then calcination with citric acid as complexing agent. K-modified catalysts were prepared by the impregnation of the composite oxides with K2CO3solution. All the catalysts were characterized by means of nitrogen physisorption(BET),XRD and H2-TPR, and used in the catalytic decomposition of N2O. The effects of catalyst composition and potassium loading on the catalytic activity were investigated. The results showed that the CuxCo1-xCoAlO4oxides exhibited spinel structure; after the continuous reaction at 550 ℃ for 600 min,the N2O conversions in oxygen over Cu0.1Co0.9CoAlO4and 0.03K/Cu0.1Co0.9CoAlO4(n(K)∶n(Cu+Co) 0.03) were 77.0% and 92.8%,while the N2O conversion over Cu0.1Co0.9CoAlO4and 0.03K/Cu0.1Co0.9CoAlO4in the presence of oxygensteam were 14.5% and 36.2%,respectively. The 0.03K/Cu0.1Co0.9CoAlO4catalyst revealed better activity and stability in the decomposition of N2O than Cu0.1Co0.9CoAlO4.
composite copper-cobalt-aluminium oxide catalyst;potassium modified catalysts;nitrous oxide decomposition;sol-gel method
1000 - 8144(2015)02 - 0235 - 06
TQ 031.3
A
2014 - 08 - 08;[修改稿日期] 2014 - 10 - 30。
张海杰(1987—),女,山东省潍坊市人,硕士生。联系人:徐秀峰,电话 0535 - 6902746,电邮 xxf@ytu.edu.cn。
山东省科技发展计划项目(2012GSF11708)。
