液-液相转移催化合成二苯乙烯类化合物的动力学研究
2015-06-06李金波
李金波,向 双
(1. 佛山市顺德区德美瓦克有机硅有限公司,广东 佛山 528303;2. 丽珠医药集团股份有限公司,广东 珠海 519015)
液-液相转移催化合成二苯乙烯类化合物的动力学研究
李金波1,向 双2
(1. 佛山市顺德区德美瓦克有机硅有限公司,广东 佛山 528303;2. 丽珠医药集团股份有限公司,广东 珠海 519015)
以季铵盐为催化剂,采用液-液相转移催化法,进行弱酸性的苄基二乙基膦酸酯与芳香醛反应生成二苯乙烯类化合物的动力学实验。在对反应机理分析的基础上建立动力学模型。考察了搅拌转速、催化剂种类与用量、反应温度、芳香醛种类和盐类对准一级反应速率常数的影响。实验结果表明,在液-液相转移催化体系中,苄基二乙基膦酸酯与芳香醛的反应历程为萃取机理,合成二苯乙烯和4-甲氧基二苯乙烯的活化能分别为24.27 kJ/mol和26.65 kJ/mol;亲油性强的季铵盐催化活性高;含吸电子基的芳香醛反应活性高,但易发生副反应,产物收率低;盐的阴离子影响离子交换和离子对的传质,加入适量的NaCl可以促进第三相的形成,提高反应速率。
液-液相转移催化;Wittig-Horner反应;萃取机理;二苯乙烯化合物;动力学
二苯乙烯具有荧光量子效率高、稳定性强、生物毒性小的特点,广泛应用于纺织[1]、造纸、洗涤剂[2]、电子器件制造[3]、非线性光学元件制造[4]、药物生产以及光生物学[5]等许多领域。在工业上合成二苯乙烯衍生物常用的有效方法为均相Wittig-Horner反应,该反应需二甲基甲酰胺、二甲基亚砜等非质子极性溶剂以及危险碱剂醇钠、氨基钠或氢化钠,存在成本高、操作困难等缺陷[6]。合成烯烃结构的其他方法有Heck反应[7]、Siegrist反应[8]、Knoevnagel反应[9]、苄基卤的偶联反应[10]、二苯乙炔衍生物加氢反应[11]等,这些反应存在催化剂昂贵、操作复杂或产物收率低的缺点,使其工业化生产受到限制。
相转移催化反应具有反应速率快、合成操作简便、反应条件温和、产品收率高等优点,且可用NaOH水溶液代替常规方法所需的金属钠、醇钠、氨基钠、氢化钠等危险试剂[12]。1974年,Piechucki[13]在Wittig-Horner反应中应用相转移催化剂合成烯烃。随后人们在相转移催化中以Ba(OH)2、K2CO3、Cs2CO3、KF或NaOH为碱剂,用强酸性(pKa<16)或中强酸性(16<pKa<23)磷酸酯与各种醛反应生成α,β-不饱和化合物,然而对用弱酸性(23<pKa<38或pKa>38)磷酸酯的相转移催化Wittig-Horner反应的研究较少[14-19]。
最近,Popa等[20]在相转移催化中用弱酸性磷酸酯合成了聚砜类高分子化合物,这些反应存在收率较低、催化剂毒性大等问题。目前关于相转移催化Wittig-Horner反应合成二苯乙烯类化合物反应动力学的研究鲜有报道。
本工作在液-液相转移催化体系中用弱酸性的苄基二乙基膦酸酯(pKa=27.55)与芳香醛反应合成二苯乙烯类化合物,考察各种因素对液-液相转移催化Wittig-Horner反应合成二苯乙烯类化合物反应速率的影响,研究了该反应的机理,得到了反应动力学模型,为二苯乙烯类化合物生产工艺的优化和规模放大提供理论依据。
1 实验部分
1.1 试剂
苄基二乙基膦酸酯:参考文献[21]报道的方法,自制;NaOH、苯甲醛、4-甲基苯甲醛、4-甲氧基苯甲醛、2-氯苯甲醛、3-硝基苯甲醛、2,4-二氯苯甲醛、甲苯、四乙基溴化铵(TEAB)、四丙基溴化铵(TPAB)、四丁基溴化铵(TBAB)、苄基三乙基溴化铵(BTEAB)、三辛基甲基溴化铵(MTOAB)、四辛基溴化铵(TOAB)、十二烷基三甲基溴化铵(DTMAB)、十六烷基三甲基溴化铵(HTMAB):AR,国药集团化学试剂有限公司。
1.2 实验方法
在装有温度计、机械搅拌器和回流冷凝管的100 mL四口烧瓶中加入10 g NaOH固体和10 g去离子水,在一定转速下搅拌约20 min,使烧瓶内水相温度稳定至(45±0.2) ℃。于50 mL烧杯中依次称取0.2 mmol 相转移催化剂、2 mmol芳香醛、20 mmol苄基二乙基膦酸酯和15 mL甲苯,加热至45℃,然后加入到四口烧瓶中,开始反应并计时。
在反应过程中定时取样约0.05 mL至试管中,迅速加入0.2 mL 含量为10%(φ)HCl溶液淬灭反应,再用50%(φ)乙腈水溶液稀释至10 mL,采用美国安捷伦科技公司Agilent 1200型高效液相色谱仪分析二苯乙烯类化合物和甲苯的含量。
合成二苯乙烯类化合物的反应式如下。
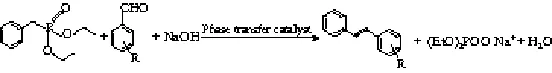
1.3 表征方法
采用高效液相色谱仪分析产物的纯度和E/Z值。分析条件:反式C18色谱柱(4.6 mm×150 mm,5 µm),流动相体积比V(乙腈)∶V(水相)=57.5∶42.5,其中,水相体积比V(高纯水) ∶V(甲醇)∶V(四氢呋喃)=92∶5∶3,流量1 mL/min,紫外检测器波长260 nm,柱温30 ℃,进样量20 µL。
2 结果与讨论
2.1 反应机理和动力学模型
通常反应物的pKa不同,由OH-引发的相转移催化反应的机理有差异,例如在两相界面上OH-能脱去中强酸性(16<pKa<23)反应物的质子,反应过程与界面机理一致;对于弱酸性(23<pKa<38)反应物,OH-需要被萃取到有机相中才能消去反应物的质子,反应历程为萃取机理[22]。弱酸性的苄基二乙基膦酸酯(pKa=27.55)的液-液相转移催化反应历程符合以下机理。
当催化剂的亲油性较弱时,反应机理为Starks萃取机理(见图1)。
催化剂阳离子Q+在水相和有机相中的分配相差不悬殊,活性离子对Q+OH-在水相中产生,然后转移至有机相;有机相中OH-离子几乎处于”裸露”状态,具有较强的碱性,OH-迅速脱去苄基二乙基膦酸酯中苄基上的氢,生成碳负离子,进而与芳香醛发生亲核加成反应,生成二苯乙烯类化合物;副产物离子对 (EtO)2POO-Q+扩散进入水相,与NaOH发生离子交换反应生成Q+OH-,形成相转移催化反应的循环过程,同时水相中副产物(EtO)2POO-Na+的浓度不断增大。

图1 催化剂亲油性较弱时反应机理为Starks萃取机理Fig.1 Starks extraction mechanism with a weakly organophilic catalyst.
当催化剂的亲油性较强时,反应机理为 Starks-Brändström-Montanari萃取机理(见图2)。
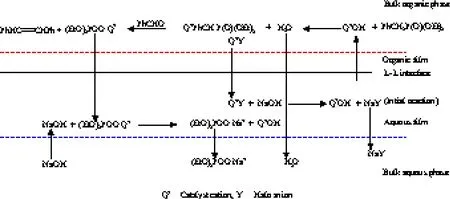
图2 催化剂亲油性较强时反应机理为Starks-Brändström-Montanari萃取机理Fig.2 Starks-Brändström-Montanari extraction mechanism with a strongly organophilic catalyst.
催化剂阳离子Q+在水相的溶解度较小,活性离子对Q+OH-在水相和有机相的界面区域上产生,OH-被萃取到有机相中,完成后续的循环过程。
整个相转移催化反应过程可分为以下4步:离子对在两相之间传质、离子交换、苄基二乙基膦酸酯脱氢以及亲核加成反应。
1) Q+Y-,Q+OH-,(EtO)2POO-Q+在水相和有机相之间的传质:
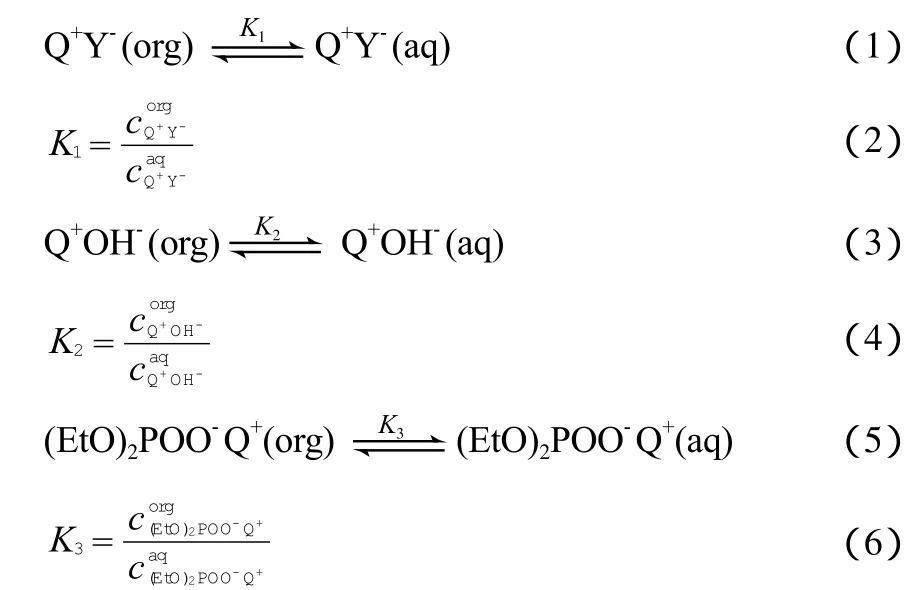
2) 在水相或液-液界面区域,Q+Y-和(EtO)2·POO-Q+分别与NaOH发生离子交换反应形成Q+OH-:

3) 在有机相中Q+OH-与苄基二乙基膦酸酯生成Q+PhCH-P(O)(OEt)2:

4) 在有机相中Q+PhCH-P(O)(OEt)2与PhCHO发生本征反应而生成二苯乙烯化合物:
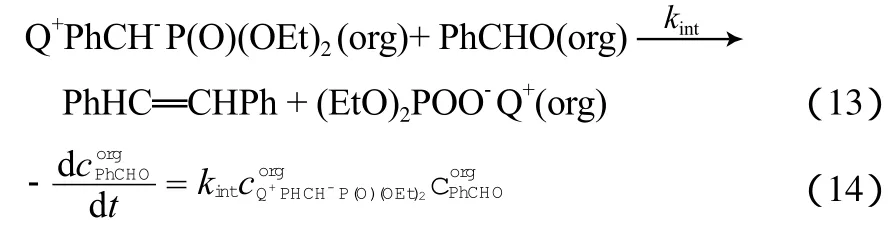
当搅拌转速超过某一值后,离子对的传质达到平衡,催化剂阳离子Q+在两相中分配平衡,可得式(15) ~(16)。
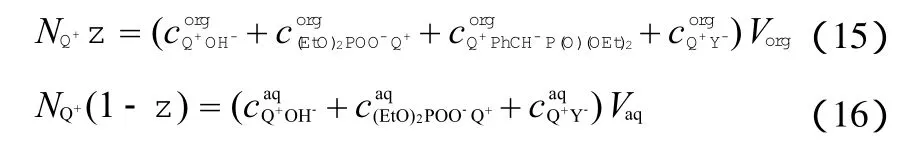
由式(4)、式(8)、式(10)、式(12)和式(16)可得出:
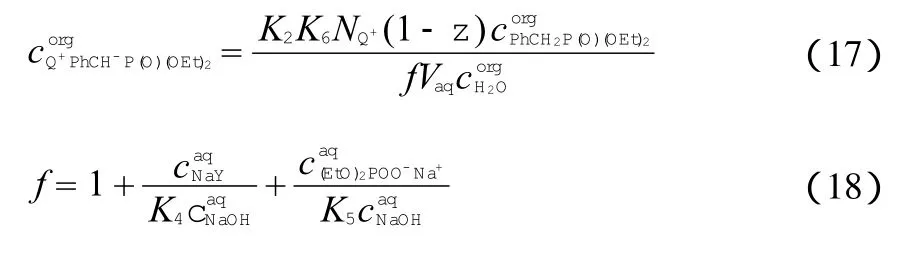
由式(14)和式(17)可得到液-液相转移催化Wittig-Horner反应合成二苯乙烯类化合物的动力学模型:
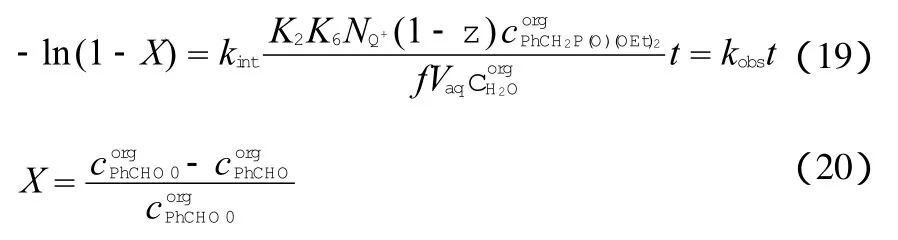
实验中苄基二乙基膦酸酯和NaOH的浓度几乎保持恒定,根据以-ln(1-X)为纵坐标、时间t为横坐标的动力学图形中直线的斜率,可以得到准一级反应速率常数kobs,再应用Arrehenius方程估算出反应活化能。
2.2 搅拌转速的影响
在相转移催化反应系统中,有机相与水相之间的传质是影响反应速率的重要因素。从反应动力学来看,搅拌转速的改变会影响离子对的传质速率和两相界面区域的大小,进而影响反应速率。
搅拌转速对kobs的影响见图3。由图3可见,当搅拌转速从200 r/min提高到800 r/min时,kobs大幅增加,原因可能是随搅拌转速的增大,有机相与水相间界面区域增大,离子对的传质速率也增加,则反应速率加快;当搅拌转速超过1 000 r/min后,反应速率增幅很小,几乎保持稳定,可能由于两相界面传质达到饱和,活性离子对Q+OH-的传质系数达到最大值。因此,可以认为在搅拌转速为1 200 r/ min下进行反应可消除界面传质阻力对反应速率的影响。
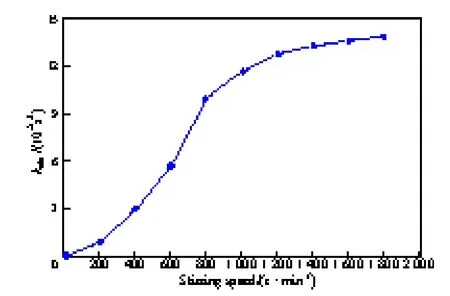
图3 搅拌转速对kobs的影响Fig.3 Effect of stirring speed on the pseudo-first-order rate constant(kobs). Reaction conditions:BA 2 mmol,DB 20 mmol,TBAB 0.2 mmol,toluene 15 mL,50%(w)NaOH 20 g,318.15 K.BA:benzaldehyde;DB:diethyl benzyl phosphonate;TBAB:tetrabutyl ammonium bromide.
2.3 催化剂种类和用量的影响
采用TEAB,TPAB,BTFAB,DTMAB,HTMAB,TBAB,MTOAB,TOAB等8种季铵盐为相转催化剂,考察对合成二苯乙烯类化合物反应的影响。
不同相转移催化剂对kobs的影响见表1。由表1可知,催化剂的活性高低的顺序为:TOAB>MTOAB>TBAB>HTMAB>DTMAB>BTEAB>TPAB>TEAB。随季铵盐碳原子数的增加,催化剂的油水分配系数lgP增大,kobs增大;可及性参数q对kobs的影响不大。碳原子总数多的季铵盐亲油性强,提高了对OH-的萃取量,有机相中OH-的浓度增大,促使苄基二乙基膦酸酯α-碳原子上的质子被脱去而生成亲核性的碳负离子,增大反应速率;亲油性强的季铵盐在水中的溶解度不大,Q+OH-主要在两相的界面区域产生,反应历程为Starks-Brändström-Montanari萃取机理。碳原子总数适量的季铵盐的亲油性适中,Q+OH-在两相中发生萃取转移,反应历程为Starks萃取机理。
阳离子TOA+和MTOA+的体积大,分别与OH-形成的离子对稳定性差,容易释放出OH-而恢复催化能力,故其催化活性比小体积阳离子的催化活性高。尽管HTMA+的油水分配系数比值大于TBA+,但催化活性高低的顺序为:TBA+>HTMA+,可能由于TBA+对称性好,正电荷被屏蔽得严密。
表1中拟合方程的截距均为负数,表明实验中开始计时后的一段时间内,相转移催化反应体系中未发现有产物生成,说明季铵盐阳离子萃取OH-到有机相中需要一段时间,使产物的生成延迟,从而佐证L-L PTC Wittig-Horner反应历程为萃取机理。
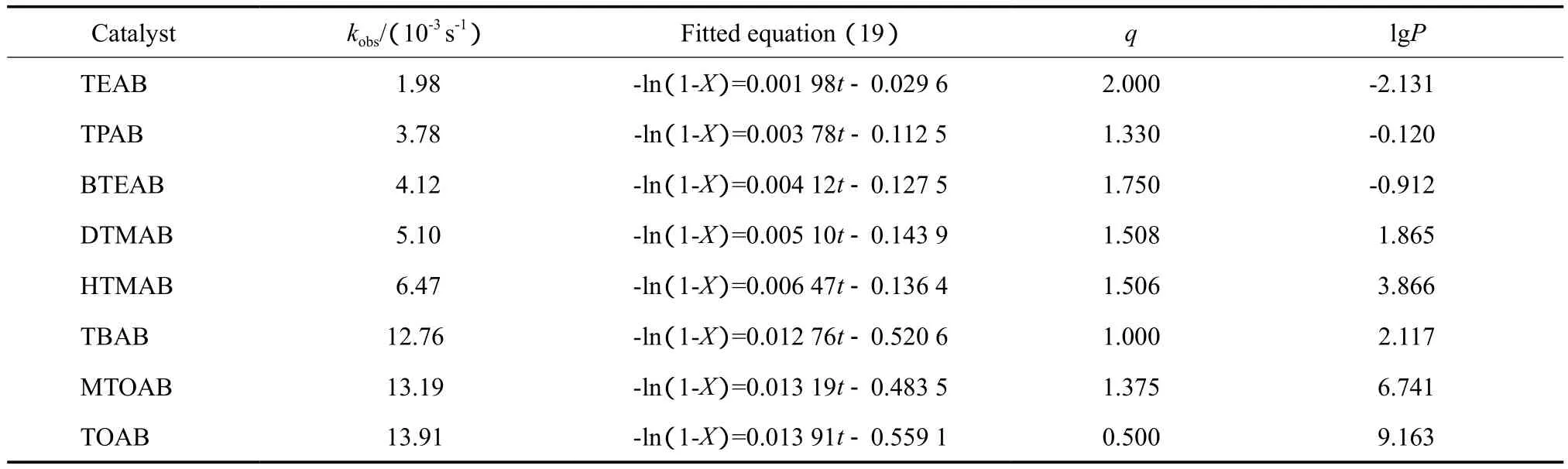
表1 不同相转移催化剂对kobs的影响Table 1 Effects of different phase-transfer catalysts on kobs
TBAB用量对kobs的影响见图4。由图4可知,当反应体系中不加催化剂时,kobs仅为1.2×10-3s-1,由于在油水界面区域OH-只能与少量的苄基二乙基膦酸酯反应产生碳负离子;当加入0.04 mmol TBAB时,反应速率大幅加快,且随TBAB用量的增加,kobs增大,原因是TBAB用量增加,Q+OH-的量增加,反应加快。同时TBAB可降低两相之间的界面张力,增加界面区域,减少传质阻力,促进反应的进行。

图4 TBAB用量对kobs的影响Fig.4 Effect of TBAB dosage on kobs.Reaction conditions:BA 2 mmol,DB 20 mmol,toluene 15 mL,50%(w) NaOH 20 g,318.15 K,1 200 r/min.
2.4 温度的影响
反应温度对kobs的影响见图5。由图5可知,随反应温度的升高,kobs增大。升高反应温度有助于提高离子对的传质速率,反应物之间的有效碰撞增加,使反应速率变快。

图5 反应温度对kobs的影响Fig.5 Effects of reaction temperature(T) on kobs.Reaction conditions:aldehydes 2 mmol,DB 20 mmol,TBAB 0.2 mmol,toluene 15 mL,50%(w) NaOH 20 g,1 200 r/min.Benzaldehyde;4-Methoxybenzaldehyde
lnkobs~ 1/T图见图6。
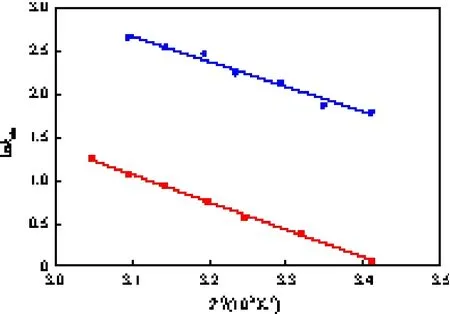
图6 lnkobs~1/T图Fig.6 Arrhenius plots of kobsvs 1/T.Benzaldehyde;4-Methoxybenzaldehyde
由图6可知,根据Arrehenius方程可以估算出液-液相转移催化Wittig-Horner反应合成二苯乙烯或4-甲氧基二苯乙烯的活化能分别为24.27 kJ/mol 和26.65 kJ/mol,指数前因子分别约为1.24×105和6.02×104。而常规均相Wittig-Horner反应合成二苯乙烯或4-甲氧基二苯乙烯的活化能分别为51.16 kJ/ mol和65.82 kJ/mol[23], 说明相转移催化剂大幅降低了反应所需的活化能,使反应更易进行。较低的活化能表明液-液相转移催化Wittig-Horner反应历程为萃取机理。
2.5 芳香醛种类的影响
Wittig-Horner 反应为亲核加成反应,芳香醛苯环上取代基的供/吸电子效应对反应产生影响。
芳香醛的种类对kobs的影响见表2。
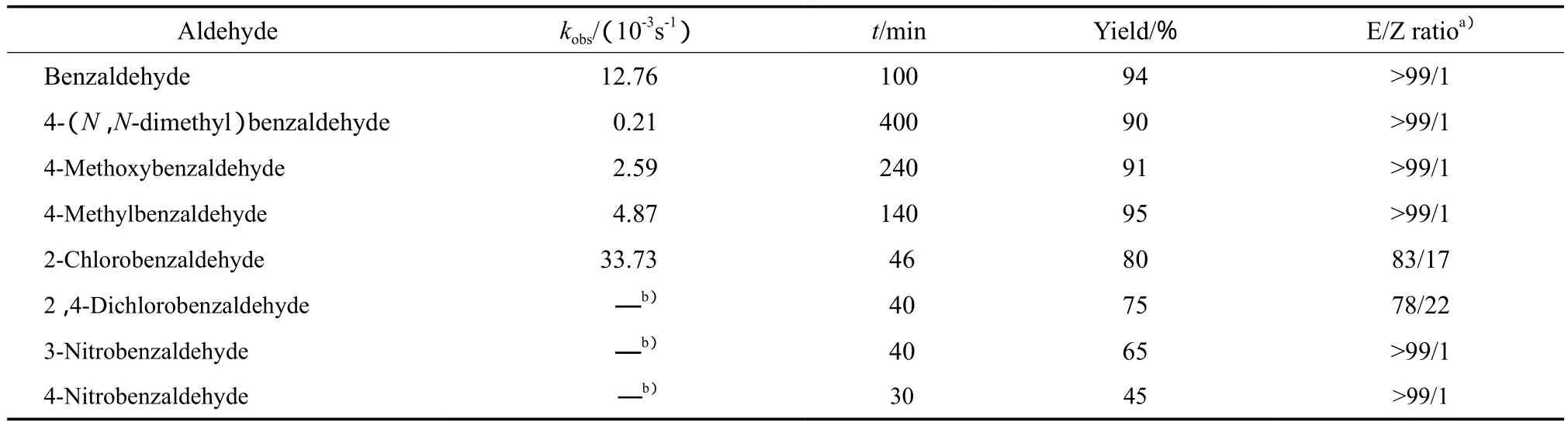
表2 芳香醛的种类对kobs的影响Table 2 Effects of aromatic aldehydes on kobs
由表2可知,kobs的大小顺序为:2-氯苯甲醛>苯甲醛>4-甲基苯甲醛>4-甲氧基苯甲醛>4-(N,N-二甲基)苯甲醛,这与芳香醛苯环上取代基的供电子能力强弱顺序相反。由于电子诱导和共轭效应,苯环上吸电子基团降低醛羰基中碳原子的电子云密度,增加碳原子的正电性,有助于亲核试剂苄基二乙基膦酸酯碳负离子的进攻,使反应速率加速;供电子基减弱碳正电性而使反应变慢。
但萃取到有机相中的OH-几乎是“裸露的”,则强碱性的OH-与含吸电子基的芳香醛易发生Canizzaro歧化反应,生成副产物醇和酸,导致二苯乙烯化合物的收率下降。含供电子基或硝基的芳香醛所生成的产物几乎全为E式构象,邻位卤素效应[24]使2-氯苯甲醛和2, 4-二氯苯甲醛的Z式构象产物组分增加。
2.6 盐种类的影响
在相转移催化体系中加入盐,可以调节季铵盐在有机相和水相的萃取平衡,促进盐析效应;也可以干燥有机相,减少Q+OH-被水化的程度,增强OH-的碱性。
盐的种类对kobs的影响见图7。由图7可知,随NaCl或(EtO)2POONa用量的增加,kobs先降低,再增大,最后降低;kobs随NaBr用量的增加而不断下降;当加入微量的NaI时,kobs迅速降至1.2×10-3s-1,与反应体系中无催化剂时的kobs相同,且当NaI的用量继续增加时,kobs几乎保持不变。
不同的盐对kobs的影响有以下几点:
1) 阴离子的选择性萃取常数大小次序为:I->Br->Cl->(EtO)2POO->OH-,卤离子以及(EtO)2POO-比OH-优先同Q+形成离子对[25-26],其中,I-与Q+结合得最紧密,催化剂“中毒”,反应速率急剧降低;Br-,Cl-,(EtO)2POO-分别与Q+结合的紧密程度比I-低,所以反应速率降低幅度也比I-小。
2) 向相转移催化体系中加入适量的盐,盐析效应使催化剂和反应物聚集,形成第三相, 液-液相转移催化反应体系变为液-液-液三相转移催化反应体系[27],反应速率达到最大。但加入(EtO)2POONa时kobs的峰值比加入NaCl时小,这是由于(EtO)2POONa是有机相本征反应的副产物,抑制本征反应向正反应方向进行。
3) TBAB与NaOH发生离子交换反应生成活性离子对TBA+OH-,同时还有副产物NaBr,故向相转移催化体系中加入NaBr会抑制TBA+OH-的生成,则反应速率随NaBr用量的增加而降低;当加入过多的(EtO)2POONa时会抑制有机相的本征反应,反应速率变慢。
以上分析表明,盐的阴离子影响离子交换反应和离子对的传质,进而影响反应速率。
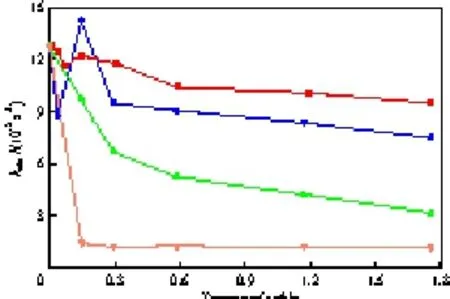
图7 盐的种类对kobs的影响Fig.7 Effects of salts on kobs.Reaction conditions:BA 2 mmol,DB 20 mmol,TBAB 0.2 mmol,toluene 15 mL,50%(w)NaOH 20 g,318.15 K,1 200 r/min.NaCl;(EtO)2POONa;NaBr ;NaI
3 结论
1)液-液相转移催化Wittig-Horner反应合成二苯乙烯类化合物的机理为萃取机理,建立了合成二苯乙烯类化合物的动力学模型,液-液相转移催化Wittig-Horner反应合成二苯乙烯与4-甲氧基二苯乙烯的活化能分别为24.27 kJ/mol和26.65 kJ/mol。
2)提高离子对在有机相与水相之间的传质速率有利于提高反应速率。强化搅拌和升高反应温度促进离子对的传质,进而加快反应。
3)催化剂的活性高低的顺序为:TOAB>MTOAB>TBAB>HTMAB>DTMAB>BTEAB>TPAB>TEAB,催化剂阳离子的亲油性越强,对OH-的萃取量越大,反应速率越快;催化剂用量越多,反应越快。
4)醛类反应物的kobs大小顺序为:2-氯苯甲醛>苯甲醛>4-甲基苯甲醛>4-甲氧基苯甲醛>4-(N,N-二甲基)苯甲醛,苯环上吸电子基团增加了醛羰基中碳原子的正电性,有助于亲核试剂的进攻。
5)盐影响离子交换和离子对的传质,适量的NaCl可促进第三相的形成,将液-液相转移催化反应体系变为液-液-液三相转移催化反应体系,提高反应速率。
符 号 说 明
c 浓度,mol/L
c0初始浓度,mol/L
Ki反应平衡常数,i=1,2,…,6
kint本征反应速率常数,s-1
kobs准一级反应速率常数,s-1
lgP 油水分配系数
q 可及性参数
T 温度,K
t 时间,s
V 体积,mL
X 苯甲醛的转化率,%
φ 有机相中Q+与催化剂总量的质量比
上角标
aq 水相
org 有机相
[1] 何瑾馨. 染料化学[M]. 北京:中国纺织出版社,2004:213 -218.
[2] Leaver I H,Milligan B. Fluorescent Whitening Agents-A Survey[J]. Dyes Pigm,1984,5(2):109 - 144.
[3] Yan Ziqi,Xu Bin,Dong Yujie,et al. The Photophysical Properties and Two-Photon Absorption of Novel Triphenylamine-Based Dendrimers[J]. Dyes Pigm,2011,90(3):269 - 274.
[4] Choi K S,Jo H,Park K,et al. Effects of Functional Groups in Unsymmetrical Distyrylbiphenyl on the Performances of Blue Organic Light Emitting Diodes[J]. J Phys Chem C,2011,115(19):9767 - 9771.
[5] Ahluwalia A,Giusto G,Chen O,et al. A Fluorescent-Photochrome Method for the Quantitative Characterization of Solid Phase Antibody Orientation[J]. Anal Biochem,2002,305 (2):121 - 134.
[6] 汪秋安. 物理有机化学[M]. 长沙:湖南大学出版社, 2010:273 - 274.
[7] Inoue A,Shinokubo H,Oshima K. Oxidative Heck-Type Reaction Involving Cleavage of a Carbon-Phosphorus Bond of Arylphosphonic Acids[J]. J Am Chem Soc,2003,125(6):1484 - 1485.
[8] Imad A. Synthesis of Biphenols Containing Anhydride,Imido or Dicyano Arylene Moieties[J]. Synth Commun,1999,29 (17):2915 - 2922.
[9] Stalmach U,Detert H. Synthesis and Electronics Spectra of Substituted p-Distyrylbenzenes for the Use in Light-Emitting Diodes[J]. J Prakt Chem,2000,342(1):10 - 16.
[10] Nockemann P,Binnemans K,Driesen K. Purification of Imidazolium Ionic Liquids for Spectroscopic Applications[J]. Chem Phys Lett,2005,415(1/3):131 - 136.
[11] Bance S,Barber H J,Woolman A M. Bromination of Diphenylalkanes and the Preparation of Some Stilbene Derivatives:Part 1. α,β-Diphenylethane[J]. J Chem Soc,1943:1 - 4.
[12] Starks C M,Liotta C L,Halpern M. Phase-Transfer Catalysis: Fundamentals,Applications and Industrial Perspectives [M]. New York:Chapman & Hall,1994:1 - 22.
[13] Piechucki C. Wittig-Horner Synthesis in An Aqueous Two-Phase System Using Phase-Transfer Catalysis[J]. Synthesis,1974(12):869 - 870.
[14] Alvarez-Ibarra C,Arias S,Banon G. An Efficient and Stereoselective Wittig-Horner Synthesis of Acyclic α-Enones with Barium Hydroxide as Solid Catalyst[J]. Chem Soc Chem Commun,1987 (19):1509 - 1511.
[15] Arai S,Hamaguchi S,Shioiri T. Catalytic Assimetric Horner-Wadsworth-Emmons Reaction under Phase Transfer Catalysis Conditions[J]. Tetrahedron Lett,1998,39(19):2997 -3000.
[16] Mikolajczyk M,Grzejszczak S,Midura W,et al. Synthesis of α,β-Unsaturated Sulphides,Sulphoxides,and Sulphones by Horner-Wittig Reaction in Two Phase System Catalysed by Quaternary Ammonium Salts and Crown Ethers[J]. Synthesis,1975(4):278 - 280.
[17] Villieras J,Rambaud M. Wittig-Horner Reactions in Heterogenous Media;A Convenient Synthesis of α,β-Unsaturated Esters and Ketones Using Weak Bases in Water[J]. Synthesis,1983(4):300 - 303.
[18] Loreto M A,Pompili C,Tardella P. α-Methylene β-Amino Phosphonic Ester Derivatives by Amination of (1-Trimethylsilanylmethyl-Vinyl) Phosphonic Esters[J]. Tetrahedron Lett,2001,57(20):4423 - 4427.
[19] Pascariu A,Ilia G,Bora A,et al. Wittig and Wittig-Horner Reactions under Phase Transfer Catalysis Conditions [J]. Cent Eur J Chem,2003,1(4):491 - 534.
[20] Popa A,Avram E,Lisa G,et al. Crosslinked Polysulfone Obtained by Wittig-Horner Reaction in Biphase System[J]. Polym Eng Sci,2012,52(2):352 - 359.
[21] Winter A,Friebe C,Hager M D,et al. Synthesis of Rigid π-Conjugated Mono-,Bis-,Tris- and Tetrakis(Terpyridine)s:Influence of the Degree and Pattern of Substitution on the Photophysical Properties[J]. Eur J Org Chem,2009(6):801 - 809.
[22] Rabinovitz M,Cohen Y,Halpern M. Hydroxide Ion Initiated Reactions Under Phase Transfer Catalysis Conditions:Mechanism and Implications[J]. Angew Chem Int Ed Engl,1986,25 (11):960 - 970.
[23] Li Zhengkai,He Chun,Yang Meng,et al. Kinetics Studies on the Reaction Between Substituted Benzyl Phosphonates and Substituted Benzaldehydes[J]. Arkivoc,2005(1):98 - 104.
[24] Dunne E C,Coyne E J,Crowley P B,et al. Co-Operative Ortho-Effects on the Wittig Reaction. Interpretation of Stereoselectivity in the Reaction of Ortho-Halo-Substituted Benzaldehydes and Benzylidenetriphenylphosphoranes[J]. Tetrahedron Lett,2002,43(13):2449 - 2453.
[25] Landini D,Maia A,Rampoldi R. Stability of Quaternary Onium Salts Under Phase-Transfer Conditions in the Presence of Aqueous Alkaline Solutions[J]. J Org Chem,1986,51 (16):3187 - 3191.
[26] Wu Ho-Shing,Fang Tsung-Ran,Meng Shang-Shin,et al. Equilibrium and Extraction of Quaternary Salt in an Organic Solvent/Alkaline Solution: Effect of NaOH Concentration[J]. J Mol Catal A:Chem,1998,136(2):135 - 146.
[27] Yang Hung-Ming,Li Ching-Ching. Kinetics for Synthesizing Salicylate by Third-Liquid Phase-Transfer Catalysis[J]. J Mol Catal A:Chem,2006,246(1/2):255 - 262.
(编辑 李治泉)
Kinetics for Synthesizing Diphenylethene Compounds by Liquid-Liquid Phase-Transfer Catalysis
Li Jinbo1,Xiang Shuang2
(1. Wacker Dymatic Silicones(Shunde)Co. Ltd.,Foshan Guangdong 528303,China;2. Livzon Medical Group Co. Ltd.,Zhuhai Guangdong 519015,China)
The kinetics for the synthesis of diphenylethene compounds from weakly acidic diethyl benzylphosphonate and aromatic aldehydes with quaternary ammonium salts as phase-transfer catalysts and sodium hydroxide as a base was studied. The effects of stirring speed,catalysts,temperature,aromatic aldehydes and salts on the pseudo-first-order reaction rate constant were investigated. A reasonable extraction mechanism was proposed based on the results obtained. The activation energies of synthesizing diphenylethene and 4-methoxy-diphenylethene with the tetrabutyl ammonium bromide(TBAB) as catalyst are 24.27 kJ/mol and 26.65 kJ/mol,respectively. The strongly organophilic catalysts possess high activity. Aromatic aldehydes containing electron-withdrawing groups had higher reactivity than those containing electron-donating groups,but side reactions which occurred more easily resulted in lower yield. The addition of a suitable amount of NaCl could promote the formation of a third-liquid phase and improve the reaction rate.
liquid-liquid phase-transfer catalysis;Wittig-Horner reaction;extraction mechanism;diphenylethene compound;kinetics
1000 - 8144 (2015)02 - 0198 - 08
TQ 013.2
A
2014 - 08 - 06;[修改稿日期] 2014 - 12 - 10。
李金波(1986—),男,湖北省监利市人,硕士,电话 0757 - 23277916,电邮 hibob1987@sina. cn。
