外源性H2O2对大鼠纯化视网膜神经节细胞存活及轴突生长的影响
2015-06-05杨万举
钟 杰, 贾 君, 杨万举
外源性H2O2对大鼠纯化视网膜神经节细胞存活及轴突生长的影响
钟 杰, 贾 君, 杨万举
武汉市中心医院眼科,武汉 430014
目的 研究外源性H2O2对视网膜神经节细胞(retinal ganglion cells,RGCs)存活和轴突生长状况的影响及其与神经微丝蛋白NF-H表达变化的关系,探讨H2O2的氧化应激引起RGCs损伤的机制。方法 纯化培养SD乳鼠RGCs,应用不同浓度H2O2(250、500μmol/L)分别作用4、8、24、32h后测定存活、有突起的视网膜神经节细胞数及其最长突起长度。采用免疫组织化学染色加图像分析系统检测H2O2对RGCs表达神经微丝蛋白NF-H的影响。结果 纯化培养的SD大鼠RGCs纯度可达96.24%。H2O2以浓度和时间依赖的方式影响纯化培养的RGCs存活数,500μmol/L的H2O2在32h可以导致RGCs存活数下降约50%。同时,500μmol/L H2O2孵育后RGCs细胞轴突长度与对照组比较明显减短,差异有统计学意义(P<0.01),且减短程度随时间延长而增大;NF-H表达差异也有统计学意义(P<0.01),且NF-H在RGCs中分布紊乱。结论 H2O2的氧化应激损伤能够以时间和浓度依赖的方式影响纯化培养的RGCs存活,可影响RGCs轴突生长,这可能与其下调RGCs中神经微丝蛋白的表达有关。
视网膜神经节细胞; 外源性过氧化氢; 细胞存活; 轴突; 神经微丝蛋白
目前关于青光眼视神经损害的发病机制有很多学说,其中氧化应激反应损伤在青光眼的发生发展中发挥了重要的作用[1-2]。视网膜神经节细胞(retinal ganglion cells,RGCs)的死亡和神经纤维的丢失是青光眼的特征性病理改变,但其发生机制尚不完全清楚[3]。神经微丝蛋白-H(neurofilament proteins,NF-H)是神经节细胞轴突的标志性蛋白,参与神经细胞轴突生长过程,起到维持轴突直径的作用[45]。因此,氧化应激反应对RGCs的影响可能与调节NF-H的表达有关。我们以不同浓度的外源性H2O2作用于RGCs,检测经体外纯化培养的RGCs存活数和轴突生长状况,观察NF-H表达水平的变化趋势,进一步探讨青光眼的发生机制。
1 材料与方法
1.1 RGCs纯化培养和鉴定
1.1.1 取材 由华中科技大学同济医学院实验动物学部提供20只生后1~3d的清洁级SD乳鼠,处死后取出眼球,解剖显微镜下钝性分离视网膜组织并剪碎。加0.125%胰蛋白酶(含0.1g/L的DNA酶,美国Sigma公司),在37℃下消化10~15min。加含20%胎牛血清(杭州四季青公司)的DMEM/F12(美国Hyclone公司)培养液终止消化,离心半径8cm,900r/min离心8min,弃上清液,加完全培养液,制成单细胞悬液,接种至直径100mm的细胞培养皿内。
1.1.2 三步法纯化 取第1培养皿,预先以1∶100羊抗鼠IgG抗体室温包被,24h后用不含血清的DMEM/F12培养液漂洗3次;用1∶100小鼠抗大鼠Thyl.1OX-7单克隆抗体(美国Chemicon公司)室温下包被,24h后再以不含血清的DMEM/F12培养液漂洗3次,在包被好的培养皿内加入视网膜单细胞悬液及DMEM/F12培养液,37℃条件下培养30min,使RGCs与Thyl.1单克隆抗体充分结合;用0.125%胰蛋白酶消化后,完全培养液终止消化,离心半径8cm,900r/min离心5min。培养液重悬,细胞以4×107/L的终浓度接种入第2培养皿(预铺多聚赖氨酸,美国Sigma公司的清洁盖玻片),培养12h后加入终浓度为10μmol/L的阿糖胞苷(以抑制星型胶质细胞和非神经细胞的生长),即为纯化的RGCs。纯化后培养:培养24h的纯化RGCs的盖玻片移入第3培养皿(含单层第2代星型胶质细胞培养液),48h换液1次,换半量培养液。
1.1.3 细胞鉴定 纯化培养12h的RGCs用Thyl.1单克隆抗体免疫荧光细胞染色,检测其细胞纯度。荧光显微镜下观察Thyl.1单克隆抗体标记阳性的细胞与同一视野中的细胞总数之比为RGCs的纯度。视野的选取以培养板的盖玻片中央为中心,分别在其上、下、左、右、中5个方向随机选取5个显微镜(200倍)扫描视野框(框面积0.27mm2),每次实验随机取2个孔计数,3次实验共30个视野。
1.2 检测H2O2对RGCs的影响
1.2.1 RGCs细胞分组 每次实验取材均用20只SD乳鼠的视网膜组织,一起消化纯化培养,按统一密度接种于培养板,使各组细胞密度一致。每次实验周期,将0、250、500μmol/L H2O2加入纯化培养的RGCs中作用4、8、24、32h。每个实验周期分为上述12组,每组9孔。总共重复3个周期,共计使用60只乳鼠。
1.2.2 RGCs存活数和轴突生长情况检测 每4h在倒置相差显微镜下观察细胞生长情况,记录RGCs存活数和存活时间。采用HMIAS-2000型全自动医学彩色图像分析系统计数每个视野中分散的、有轴突的、存活的RGCs及其最长轴突的长度(每个视野随机取5个细胞进行测量,共30个视野,150个轴突)。
1.2.3 NF-H免疫组织化学染色 利用小鼠抗大鼠抗NF-H 200单克隆抗体(武汉博士德生物技术有限公司),采用SABC法对RGCs的NF-H行免疫组织化学染色,采用HMIAS-2000型全自动医学彩色图像分析系统(武汉同济千屏影像工程公司),测定不同压力下RGCs中NF-H的表达水平,用吸光度(A)值表示。
1.3 统计学方法
采用SPSS 13.0统计学软件对实验数据进行分析,实验数据以表示,组间均数比较采用方差分析或t检验,所有实验均独立重复3次。
2 结果
2.1 纯化的RGCs纯度检测及鉴定
用抗大鼠Thyl.1单克隆抗体对纯化培养12h后的RGCs进行荧光免疫细胞化学检测。RGCs纯度为96.24%。多数细胞的胞膜及轴突均有明显的绿色荧光染色,细胞核区空染,细胞形态清晰。培养至第3天的细胞轴突较短,第7天细胞轴突较长,相互邻近细胞间的轴突发生连接。见图1。

图1 纯化培养第3天的RGCs Thy1.1免疫荧光细胞化学染色图像(×400)Fig.1 Immunofluorescent staining image of RGCs on the third day of culture(Thy1.1antibody,×400)
2.2 H2O2对RGCs存活数、轴突、NF-H表达水平的影响
2.2.1 H2O2的氧化应激反应对RGCs存活数的影响 分别应用不同浓度(250、500μmol/L)H2O2诱导RGCs细胞氧化应激损伤,并设立正常培养细胞为对照组,在不同时间(4、8、24、32h)测定细胞存活数。实验显示H2O2能够以时间和浓度依赖的方式减少RGCs的细胞数(图2)。500μmol/L H2O2孵育32h可以导致RGCs细胞为对照组的50%。

图2 不同浓度H2O2处理不同时间对RGCs细胞存活数的影响Fig.2 Effects of treatment with H2O2at different concentrations for different time on the survival of RGCs
2.2.2 H2O2的氧化应激反应对RGCs轴突的影响
纯化培养的RGCs在正常培养液中孵育8、24、32 h,未见轴突长度的明显变化;在含500μmol/L H2O2细胞培养液中孵育8、24、32h,24、32h组与8 h组比较差异有统计学意义(均P<0.05);不同时间与对照组比较,可见细胞轴突长度明显变短,差异均有统计学意义(均P<0.01)。见表1。
表1 各组培养的RGCs最长突起长度比较(μm,)Table 1 Comparison of the length of the longest process of RGCs in each group(μm,)

表1 各组培养的RGCs最长突起长度比较(μm,)Table 1 Comparison of the length of the longest process of RGCs in each group(μm,)
H2O2t值P值6.859 0.000 24h73.64±42.93 37.56±22.26 9.301 0.000.88 32h68.44±39.73 35.96±22.10 8.764 0.000 F值0.842 4.133 P值0.431 0.017
2.2.3 H2O2的氧化应激反应对RGCs中NF-H的影响 纯化培养的RGCs在正常培养液中孵育8、24、32h,未见NF-H的明显变化;在含500μmol/L H2O2细胞培养液中孵育8、24、32h,与对照组比较,可见NF-H表达明显减少,差异均有统计学意义(P<0.01)(表2)。对照组RGCs中NF-H免疫组化染色,DAB显色可见免疫阳性产物NF-H为棕褐色网状结构,NF-H丝状结构排列规则而均匀,细胞已具有成熟神经元特征,细胞形态规则,核大而圆,核膜、核仁清晰(图3)。500μmol/L H2O2作用32h组可见细胞形态极不规则,核周棕褐色阳性反应产物大量聚集,胞质内周边区域阳性反应染色变浅,NF-H在RGCs中分布紊乱(图4)。
表2 各组培养的RGCs中NF-H表达的比较(A值,)Table 2 Comparison of NF-H expression in RGCs in each group(Avalue,)

表2 各组培养的RGCs中NF-H表达的比较(A值,)Table 2 Comparison of NF-H expression in RGCs in each group(Avalue,)
孵育时间0μmol/L H2O2500μmol/L H2O2t值P值8h0.47±0.20 0.14±0.05 5.079 0.000 24h0.54±0.20 0.07±0.01 7.296 0.000 32h0.47±0.19 0.06±0.01 6.723 0.000 F值0.418 21.434 P值0.662 0.000
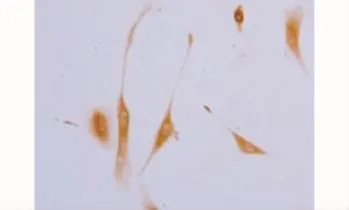
图3 对照组RGCs神经丝蛋白NF-H免疫组化染色Fig.3 Immunohistochemistry staining of NF-H in RGCs in control group

图4 500μmol/L H2O2作用32h组RGCs神经丝蛋白NF-H免疫组化染色Fig.4 Immunohistochemistry staining of NF-H in RGCs treated with 500μmol/L H2O2for 32h
3 讨论
在青光眼中,RGCs的死亡是青光眼视神经损伤的最终共同通路,目前关于导致RGCs凋亡的可能机制主要包括:神经营养因子剥夺、胶质细胞激活、谷氨酸兴奋毒性、缺血以及氧化应激损伤等[6-8]。其中氧化应激反应增强、活性氧产生增多在青光眼的发生发展中发挥了重要的作用[1-2]。在本研究中,以500μmmol/L的H2O2孵育32h后可以导致RGCs存活数下降约50%。
神经微丝蛋白NF是构成神经元胞体和神经轴突细胞骨架的主要成分,在维护神经元功能和轴浆转运等一系列与脊髓损伤修复相关的病理生理变化中发挥重要作用[9]。NF分别由相对分子质量为68 000(NF-L)、160 000(NF-M)及200 000(NF-H)的3种多肽亚单位组成。其中相对分子质量为200 000的NF-H仅存在于轴突中。已有研究表明脊髓损伤后NF-200即NF-H阳性神经细胞的数量及神经细胞着色程度与后肢功能的恢复情况有密切关系[10]。因此,NF-H是神经节细胞轴突的标志性蛋白,可以作为判断神经节细胞轴突生长的指标[11]。
在本研究中,我们采用体外纯化培养的RGCs,分别在不同浓度的外源性H2O2下作用不同时间,结果显示H2O2的氧化应激损伤能够以时间和浓度依赖的方式影响纯化培养的RGCs存活,可影响RGCs轴突生长,下调RGCs中神经微丝蛋白的表达。这提示氧化应激损伤可以直接影响RGCs的轴突生长,此种影响与其下调NF-H表达水平有关。
H2O2引起NF-H表达水平下调,与RGCs存活和轴突生长情况相关,研究表明磷酸化的NF-H在调节神经微丝的生长、运输、形态与功能上起关键作用,也与一些神经变性疾病发病机制相关[12]。正常情况下,NF-H在轴突中大部分是以磷酸化形式存在,在核周树突中多以去磷酸化形式存在[4]。本实验结果图3中对照组RGCs细胞形态规则,神经丝蛋白NF-H呈棕褐色网状结构,排列规则而均匀,主要分布于轴突中。而图4中500μmol/L H2O2作用32h组RGCs细胞形态极不规则,棕褐色阳性反应产物大量聚集于核周,胞质内周边区域,包括轴突中阳性反应染色变浅,NF-H在RGCs中分布变紊乱,表明氧化应激损伤打破了NF-H在神经节细胞中的结构布局,直接造成NFs合成能力下降和NF的磷酸化水平,其原因可能为:①造成轴膜Ca- ATPase活性改变和钙离子内流,细胞内钙离子的蓄积,从而激活大量蛋白水解酶,引起神经元内NFs等结构蛋白的水解;②调解NFs磷酸化和去磷酸化的磷酸酶和蛋白激酶动态平衡的改变。这些原因均可造成神经元中NFs的减少和异常分布,进而导致RGCs轴突运输的异常,影响轴突生长,使RGCs变性、萎缩,最终导致RGCs死亡。
综上所述,H2O2的氧化应激损伤可影响纯化培养的RGCs存活和轴突生长,这可能与其下调RGCs中NF的表达水平有关。由此可见,氧化应激反应损伤在青光眼的发生发展中发挥了重要的作用。
[1] Qu J,Wang D,Grosskreutz C L.Mechanisms of retinal ganglion cell injury and defense in glaucoma[J].Exp Eye Res,2010,91(1):48-53.
[2] Tezel G.The immune response in glaucoma:aperspective on the roles of oxidative stress[J].Exp Eye Res,2011,93(2): 178-186.
[3] Wein F B,Levin L A.Current understanding of neuroprotection in glaucoma[J].Curr Opin Ophthalmo1,2002,13(2):61-67.
[4] Gotow T.Neurofilaments in health and disease[J].Med Electron Microsc,2000,33(4):173-199.
[5] Uchida A,Brown A.Arrival,reversal,and departure of neurofilaments at the tips of growing axons[J].Mol Biol Cell,2004,15(9):4215-4225.
[6] Band L R,Hall C L,Richardson G,et al.Intracellular flow in optic nerve axons:a mechanism for cell death in glaucoma[J].Invest Ophthalmol Vis Sci,2009,50(8):3750-3758.
[7] Chrysostomou V,Rezania F,Trounce I A,et a1.Oxidative stress and mitochondrial dysfunction in glaucoma[J].Curt Opin Harmacol,2013,13(1):12-15.
[8] 李珂,贾君.重组人促红细胞生成素对谷氨酸诱导的视网膜神经细胞凋亡的影响[J].华中科技大学学报:医学版,2014,43(2):227-230.
[9] Uchida K,Baba H,Maezawa Y,et al.Progressive changes in neurofi lament proteins and growth-associated protein-43immunoreactivities at the site of cervical spinal cord compression in spinal hyperostotic mice[J].Spine,2002,27(5):480-486.
[10] Yabe J T,Wang F S,Chylinski T,et al.Selective accumulation of the high Molecular weight neurofilament subunit within the distal region of growing axonal neurites[J].Cell Motil Cytoskeleton,2001,50(1):1-12.
[11] Kamda T,Koda M,Dezawa M,et al.Transplantation of bone marrow stromal cell-derived Schwann cells promotes axonal regeneration and functional recovery after complete transaction of adult rat spinal cord[J].J Neuropathol Exp Neurol,2005,64(1):37-45.
[12] Shea T B,Flanagan L A.Kinesin,dynein and neurofilament transport[J].Trends Neurosci,2001,24(11):644-648.
(2014-12-24 收稿)
Effects of Exogenous H2O2on Survival and Axonal Growth of Rat Retinal Ganglion Cells
Zhong Jie,Jia Jun,Yang Wanju
Department of Ophthalmology,Wuhan Central Hospital,Wuhan 430014,China
ObjectiveTo examine the effects of exogenous H2O2on the survival and axonal growth of retinal ganglion cells(RGCs)and on the expression of neurofilament protein-H(NF-H)in order to explore the mechanism of RGCs damage caused by H2O2-induced oxidative stress Methods The number of viable RGCs with axon-like processes and the length of the longest process were measured in RGCs which were obtained from SD neonatal rats(n=20,postnatal 1-3days),purified,cultured and then treated with H2O2of 0,250and 500μmol/L respectively.The expression of NF-H and its distribution in primary RGCs were detected by immunohistochemical technique and microscopic image-analysis technique.Results The purity of RGCs was 96.24%.H2O2affected the survival and growth of RGCs in a time-and concentration-dependent manner.The viability of RGCs was reduced by 50%after treatment with 500μmmol/L H2O2for 32h.Moreover,the processes of H2O2-treated RGCs were much shorter than those of untreated cells(P<0.01),which was accentuated with extended treatment time.NF-H was significantly down-expressed in RGCs treated with H2O2and it was distributed unevenly in RGCs.Conclusion H2O2-induced oxidative stress injury can affect the survival of purified and cultured RGCs in a time-and concentration-dependent manner,and affect their axonal growth,which may be associated with the down-regulated expression of NF-H protein in RGCs.
retina ganglion cells; exogenous H2O2; cell survival; axons; neurofilament protein-H
R774
10.3870/j.issn.1672-0741.2015.02.016
钟 杰,女,1981年生,主治医师,医学硕士,E-mail:349946046@qq.com
