荧光素钠引导辅助下胶质瘤切除的应用
2015-06-05刘晓亮张首平罗毅男
刘 明,刘 楠,刘晓亮,张首平,罗毅男*
(1.吉林大学第一医院神经外科,吉林长春130021;2.吉林大学第四医院神经外科,吉林长春130011)
荧光素钠引导辅助下胶质瘤切除的应用
刘 明1,刘 楠1,刘晓亮1,张首平2,罗毅男1*
(1.吉林大学第一医院神经外科,吉林长春130021;2.吉林大学第四医院神经外科,吉林长春130011)
目的观察和评估应用荧光素钠引导的荧光显微镜下诊断胶质瘤边界,从而通过手术准确的切除胶质瘤。方法29例脑胶质瘤患者术前根据体征、查体及影像学表现,初步诊断为胶质瘤,术中应用荧光素钠所发出的黄荧光确定肿瘤边界来切除肿瘤,根据不同荧光强度取材进行病理诊断以确定荧光引导的边界是否准确。术后行MRI增强检查以明确肿瘤的切除情况。结果胶质瘤在荧光显微镜下被激发出黄荧光,而正常脑组织不发光。病理结果显示黄色荧光区含有大量的胶质瘤细胞,并可见血管内皮细胞增生,淡黄色荧光区仅有少量的肿瘤细胞。患者术后MRI增强扫描证实肿瘤切除比较彻底。结论该方法能够确定肿瘤边界,降低肿瘤复发率,保护正常脑组织,提高患者术后生存质量。
荧光素钠;诊断;神经胶质瘤
(Chin J Lab Diagn,2015,19:0210)
胶质瘤在颅内恶性肿瘤的发病率占(70%),其特点为病变在颅内浸润性生长,易复发、病变边界不易确定,手术难以彻底清除。人体被注射荧光素钠后,通过特定波长的光,照射特定的光敏物质后所产生的一系列化学、物理、生物等反应而用于诊断肿瘤的一种方法。光敏药物可以在肿瘤部位伴随血液运行而高浓度积聚,使用特定波长的光线照射肿瘤部位,恶性肿瘤随即产生荧光,根据荧光的强度来确定肿瘤的的边界[1-4],以提高肿瘤的清除率,减少肿瘤残余,降低肿瘤复发率,这是近10多年发展起来的治疗颅内恶性肿瘤的一种方法。我们对29例脑恶性胶质瘤患者在荧光素钠介导下的肿瘤切除,获得较好满意的结果,报告如下。
1 材料与方法
1.1 临床资料2012年1月至2013年4月在我院手术治疗胶质瘤男16例,女13例,年龄33-72岁,平均51岁。病程15天-8个月,临床表现:头疼13例,肢体活动不灵5例,失语4例,癫痫2例,走路不稳5例。头部CT或MRI检查示:肿瘤位于额叶17例,顶叶3例,颞叶4例,小脑5例。术前均向患者告知手术风险,签署使用荧光素钠知情同意书。
1.2 方法
术前检查-29例病人在手术前均进行头部CT和MRI检查,了解肿瘤位置及大小、肿瘤血液供应情况、周围脑水肿程度、肿瘤内有无囊性变、与邻近的重要神经血管关系等,术前检查患者肝功、凝血常规、肾功等情况,并查无异常。
手术方法-患者在全麻起效后行常规开颅手术,打开硬脑膜后先进行荧光素钠药物试敏,用0.9%氯化钠注射液将20ml荧光素钠稀释,稀释后浓度为1%的溶液5ml,监测患者一般生命体征,观察患者的呼吸变化、心率,皮肤有无皮疹。观察15 min无异常后暴露肿瘤,然后静脉注射10%荧光素钠10ml(15-20mg/kg),此时肿瘤开始呈现浅黄色并逐渐加深,5-10min左右荧光素钠达到高峰,肿瘤呈现深黄色区、肿瘤周边呈浅黄色区、正常脑组织呈无黄染区,将深黄色、浅黄色区至无黄染区在显微镜下切除结束手术。术后将肿瘤荧光程度不同部位送检病理,分别在每例患者肿瘤标本的中心(深黄荧光区)、肿瘤标本边缘(淡黄色荧光区)和肿瘤标本周边(无荧光区)取材,甲醛固定,石蜡包埋后制成厚度约5mm的病理切片,HE染色,镜下观察根据不同荧光程度取材的组织学特点。以及免疫组化检验后对肿瘤的恶性程度评估.术后3天后给予每位患者行头部MRI或CT检查,判断肿瘤的切除程度。患者出院时给予KPS评分进行评估,判断手术前后患者的神经功能有无受损。术后3个月随访病人状况。
2 结果
2.1 荧光质量在荧光显微镜下胶质瘤的实质部分显示为深黄色荧光区,而肿瘤坏死部分不能激发荧光。在肿瘤组织和脑组织的交界处显示为较淡的黄色荧光,而正常脑组织不激发荧光。通过荧光的有无和强弱对比不仅能够诊断肿瘤组织和正常脑组织边界,并能够区别不同性质和区域的肿瘤组织。注射荧光素纳后荧光持续约时间约4-6h。
2.2 手术疗效术后给予营养神经、预防感染、降颅压、抗癫痫等治疗。本组患者无手术死亡,术后患者临床症状缓解,KPS评分平均为86.3分,尿液、皮肤及巩膜黄染均在24h左右消失。血常规、肝功和肾功检查正常,无药物不良反应。术后3天复查头部MRI显示手术治疗后肿瘤全切除28例,次全切除1例。术后觉头疼患者均觉头疼程度和发作频率明显减轻,病灶累及运动区的5例病人中4术后肌力未受影响,可以在生活上自理,1例出院时已恢复至术前水平,4例病灶累及语言区中枢2例病人术后言语功能基本恢复正常,病灶累及小脑的5例患者,术后5例小脑平衡共济障碍未见加重。术后3个月随访患者29例中有27例未见复发,2例有轻度的复发。
2.3 病理学检查根据荧光显示结果,分别在每例患者肿瘤标本中心(深红黄荧光区)、肿瘤标本边缘(淡黄色荧光区)和肿瘤周边(无荧光区)取病理,不同染色区病理:在肿瘤黄荧光强度较高的区域,深黄染区(图1中a),显示大量的肿瘤细胞,肿瘤细胞排列紧密,细胞核大小不一,异型性明显,并可见较多核分裂像,血管内皮细胞数量较多,血管内皮细胞异常增殖,瘤细胞围绕血管形成似菊花形团状,瘤组织内小血管十分丰富,围绕成团或者呈屏障样排列,瘤组织中可见大量坏死组织和黏液变性;浅黄染区(图1中b),肿瘤细胞密度低,排列较弥散,瘤内小血管数量减少,血管内皮细胞增生不明显,坏死灶少见;无黄染区(图1中c),未见肿瘤细胞及内皮细胞增生和坏死改变,细胞核大小,形态未见明显异常。
2.4 术后影像学检术后给予每位患者检查头部MRI或头部CT,根据术前及术后核磁等影像学检查,经对比后,可见肿瘤明显切除(图2和图3)。
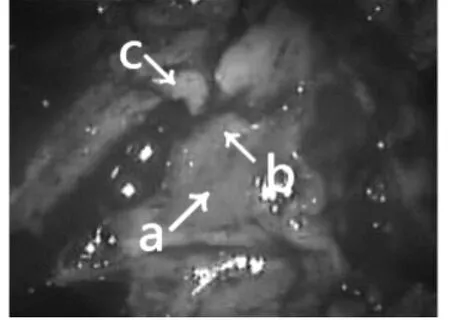
图1 a肿瘤标本中心(深红黄荧光区b边缘(淡黄色荧光区)c肿瘤周边(无荧光区)

图2 患者术前头部影像学检查
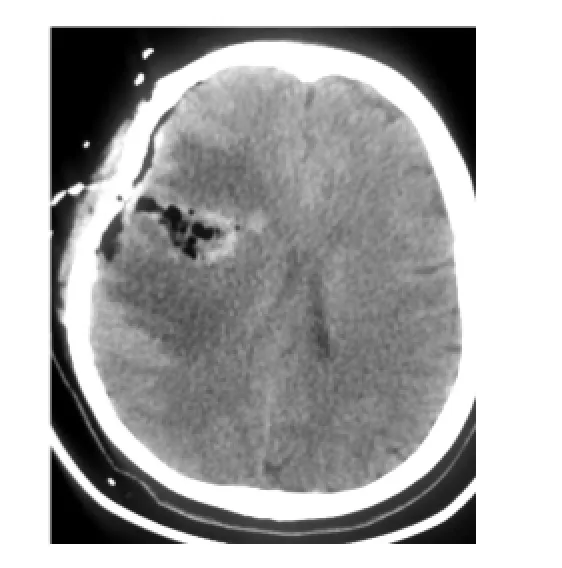
图3 患者术后影像学检查
2.5 术后并发症3例患者术后皮肤、黏膜、巩膜出现黄染,尿液呈淡黄色,2天后自行消失。余26例患者未发现黄染和静脉注射荧光素钠引起的术后其他并发症。
3 讨论
目前,胶质瘤的死亡率很高,中国年胶质瘤发病率为3-6人/10万人,年死亡人数约为3万人,原发性恶性胶质瘤病人的平均生存期大约为1年左右。胶质瘤的治疗仍是医学所面临的难题,其特点是侵袭性生长,基因治疗和免疫治疗在动物实验中取得了不错的疗效,但在临床实际应用中还面临着许多问题,疗效不确切。胶质瘤边界与正常脑组织之间无明显边界,术中术者经常凭借经验,如脑沟深浅、肿瘤的颜色、脑回形态、质地、血液供应等为主要标准来判定肿瘤的边界,因此往往会引起肿瘤组织在大脑中的残余而复发,特别是大脑运动功能区肿瘤手术完整切除是具有挑战性的。手术切除肿瘤的程度直接关系到胶质瘤复发的几率,局部肿瘤细胞的残留是胶质瘤复发最主要的因素。目前用于术中评估肿瘤残留的方法存在多种限制。术中的MRI或CT,能够通过影像诊断对肿瘤进行评估,发现肿瘤后可继续切除,但术中的MRI或CT设备昂贵,成像时间长,增加患者感染风险,临床很少应用。术中B超提供了简单的发现肿瘤残留的方法,但是由于B超图像质量不清晰,对于小于3mm的肿瘤组织不能清楚分辨,而且要求手术医师具有十分丰富的超声图像识别经验。术后同步的放疗、化疗能够明显降低胶质瘤复发概率,肿瘤手术切除的程度则是其他一切治疗的基础,直接关系到病人生存期延长的程度[5-7]。
近年来,随着光学设备的飞速发展,荧光激发光源结合接收显示系统被整合于手术显微镜中,称为荧光手术显微系统。应用荧光手术显系统,在手术过程中能够清楚诊断肿瘤组织的边界,区别肿瘤组织和正常的脑组织。应用荧光显微镜系统介导的手术,可随时在镜下变换自然光与荧光,确定胶质瘤边界后,不仅大大缩短的手术时间和术后感染的概率,同时降低了肿瘤复发的概率,正常功能区脑组织明显减少破坏,随着科学发展越来越多的技术正在开发最大安全切除颅脑胶质瘤手术。国际上现常用的荧光剂为血红素前体(5-ALA)和荧光素钠,德国学者研究将神经细胞和肿瘤细胞与血红素前体(5-ALA)共同培育,利用荧光强度不同,可以将神经细胞与肿瘤细胞区分开。5-ALA的作用原理是5-ALA与胶质瘤细胞内聚集的荧光原卟啉结合,结合后释放荧光的特点,让患者在手术前服用5-ALA,在手术过程中通过装有氙光光源的光学显微镜切除散发红荧光胶质瘤组织,取得了很好的治疗效果,但使用该方法必须使用具有氙气光源的显微镜,且国内无5-ALA,临床使用和推广受到很大限制。日本学者将胶质瘤细胞加入荧光素钠共同培育约2小时,用共聚焦显微镜观察,发现胶质瘤细胞不吸收荧光素钠。表明荧光素钠存在于细胞外间隙,不进入胶质瘤细胞内部。荧光素钠的作用原理是胶质瘤呈浸润性生长,侵袭破坏脑组织过程涉及多个步骤,其中肿瘤侵袭的关键步骤是细胞外基质被降解,破坏了血脑屏障,荧光素钠是一种特殊的荧光染料,由静脉给药,通过被破坏的血脑屏障进入胶质瘤细胞内,使肿瘤组织和其浸润部分显示深黄色,普通显微镜下即可分辨白质神经纤维和肿瘤组织,通过胶质瘤特异摄取大量荧光素钠的特性,结合Leica荧光显微镜系统,能够更清晰的识别肿瘤的边界。荧光素钠经长期临床试验是一种有效、代谢迅速、安全的荧光剂[8],根据患者肝功、肾功和个人体重情况给药,术后给予足量的饮水或静点液体即可代谢。Haglund等[9]采用术中电刺激,证实了决定预后的关键因素是切除肿瘤边缘与最近语言区的距离,如该距离>1cm,发生语言障碍的风险会明显减少。Feigl等[10]采用荧光引导联合皮层电刺激,确定功能区边界后更好的保留功能区。本组功能区的胶质瘤9例患者结合使用了术中电生理,肿瘤切除范围只保留术中电生理确定的功能区域,其余全部切除,术后肢体运动、语言障碍一过性加重3例,可能与血管痉挛、术后脑水肿及辅助运动损伤有关,经对症治疗后逐渐恢复。因此,功能区胶质瘤荧光引导手术中结合皮质电刺激、体感诱发电位检测,可使安全性、准确性、手术切除率大大提高[11],提高患者术后生存质量。荧光素钠引导胶质瘤切除安全、经济、可靠、实用,本组病例数量少,随访时间短,今后在如何提高荧光素钠对肿瘤染色的特异性(尤其是低级别胶质瘤)、荧光索钠最合理用药剂量,荧光需要配合手术持续时间等方面尚需进一步研究,相信随着实践和经验的积累,荧光素钠引导神经胶质瘤切除技术将越来越成熟。
[1]Li Y,Rey-Dios R,Roberts DW,et al.ntraoperative Fluorescence-Guided Resection of High-Grade Gliomas[J].World Neurosurg,2014.82:175.
[2]Koc K,Anik I,Cabuk B,et al.Fluorescein sodium-guided surgery in glioblastoma rnultiforme:aprospective evaluation[J].Br J Neurosurg,2008,22:99.
[3]Bogaards A,Varma A,Collens SP,et al.Increased brain tumor resection using fluorescence image guidance in a preclinical model[J].Lasers Surg Med,2004,35:181.
[4]Grieb P.5-Aminolevulinic acid(ALA)and its applications in neurosurgery[J].Neurol Neurochir Pol,2004,38:201.
[5]Laws E R.Parney I F.Huang W,et al.Survival following surgery and prognostic factors for recently diagnosed malignant glioma:data from the Glioma Outcomes Project[J].J Neurosurg,2003,99:467.
[6]Buckner JC.Factors influencing survival in high-grade gliomas[J].Semin Oncol,2003,30:10.
[7]Lacroix M.Abi-Said D,Fourney DR,et al.A multivariate analysis of 416patients with glioblastoma multiforme:prognosis,extent of resection.and survival[J].J Neurosurg,2001,95:190.
[8]赵世光,滕 雷,李 一,等.5-氨基乙酰丙酸荧光引导显微手术切除人脑胶质瘤[J]中华神经外科杂志,2007,23:369.
[9]Haglund MM.Berger MS,Shamseldin M,et al.Cortical localization of temporal lobe language sites in patients with gliomas.Neurosurgery[J].1994,34:567;discussion 576.
[10]Feigl GC,Ritz R,Moraes M.Resection of malignant brain tumors in eloquent cortical al'efs:a new muhimodal apprnach combining 5一Aminolevulinic acid and intranperative monitoring[J].Neumsurg,2010,13:352.
[11]陈大伟,顾卫红,葛鹏飞,等.荧光引导脑胶质瘤切除的临床应用[J].中华神经外科杂志,2012,28:829.
The application of fluorescein sodium guided to diagnose glioma border
LIU Ming,LIU Nan,LIU Xiao-liang,et al.
(Department of Neurosurgery,The First Hospital,jilin Univicrsity,Changchun130021,China)
ObjectiveObserved and evaluated the application of fluorescein sodium guided by fluorescence microscopic to diagnose glioma boundary,thereby we can accurate removal of glioma by surgery.Methods29patients with glioma were according to the physical signs,physical examination,and imaging findings before surgery,preliminary diagnosis was glioma,During surgery,application of fluorescein sodium emitted yellow fluorescence confirmed tumor boundary to removal of the tumor,According to sample of different fluorescence intensity based on pathological diagnosised to determine whether the boundary of the fluorescent guide is accurate.Postoperative used MRI enhanced examination in order to make clear how many f the tumor was removaled.ResultsGlioma was inspired yellow fluorescence under the fluorescent microscope,the normal brain tissue was not light.Pathological results showed that yellow fluorescence area contains a lot of glioma cells,and saw vascular endothelial cell proliferation,pale yellow fluorescent area could see only a small amount of tumor cells.MRI enhancement scanning postoperatively in patients with confirmed tumor resection was thoroughly.ConclusionThe method could determine boundary of the tumors,reduced recurrence of tumor,protected the normal brain tissue,improved the quality of patients with postoperative survival.
Fluorescein sodium;Diagnose;Glioma
R739.41
A
2014-02-18)
1007-4287(2015)02-0210-04
*通讯作者
