五种常用二代抗精神病药物对首发精神分裂症患者泌乳素的近期影响☆
2015-06-02王厚亮赵靖平韩洪赢温盛霖张俊成
王厚亮 赵靖平韩洪赢 温盛霖 张俊成
近年来,新型二代抗精神病药物所致高泌乳素(prolactin,PRL)血症为特征的神经内分泌异常日益受到关注。从高泌乳素血症至高泌乳素血症综合征是一个逐步发展变化的病理生理过程[1]。待出现高泌乳素血症综合征才予以干预,显然具有滞后性。近年鲜有文献报道抗精神病药物在治疗早期阶段对泌乳素的动态影响,临床上对高泌乳素血症演化至高泌乳素血症综合征这一过程不够重视。由于二代抗精神病药物在临床应用日益广泛,其对泌乳素的影响不尽相同[2],本研究拟比较5种临床常用二代抗精神病药物在早期治疗阶段对首发精神分裂症患者泌乳素水平的影响,以了解其动态变化特点,为临床及时干预高泌乳素血症及高泌乳素血症综合征提供依据。
1 对象与方法
1.1 研究对象 系2012年7月至2014年6月在中山大学附属第三医院、广州市脑科医院、广州市三九脑科医院和东莞市新涌医院住院的首发精神分裂症患者。入组标准:①符合《中国精神障碍分类方案与诊断标准第3版》(Chinese Classification and Diagnostic Criteria of Mental Disorders,CCMD-3)精神分裂症的诊断标准,阳性与阴性症状量表(posi⁃tive and negative symptom scale,PANSS)总分 60~120分;②首次发病;③近半年未服用任何抗精神病药、抗抑郁药,未使用麻醉剂、抗高血压药、H2受体拮抗剂,无化疗、骨髓移植等其他可引起血清催乳素升高的因素;④年龄18~45岁;⑤获得受试者及其家属或法定监护人签署知情同意书。排除标准:①患严重躯体或内分泌疾病;②有物质滥用或依赖史;③妊娠或哺乳期妇女;④对受试药物过敏。退出标准:①治疗过程中出现病情恶化或严重并发症;②出现严重药物不良事件;③受试者或监护人撤销知情同意书。共纳入250例患者,男125例,女 125例,年龄 18~37岁,平均(22.49±3.15)岁。
1.2 研究方法
1.2.1 分组与治疗方案 本研究采用多中心、开放性、随机、对照研究设计。采用随机数字表法将患者分为利培酮组、奥氮平组、帕利哌酮组、喹硫平组和齐拉西酮组,每组各50例。治疗观察时间为6周。用药方案:①利培酮组:利培酮(西安杨森公司)起始剂量每次1 mg、每日2次,第4日加量至每次2 mg、每日2次,日稳定剂量3~6 mg,平均使用(4.15±1.72)mg/d;②奥氮平组:奥氮平(美国礼来公司)起始剂量每次5 mg、每日2次,第4日加量至每次10 mg、每日2次,日稳定剂量10~20 mg,平均使用(15.22±3.68)mg/d;③帕利哌酮组:帕利哌酮(西安杨森公司)起始剂量每次3 mg、每日1次,第4日加量至每次6 mg、每日1次,日稳定剂量6~12 mg,平均使用(9.14±2.32)mg/d;④喹硫平组:喹硫平(阿斯利康公司)起始剂量每次100 mg、每日2次,第4日加量至每次200 mg、每日2次,日稳定剂量400~750 mg,平均使用(537.83±64.27)mg/d;⑤齐拉西酮组:齐拉西酮(辉瑞公司)起始剂量每次20 mg、每日2次,第4日加量至每次40 mg、每日2次,日稳定剂量80~160 mg,平均使用(113.67±31.62)mg/d。治疗期间可合并使用小剂量苯二氮䓬类药物和盐酸苯海索,不合用其他抗精神病药物、心境稳定剂、抗抑郁药物或电休克治疗。
1.2.2 泌乳素水平检测 基线和治疗第1、2、3、4、5、6周末采血检测泌乳素水平。采血前一日,不搓揉乳房;当日避免剧烈晨练。清晨空腹7:00~10:00时采肘部静脉血约5 mL,高速离心(3000 r/min,10 min)后取上层血清,置-20℃低温冰箱存放。于中山大学附属第三医院检验科批量检测泌乳素,采用化学发光法,检测仪器为ACCESS型全自动微粒子化学发光免疫分析系统(美国贝克曼库尔特有限公司),试剂盒为该公司配套泌乳素检测试剂盒。血清泌乳素正常值范围为2.78~29.20 ng/mL。
1.2.3 临床评估 在基线和治疗第6周末时采用PANSS和副反应量表(treatment emergent symptom scale,TESS)评估各组药物疗效与安全性,在基线和治疗每周末时采用自编高泌乳素血症综合征调查表记录患者月经、溢乳等临床情况。PANSS用于评定患者精神症状严重程度,主要指标包括阳性症状分、阴性症状分、一般精神病理分。TESS用于评定抗精神病药物治疗的安全性,本研究中记录不良反应发生的例数作为统计指标。自编高泌乳素血症综合征调查表包括闭经、月经紊乱、泌乳、性欲减退、男子乳房女性化、多毛等项目,记录是否出现上述症状及出现时间。量表的评估由1名高年资主治医师完成,由1名副主任医师复核。1.3统计学方法所有数据均采用SPSS 17.0进行统计分析。对各组各时点泌乳素值采用重复测量方差分析,各组内不同时点泌乳素水平的比较采用Bonerroni法,各时点上组间泌乳素水平的两两比较采用LSD法。5组PANSS评分在治疗前后变化值的比较采用单因素方差分析,LSD法进行两两比较。各组不良反应发生情况的比较采用χ2检验。检验水准α为0.05。
2 结果
2.1 社会人口学和临床特征 至研究终点,利培酮组完成47例,失访1例,无法耐受不良反应2例;奥氮平组完成46例,失访1例,无法耐受不良反应3例;帕利哌酮组完成49例,失访1例;喹硫平组完成49例,失访1例;齐拉西酮组完成48例,失访2例。剔除失访及不能耐受不良反应患者,入组患者社会人口学资料和基线时病程见表1。5组患者间性别、年龄、受教育年限、病程的差异均无统计学意义(P >0.05)。
2.2 泌乳素水平变化 基线时5组患者泌乳素水平差异无统计学意义(P>0.05)。各组各时点泌乳素水平见图1与表2。重复测量方差分析示,时间因素主效应(F=943.06,P<0.01)、分组因素主效应(F=43.47,P<0.01)均具有统计学意义,时间和分组交互作用具有统计学意义(F=15.08,P<0.01)。
比较各组内不同时点的泌乳素值,利培酮组内各时点泌乳素水平均具有统计学差异(P<0.05);奥氮平组,第1周末泌乳素水平与基线比较无统计学差异(P>0.05),之后各时点与第1周末及相互间比较均具有统计学差异(P<0.05);帕利哌酮组、喹硫平组和齐拉西酮组在基线、第1周和第2周末时泌乳素水平差异无统计学意义(P>0.05),之后各时点与第2周末及相互间比较均具有统计学差异(P<0.05)。
表1 入组患者社会人口学资料和基线时临床特征(±s)
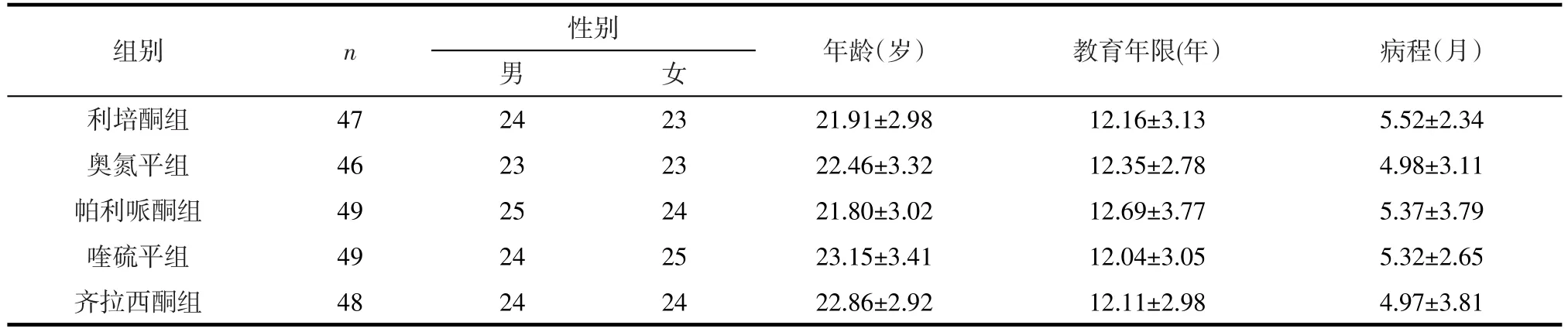
表1 入组患者社会人口学资料和基线时临床特征(±s)
组别利培酮组奥氮平组帕利哌酮组喹硫平组齐拉西酮组n 性别女47 46 49 49 48男24 23 25 24 24 23 23 24 25 24年龄(岁)21.91±2.98 22.46±3.32 21.80±3.02 23.15±3.41 22.86±2.92教育年限(年)12.16±3.13 12.35±2.78 12.69±3.77 12.04±3.05 12.11±2.98病程(月)5.52±2.34 4.98±3.11 5.37±3.79 5.32±2.65 4.97±3.81
比较各时点上5组患者间泌乳素值,第1周末利培酮组泌乳素水平高于另外4组(P<0.01);第2、3、4、5周末,利培酮组和奥氮平组泌乳素水平均高于其他3组(P<0.01),而后3组间没有统计学差异(P>0.05);第6周末利培酮组、奥氮平组和帕利哌酮组泌乳素水平均高于喹硫平组和齐拉西酮组(P<0.05),并且利培酮组和奥氮平组高于帕利哌酮组(P<0.01),喹硫平组和齐拉西酮组间没有统计学差异(P>0.05)。
2.3 PANSS评分变化 各组在基线和治疗第6周末时的PANSS评分及其变化值见表3。基线时5组间PANSS评分无统计学差异(P>0.05);治疗6周,各组变化值有统计学差异(F=18.63,P<0.01),其中利培酮组、奥氮平组和帕利哌酮组变化值大于喹硫平组和齐拉西酮组(P<0.01),其他组间差异无统计学意义(P>0.05)。
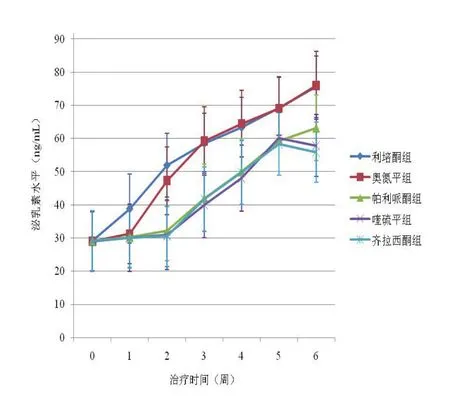
图1 5组患者各时点泌乳素水平变化 时间主效应、分组主效应、时间分组交互效应均具有统计学意义(P<0.01)
2.4 不良反应及泌乳素血症症状情况 剔除失访患者,将完成研究和无法耐受不良反应而退出者纳入分析。利培酮组因鼻塞而无法耐受者2例,静坐不能者3例,嗜睡者1例,肌强直2例,不良反应发生率16.33%(8/49);奥氮平组因嗜睡而无法耐受者3例,体重增加者4例,不良反应发生率14.29%(7/49);帕利哌酮组静坐不能者2例,鼻塞者1例,不良反应发生率6.12%(3/49);喹硫平组头痛者1例,头昏者1例,不良反应发生率4.08%(2/49);齐拉西酮组静坐不能者2例,恶心者1例,不良反应发生率6.25%(3/48)。5组间不良反应发生率无统计学差异(χ2=6.92,P=0.15)。
奥氮平组、喹硫平组和齐拉西酮组患者均未出现高泌乳素血症症状;利培酮组5例出现月经延迟,2例乳涨;帕利哌酮组3例月经延迟,1例乳涨。
3 讨论
表2 5组患者各时点泌乳素水平[(±s),ng/mL]

表2 5组患者各时点泌乳素水平[(±s),ng/mL]
1)与利培酮组比较,经LSD-t检验,P<0.01;2)与奥氮平组比较,经LSD-t检验,P<0.01;3)与帕利哌酮组比较,经LSD-t检验,P<0.05
组别利培酮组奥氮平组帕利哌酮组喹硫平组齐拉西酮组n 47 46 49 49 48治疗前29.18±9.16 28.98±8.86 29.23±9.09 29.04±8.91 29.12±9.10治疗第1周38.87±10.41 31.26±9.021)30.37±9.211)30.08±10.061)29.98±9.011)治疗第2周51.97±9.57 47.29±10.261)32.17±9.011)2)31.02±10.511)2)30.47±9.111)2)治疗第3周58.54±9.12 59.29±10.31 42.14±10.121)2)40.09±9.981)2)41.74±9.611)2)治疗第4周63.42±9.02 64.49±10.11 50.14±9.871)2)48.09±9.981)2)49.74±9.611)2)治疗第5周69.27±9.32 69.14±9.24 59.42±10.011)2)60.09±10.981)2)58.38±9.421)2)治疗第6周75.66±9.28 76.01±10.21 63.25±9.921)2)57.87±9.341)2)3)55.84±9.121)2)3)
表3 5组患者基线和第6周末PANSS得分(±s)

表3 5组患者基线和第6周末PANSS得分(±s)
1)与利培酮组比较,经LSD-t检验,P<0.01;2)与奥氮平组比较,经LSD-t检验,P<0.01;3)与帕利哌酮组比较,经LSD-t检验,P<0.05
组别利培酮组奥氮平组帕利哌酮组喹硫平组齐拉西酮组n 47 46 49 49 48基线78.19±10.97 76.98±11.19 77.85±11.19 77.88±10.78 78.08±10.40第6周末50.31±17.16 51.42±16.89 54.58±17.75 63.58±17.23 64.83±16.70变化值-27.36±7.87-25.24±9.27-23.45±10.99-14.28±10.861)2)3)-13.95±11.031)2)3)
关于泌乳素正常值范围的上限,临床研究中的界定并不一致:如有的研究中男性与女性上限均为25 ng/mL[3];近来更多的研究设定男性上限为18~20 ng/mL,女性为24 ng/mL[4-7];国内则将男性上限定为17.70 ng/mL,女性为29.20 ng/mL[8]。本研究采用国内标准,将泌乳素范围值上限定为29.20 ng/mL。尽管泌乳素正常值标准不同,但大部分研究报道首发、未用抗精神病药物治疗的精神分裂症患者泌乳素水平为正常或低于正常[9-11]。有些研究报道则发现首发未用药精神分裂症患者泌乳素水平增高[12-13]。最近 Song等[14]研究首发未用药精神分裂症患者泌乳素与炎性状态的关系亦发现,男性患者泌乳素水平为6.78~51.43 ng/mL,平均(28.61±11.74)ng/mL,女性为9.82~57.73 ng/mL,平均为(32.48±14.05)ng/mL,高于健康对照组,且女性患者中高泌乳素的发生率高于男性患者。本研究结果发现,首发未用药精神分裂症患者基线泌乳素接近正常值范围的上限29.20 ng/mL,提示首发患者可能具有基础泌乳素偏高的倾向。精神分裂症患者基础泌乳素水平能否作为生物学标志尚需进一步研究。Aston等[15]认为,基础泌乳素值高于上限的患者可能是精神分裂症的一种亚型。Shrivastava等[16]报道首发未用药精神分裂症患者基础泌乳素增高,并认为泌乳素水平可作为长期预后指标,但不作为精神病理学和短期预后指标。
所有抗精神病药物都具有阻断中脑—边缘系统和中脑—皮质系统多巴胺D2受体的作用,这种特性被认为是抗精神病药物疗效的关键;但抗精神病药物也不可避免地阻断多巴胺黑质—纹状体通路和结节—漏斗通路多巴胺受体,产生副作用。抗精神病药物阻断垂体前叶泌乳素细胞D2受体,减弱多巴胺对泌乳素分泌的抑制作用,导致泌乳素升高。第二代抗精神病药物对泌乳素的影响变异较大,如氯氮平对泌乳素几乎没有影响,而利培酮和帕利哌酮升高泌乳素的作用较强,且具有剂量依赖性[17]。本研究发现,5种二代抗精神病药物中,利培酮在第1周末即显著升高泌乳素至第6周末,该组患者每个时点泌乳素水平均高于帕利哌酮组、喹硫平组和齐拉西酮组。帕利哌酮作为利培酮的代谢产物,延迟在第3周末显著升高泌乳素,患者在第6周末泌乳素水平显著高于喹硫平组、齐拉西酮组。可能的解释是,帕利哌酮成分单一,对泌乳素细胞D2受体的阻断作用相比利培酮较弱。
Tran等[18]研究发现,使用奥氮平治疗的成人患者中,约1/3出现泌乳素轻度升高。奥氮平对泌乳素的升高作用有剂量依赖性[19]。本研究发现,奥氮平第2周末即显著升高泌乳素,且持续升高至第6周末,该组患者第2周末及之后各时点泌乳素水平高于帕利哌酮组、喹硫平组和齐拉西酮组,提示奥氮平对泌乳素细胞D2受体有一定的阻断作用。多数研究认为喹硫平几乎不升高泌乳素水平,与安慰剂比较没有统计学差异[20-23]。一项为期8周的双盲研究发现齐拉西酮组超过40%的患者泌乳素升高,奥氮平组超过60%的患者泌乳素升高[24]。而本研究发现,喹硫平与齐拉西酮类似,同样升高泌乳素水平,但迟于利培酮和奥氮平,于第3周末显著升高泌乳素,且以相对较低幅度持续升高至第6周末。可能的解释是,喹硫平和帕利哌酮对D2受体结合短暂且占有率低,但毕竟对D2受体具有一定的阻断作用。
本研究提示,精神分裂症患者可能存在基础泌乳素水平偏高;随着抗精神病药物治疗的延续,泌乳素水平有增高的趋势;不同二代抗精神病药物对泌乳素的近期影响不同。临床上应把握抗精神病药物治疗过程中导致泌乳素显著升高的时间节点,及时进行高泌乳素血症早期干预,从而避免或缩短从高泌乳素血症至高泌乳素血症综合征这一病理生理过程,为患者带来最大裨益。
本研究特色在于提出早期、及时对高泌乳素血症进行干预,避免或缩短高泌乳素血症发展至高泌乳素血症综合征的过程。本研究不足之处主要在于纵向时间点上间隔以周为单位,可能不足以及时检测泌乳素水平的变化;其次,样本量较小,且没有按性别分别进行研究。今后的进一步研究需加以完善。
[1]De Hert M,Detraux J,Peuskens J.Second-generation and new⁃ly approved antipsychotics,serum prolactin levels and sexual dysfunctions:a critical literature review[J].Expert Opin Drug Saf,2014,13(5):605-624.
[2]Peuskens J,Pani L,Detraux J,et al.The effects of novel and newly approved antipsychotics on serum prolactin levels:a com⁃prehensive review[J].CNS Drugs,2014,28(5):421-453.
[3]Marken PA,Haykal RF,Fisher JN.Management of psychotro⁃pic-induced hyperprolactinemia[J].Clin Pharm,1992,11(10):851-856.
[4]Jung DU,Conley RR,Kelly DL,et al.Prevalence of bone miner⁃al density loss in Korean patients with schizophrenia:a cross-sectionalstudy[J].J Clin Psychiatry,2006,67(9):1391-1396.
[5]Kinon BJ,Ahl J,Liu-Seifert H,et al.Improvement in hyperpro⁃lactinemia and reproductive comorbidities in patients with schizophrenia switched from conventional antipsychotics or ris⁃peridone to olanzapine[J].Psychoneuroendocrinology,2006,31(5):577-588.
[6]Kinon BJ,Gilmore JA,Liu H,et al.Prevalence of hyperprolac⁃tinemia in schizophrenic patients treated with conventional anti⁃psychotic medications or risperidone[J].Psychoneuroendocrinol⁃ogy,2003,28 Suppl 2:55-68.
[7]Jung DU,Seo YS,Park JH,et al.The prevalence of hyperprolac⁃tinemia after long-term haloperidol use in patients with chronic schizophrenia[J]. J Clin Psychopharmacol, 2005, 25(6):613-615.
[8]Guo Q,Yang Y,Mu Y,et al.Pituitary stalk interruption syn⁃drome in Chinese people:clinical characteristic analysis of 55 cases[J].PLoS One,2013,8(1):e53579.
[9]Segal M,Avital A,Rojas M,et al.Serum prolactin levels in un⁃medicated first-episode and recurrent schizophrenia patients:a possible marker for the disease's subtypes[J].Psychiatry Res,2004,127(3):227-235.
[10]Muck-Seler D,Pivac N,Mustapic M,et al.Platelet serotonin and plasma prolactin and cortisol in healthy,depressed and schizophrenic women[J].Psychiatry Res,2004,127(3):217-226.
[11]Warner MD,Walker AM,D'Souza DC,et al.Lower prolactin bioactivity in unmedicated schizophrenic patients[J].Psychiatry Res,102(3):249-254.
[12]Garcia-Rizo C,Fernandez-Egea E,Oliveira C,et al.Prolactin concentrations in newly diagnosed,antipsychotic-naïve patients with nonaffective psychosis[J].Schizophr Res,2012,134(1):16-19.
[13]Riecher-R ö ssler A,Rybakowski JK,Pfl ueger MO,et al.The EUFEST Study Group.Hyperprolactinemia in antipsychotic-na⁃ive patients with first-episode psychosis[J].Psychol Med,2013,17:1-12.
[14]Song X,Fan X,Zhang J,et al.Prolaction serum levels correlate with inflammatory status in drug-naïve first-episode schizophre⁃nia[J].World J Biol Psychiatry,2014,15(7):546-552.
[15]Aston J,Rechsteiner E,Bull N,et al.Hyperprolactinaemia in early psychosis-not only due to antipsychotics[J].Prog Neuro⁃psychopharmacol Biol Psychiatry,2010,1(34):1342-1344.
[16]Shrivastava A,Johnston M,Bureau Y,et al.Baseline serum prolactin in drug-naive,first-episode schizophrenia and out⁃come at five years:Is it a predictive factor[J].Innov Clin Neuro⁃sci,2012,9(4):17-21.
[17]Skopek M,Manoj P.Hyperprolactinaemia during treatment with paliperidone[J].Australas Psychiatry,2010,18(3):261-263.
[18]Tran PV,Hamilton SH,Kuntz AJ,et al.Double-blind compari⁃son of olanzapine versus risperidone in the treatment of schizo⁃phrenia and other psychotic disorders[J].J Clin Psychopharma⁃col,1997,17(5):407-418.
[19]Crawford AM,Beasley CM Jr,Tollefson GD.The acute and long-term effect of olanzapine compared with placebo and halo⁃peridol on serum prolactin concentrations[J].Schizophr Res,1997,26(1):41-54.
[20]Arvanitis LA,Miller BG.Multiple fixed doses of“Seroquel”(quetiapine)in patients with acute exacerbation of schizophre⁃nia:a comparison with haloperidol and placebo.The Seroquel Trial 13 Study Group[J].Biol Psychiatry,1997,42(4):233-246.
[21]Small JG,Hirsch SR,Arvanitis LA,et al.Quetiapine in patients with schizophrenia.A high- and lowdose double-blind compari⁃son with placebo.Seroquel study group[J].Arch Gen Psychiatry,1997,54(6):549-557.
[22]King DJ,Link CG,Kowalcyk B.A comparison of bd and tid dose regimens of quetiapine(Seroquel)in the treatment of schizophrenia[J].Psychopharmacology (Berl),1998,137(2):139-146.
[23]Borison RL,Arvanitis LA,Miller BG.ICI 204,636,an atypical antipsychotic:efficacy and safety in a multicenter,placebo-con⁃trolled trial in patients with schizophrenia.U.S.Seroquel Study group[J].J Clin Psychopharmacol,1996,16(2):158-169.
[24]Grootens KP,van Veelen NM,Peuskens J,et al.Ziprasidone vs.olanzapine in recent onset schizophrenia and schizoaffective dis⁃order:Resultsof an 8-week double blind randomized controlled trial[J].Schizophr Bull,2011,37(2):352-361.
