低频超声联合微泡治疗阿尔茨海默症的研究进展
2015-06-01陈高舒郭瑾璇杨细飞应明沈圆圆
陈高舒,郭瑾璇,杨细飞,应明,沈圆圆
1.医学超声关键技术国家地方联合工程实验室,广东省生物医学信息检测与超声成像重点实验室,深圳大学生物医学工程学院(深圳,518060)
2.深圳市疾病预防控制中心,深圳市现代毒理学重点实验室(深圳,518055)
3.深圳市微生物基因工程重点实验室,深圳市海洋生物资源与生态环境重点实验室,深圳大学生命科学学院(深圳,518060)
低频超声联合微泡治疗阿尔茨海默症的研究进展
陈高舒1,郭瑾璇1,杨细飞2,应明3,沈圆圆1
1.医学超声关键技术国家地方联合工程实验室,广东省生物医学信息检测与超声成像重点实验室,深圳大学生物医学工程学院(深圳,518060)
2.深圳市疾病预防控制中心,深圳市现代毒理学重点实验室(深圳,518055)
3.深圳市微生物基因工程重点实验室,深圳市海洋生物资源与生态环境重点实验室,深圳大学生命科学学院(深圳,518060)
血脑屏障是中枢神经系统中的特殊生理结构。它对血液中的物质进入大脑具有高度选择性,能够阻止绝大多数外源性大分子物质的进入,以维持脑内环境的稳定,但是它也阻挡了大部分药物分子的进入,成为治疗中枢神经系统疾病的障碍。目前,低频聚焦超声联合微泡的方法能够短暂、有效、局部地开放血脑屏障,为脑部药物输送和中枢神经系统疾病的治疗开辟了一个崭新途径。该文综述了近几年来利用低频超声联合微泡治疗阿尔茨海默症的研究进展。
血脑屏障;低频超声;微泡;阿尔茨海默症;β-淀粉样蛋白(Aβ)
0 引言
阿尔茨海默症(Alzheimer's Disease,AD)是常见的老年痴呆症之一,占据了老年痴呆症的50%~75%[1]。AD是进行性发展的致死性神经退行性疾病,临床表现为认知和记忆功能不断恶化,日常生活能力进行性减退,伴有神经精神症状和行为障碍。据国际老年痴呆症协会(Alzheimer's Disease International,ADI)公布的关于痴呆症的国际调查报告统计,2010年全球痴呆症患者数为3 560万;每20年,患者数量将增倍;到2050年,全球患上痴呆性疾病的人数将增长到约1.15亿[2]。据ADI的最新统计,全世界用于阿尔茨海默病患者照护的费用超过了6 000亿美元,约占全球GDP的1%[3]。随着中国步入老龄化社会,老龄人口的增多及AD发病率的增高,AD带来的社会、经济问题日益严重,已成为社会的高负担疾病。因此,有效治疗AD成为迫切需要解决的问题。但治疗AD会遇到一个严重的瓶颈问题,血脑屏障阻碍了许多大分子药物进入脑内从而影响疾病的治疗效果。国内外动物实验表明,低频超声联合微泡是一种无创、可逆、局部地开放血脑屏障的有效方法。目前,利用低频聚焦超声联合微泡方式能够靶向性地输送大分子药物至动物脑组织。近几年来,已有动物实验研究利用该方法将治疗AD的大分子药物成功输送入脑,为AD疾病的治疗带来新的希望[24-25]。
1 AD的特征
AD患者脑部的主要病理特征是出现老年斑和神经元纤维缠结[4-5]。遗传基因突变、外界环境易感因素等其他因素共同作用改变淀粉样前体蛋白的正常代谢过程,导致β-淀粉样蛋白(Beta amyloid protein,Aβ)在神经细胞外聚集沉淀形成老年斑,而细胞内过度磷酸化的微管相关蛋白异常聚集形成神经纤维缠结,导致轴突运输、突触和线粒体功能受损和神经元死亡等神经退行性病变,进而导致认知损害、运动障碍并随着年龄增大而进行性恶化[6]。但AD发病机制很复杂,目前尚不十分清楚。AD病因学说有多种,而占主要地位之一的Aβ级联学说提到,AD患者脑内产生大量Aβ并聚集沉淀形成老年斑,因此认为减少Aβ在脑组织中的沉积可延缓或减轻AD的症状[7]。尽管关于AD的病因众说纷纭,但是要开发治疗AD的有效药物或治疗方案必须考虑到一个脑中枢神经系统面临的特有问题:血脑屏障。因为血脑屏障的存在,会阻碍绝大多数的药物输送到脑部。
2 血脑屏障
血脑屏障是介于血液和脑组织之间的屏障结构,它由构成大脑血管的特定细胞组成,主要由脑的血管内皮细胞间的紧密连接、完整的基膜、周细胞以及星形胶质细胞突起等构成[8]。这种分层结构充当脑部的前线,防御血流中的有毒和有害物质进入。在电子显微镜下观察发现,脑血管内皮细胞间紧密连接比其它组织中的紧密连接更为复杂,它构成了一个连续密封的网,是大分子物质经内皮细胞间路径转运的屏障,限制离子和非电解质通过,阻止脂类化合物在外质膜的自由扩散[9-11]。尽管循环的物质可以通过转细胞运输途径或受体介导的内吞作用,穿过大脑微血管到达脑组织,但紧密连接还是会阻止循环的物质通过细胞旁路途径进入脑部[12]。因此,紧密连接是血脑屏障的主要结构基础之一。内皮细胞、星形胶质细胞底部及周细胞相结合减弱了血脑屏障的通透性。血脑屏障的存在,使得只允许气体及分子量小于400~500 Da的脂溶性小分子物质通过,这样一方面阻止了有害物质由血液进入脑组织,保证了脑内环境的高度稳定性,但同时也阻碍了许多有治疗作用的大分子物质进入脑内从而影响疾病的治疗效果[13]。
3 跨越血脑屏障输送药物的方法
为了增强药物透过血脑屏障进入脑组织,目前,在临床前和临床上主要有以下几种方式:
(1)对药物进行修饰使得它们具备脂溶性
用可溶于脂类的物质或者可与脂类载体共存的物质去修饰药物,而达到药物的脂类化,但药物脂类化存在一定的缺陷:增加了周围器官对脂类化药物的吸收,减少了药物的利用度[14]。
(2)使用药物载体
药物被封装进入到胶状的载体(比如:脂质体、纳米颗粒等)内部,或者结合蛋白质、多肽受体或者抗体[15]。药物载体方面,已经有不少关于脂质体和纳米颗粒方面的研究,比如:对脂质体和纳米颗粒的表面进行改造,利用血脑屏障的特异性机制输送药物到中枢神经系统内[16]。但是药物载体制备方法复杂、成本高、大大限制了应用。
(3)静脉注射高渗透性的溶液(比如:甘露醇、树胶醛醣)开放血脑屏障
注射高渗透性的溶液会引起脑部毛细血管壁内皮细胞的收缩,能短暂地开放血脑屏障[17]。但这种方法不能局部性开放血脑屏障,同时毒性的物质能够渗透进入脑组织,因此会引起周围细胞和神经细胞受损伤[18]。
(4)经颅注射药物入脑组织或脑室
经颅注射药物入脑组织或脑室,它是一种有创的方式,很可能会引起脑组织功能区受损[19]。
(5)低频聚焦超声联合微泡开放血脑屏障
低频聚焦超声联合微泡的方法展现出了巨大的应用潜力,因为该方法具有独特的优势,可以无创、可逆、局部地开放血脑屏障,避免了传统开放方法的局限性和副作用。微泡是一种包膜微米级的气泡,以磷脂、白蛋白、糖类、非离子表面活性剂或可生物降解的高分子多聚物等物质为壳膜[20]。在临床上常用作超声造影剂。当处于超声聚焦区域时,微泡会吸收能量并开始振荡,这种机械效应会影响到血管的紧密连接和细胞旁路途径,使血脑屏障的通透性发生短暂性的变化。因此,近几年来出现了利用聚焦超声联合微泡输送药物治疗AD的研究,下面对这方面的研究进展作一小结。
4 低强度聚焦超声联合微泡输送治疗AD的药物
2001年Hynynen等利用聚焦超声联合微泡方法成功地开放了实验兔的血脑屏[21]。研究结果发现当超声与微泡联合使用时,能以较低的声压短暂性地开放血脑屏障,并没有产生任何组织受损及神经损伤现象,为脑部药物输送和中枢神经系统疾病的治疗开辟了一个崭新途径。其后,许多研究表明,超声联合微泡能够促进大分子药物进入脑组织。近几年,逐渐出现了利用该方法输送药物入脑治疗AD的研究,表1总结了这些研究中所采取的超声联合微泡治疗的参数。
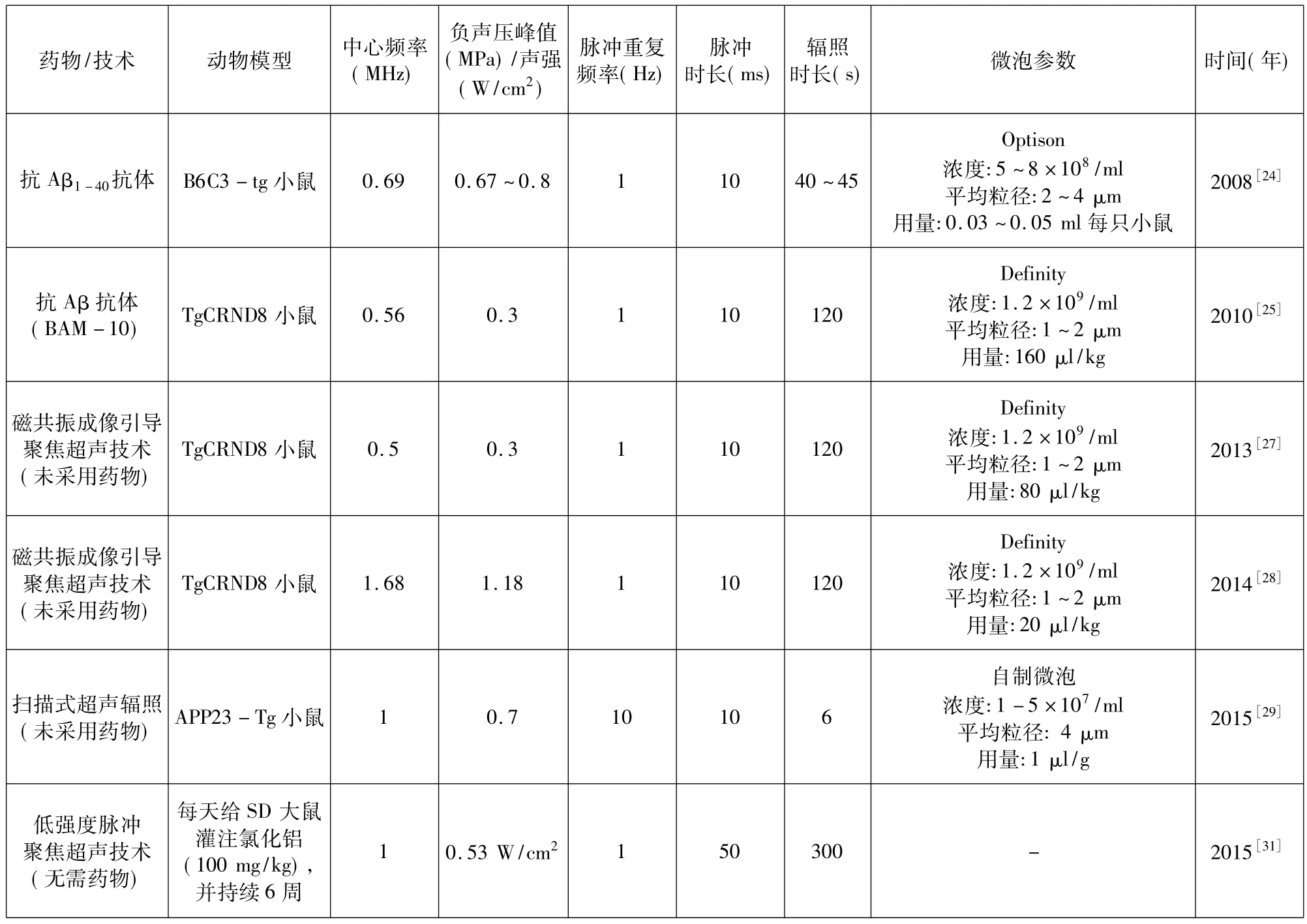
表1 超声联合微泡治疗AD的动物实验参数Tab.1 The parameters used in studies of treating AD animals using focused ultrasound w ith m icrobubbles
Aβ的沉积是引起AD患者脑部神经元死亡的重要原因之一,因此抑制Aβ的产生、聚集或促进其清除成为许多治疗AD研究的靶标。目前已有的利用超声联合微泡方法输送大分子药物治疗AD采用的也是这种策略,为刺激内源性抗体的主动免疫或直接静脉注射外源性抗体的被动免疫治疗AD。2008年Raymond等首次发现超声联合微泡能够输送抗淀粉样蛋白的抗体到AD鼠脑部[24]。利用荧光显微镜观察到抗Aβ抗体能跨越血脑屏障并结合到淀粉样斑块,但需要静脉注射高浓度的抗Aβ抗体才能治疗AD[24]。2010年,Jordão等再次证明聚焦超声联合微泡开放血脑屏障输送抗体治疗AD的有效性,并利用磁共振成像(MRI)引导聚焦超声输送抗Aβ免疫球蛋白G抗体(BAM-10)到TgCRND8鼠的脑部,用的抗体剂量少(0.04 mg),比Raymond等人输送抗Aβ抗体到脑部时剂量低约100倍[25]。此外,病理学检测发现,辐照后第4 d经超声辐照的鼠的右脑,与未辐照的左脑对比,Aβ斑块面积减少23%,Aβ斑块的数量减12%[25]。但是该研究没有验证AD鼠行为学改变情况。2014年,Burgess等通过双光子共聚焦荧光显微镜观察到经超声联合微泡辐照AD鼠脑,血管的直径对血脑屏障通透性有显著影响[26]。与正常鼠血管相比,AD鼠脑的血管壁上存在Aβ的沉积,对超声微泡引起的通透性的增强起到削弱作用,推测原因可能是因为Aβ的沉积减少了血管壁的弹性,这些研究结果表明.血管壁的力学特性对超声联合微泡增强血管通透性的效果有重要影响。因此,在将来采用该技术治疗AD时,需要考虑到AD脑部血管的特殊性所带来的影响。
上述研究中均采用了抗Aβ抗体药物,利用聚焦超声联合微泡将其输送至脑部以达到治疗AD的目的。而最新的研究结果表明,仅利用超声联合微泡开放血脑屏障,无需输送任何药物,能减少动物脑内Aβ斑块的沉积或改善动物的空间学习记忆能力[27-29,31]。2013年,Jordão等首次发现,MRI引导下利用聚焦超声联合微泡技术能显著降低TgCRND8鼠脑内Aβ斑块的沉积,而无需输送任何外源性抗体药物[27]。研究结果表明,TgCRND8鼠的右脑经聚焦超声联合微泡辐照之后第4 d,与未进行超声辐照的左脑相比,Aβ斑块的大小减少20%,总面积减少13%,但是Aβ斑块的数量未发生显著变化,该研究也没有在行为学上对AD鼠进行测试。2014年,Burgess等在MRI引导下将聚焦超声靶向至7月龄的TgCRND8鼠脑部海马区,联合微泡开放了血脑屏障[28]。该研究利用Y型迷宫测定TgCRND8鼠在该迷宫三个臂中的探索停留时间,以表征TgCRND8鼠的空间记忆能力的变化。研究结果发现经聚焦超声处理之后的AD小鼠,在新异臂的停留时间由24 s增加到了48 s,与正常小鼠无明显差异。这种行为学的改善与淀粉样斑块的大小及数量的减少相关,超声辐照后,海马区内平均斑块大小减少20%,斑块的总数量减少19%。这项研究从动物行为学上证明了低频超声联合微泡治疗能够改善AD小鼠的痴呆症状,为该方法走向临床应用进一步提供了实验依据。2015年,Leinenga等对AD鼠(APP23-Tg)的全脑进行扫描式超声辐照,亦未注射任何治疗药物[29]。研究结果发现经过超声扫描式辐照之后的AD小鼠大脑皮层区的淀粉样斑块减少56%,斑块数量减少52%,斑块负荷水平明显降低。该研究通过Y型迷宫、新物体识别及主动回避任务对小鼠进行行为学测试,发现经重复扫描式超声处理之后的AD小鼠的空间探索和记忆能力明显改善[29-30]。Leinenga等对低频超声联合微泡治疗能够改善AD小鼠症状的机制进行了初步地探索,通过共聚焦荧光显微镜观察发现小鼠脑部大量的Aβ被小胶质细胞的溶酶体所吞噬。这种清除作用可能与两种潜在的机制相关:开放血脑屏障使得内源的免疫球蛋白IgG和IgM从血液进入脑组织;星形胶质细胞和小神经胶质细胞被激活从而清除Aβ[16,27,29]。因此,有必要进一步地深入探索该方法能够降低Aβ沉积的机制。
上述研究证实了低频聚焦超声联合微泡治疗在开放动物血脑屏障的同时,能够降低脑内Aβ的负荷水平。在Burgess的研究中,还发现了该方法能增强神经元的可塑性,结果显示新生神经元数量增加250%且神经元的树突增长332%[28]。2015年,Lin等人的研究中建立了氯化铝诱导的脑损伤大鼠模型发现,低强度脉冲超声能增强模型鼠脑源性神经营养因子(BDNF和GDNF)表达,降低铝引起的大脑损伤及认知功能障碍,同时降低了脑内Aβ的沉积[31]。该研究通过Morris水迷宫的空间导航任务对大鼠进行了行为学测试结果发现,经低强度超声辐照之后的模型大鼠,在第21、42 d的探索原有平台的所花费的滞留时间和探索时间明显缩短,表明经过低强度脉冲超声刺激能改善脑损伤大鼠的空间学习和记忆能力[31-33]。这些研究结果提示了低频聚焦超声联合微泡能够对脑损伤的神经元起到一定的保护作用。
5 小结与展望
目前,众多的研究均表明,利用低频聚焦超声联合微泡治疗能短暂、安全、有效地开放血脑屏障,并能够靶向性地输送大分子药物至动物脑组织[24-25],为颅脑疾病的治疗提供了新的途径,也为AD疾病的治疗带来了新的思路。本文通过国内外的调研发现,将低频超声联合微泡应用于治疗AD动物的研究尚处于起步阶段,研究结果却振奋人心,相信在不久的将来,该方法治疗AD会有所突破。
但是,若要将这种技术应用到临床上,还面临着诸多问题。首先,人脑颅骨较厚,会引起明显的超声波的衰减和传播路径的改变,从而影响超声对病变部位的定位。第二,该方法涉及到超声参数和微泡剂量的优化问题,如何选择最适宜的超声参数和微泡剂量,确保重复性良好,同时能达到较好的治疗效果,还需要进行大量的实验研究[34]。第三,AD疾病发病原因复杂,至今尚无定论,如何选择治疗靶点,并结合低频超声联合微泡的方法仍需进行深入地探索和研究。
[1]Prince M,Prina M,GuerchetM.Journey of Caring:An analysis of long-term care for dementia[R].World Alzheimer Report,2013.
[2]Prince M,Jackson J.The global prevalence of dementia[R].World Alzheimer's Disease Report,2009.
[3]Wimo A,Prince M.The global economic impactof dementia[R].World Alzheimer Report,2010.
[4]Cruz L,Urbanc B,Buldyrev S,et al.Aggregation and disaggregation of senile plaques in Alzheimer disease[J].Proc Natl Acad Sci USA,1997,94(14):7612-7616.
[5]Sturchler-Pierrat C,Abramowski D,Duke M,et al.Two amyloid precursor protein transgenicmouse models with Alzheimer disease-like pathology[J].Proc Natl Acad Sci USA,1997,94(24):13287-13292.
[6]Jack CR,Knopman DS,Jagust WJ,et al.Hypothetical model of dynamic biomarkers of the Alzheimer's pathological cascade[J].Lancet Neurol,2010,9(1):119-128.
[7]倪嘉缵,陈平,刘琼等.阿尔茨海默病的防治策略研究进展[J].深圳大学学报(理工版),2013,30(4):331 -348.
[8]崔高宇.血脑屏障的研究进展[J].中国动脉硬化杂志,1997,5(2):162-167.
[9]Nagy Z,Peterz H,Hiittner J.Fracture faces of cell junctions in cerebral endothelium during normal and hyperosmotic conditions[J].Lab Invest:J Tech Meth Pathol,1984,50(3):313-322.
[10]Gumbiner B.Structure,biochemistry,and assembly of epithelial tight junctions[J].Am J Physiol-Cell Ph,1987,253(6 Pt1):C749-C758
[11]Staddon JM,Rubin LL.Cell adhesion,cell junctions and the blood-brain barrier[J].Curr Opin Neurobiol,1996,6(5):622-627.
[12]Abbott NJ,Rönnbäck L,Hansson E.Astrocyte-endothelial interactions at the blood-brain barrier[J].Nat Rev Neurosci,2006,7(1):41-53.
[13]PardrigeWM.Blood-brain barrier drug targeting:the future of brain drug development[J].Mol Interv,2003,3 (2):90-105.
[14]Pardrige WM.Drug and gene delivery to the brain:the vascular route[J].Neuron,2002,36(4):555-558.
[15]Fan CH,Yeh CK.Microbubble-enhanced Focused Ultrasound-induced Blood-brain Barrier Opening for Local and Transient Drug Delivery in Central Nervous System Disease[J].JMed Ultra,2014,22(4):183-193.
[16]Huwyler J,Cerletti A,Fricker G et al.By-passing of P -glycoprotein using immunoliposomes[J].J Drug Target,2002,10(1):73-79.
[17]Pan GY,Liu XD,Liu GQ.Intracarotid infusion of hypertonic mannitol changes permeability of blood-brain barrier tomethotrexate in rats[J].Acta Pharmacol Sin,2000,21(7):613-616.
[18]Dietz GP,Bahr M.Delivery of bioactive molecules into the cell:the Trojan horse approach[J].Mol Cell Neurosci,2004,27(2):85-131.
[19]ShoichetMS,Winn SR.Cell delivery to the central nervous system[J].Adv Drug Deliv Rev,2000,42(1):81 -102.
[20]Taiyama Y,Tachibana K,Hirao K,et al.Local delivery of plasmid DNA into rat carotid artery using ultrasound[J].Circulation,2002,105(10):1233-1239.
[21]Hynynen K,Mcdannold N,Vykhodtseva N,etal.Noninvasive MR Imaging-guided focal opening of the blood-brain barrier in rabbits[J].Radiology,2001,220(3): 640-646.
[22]Thakker DR,Weatherspoon MR,Harrison J,et al.Intracerebroventricular amyloid-βantibodies reduce cerebral amyloid angiopathy and associated micro-hemorrhages in aged Tg2576 mice[J].Proc Natl Acad Sci USA,2009,106(11):4501-4506.
[23]Kotilinek LA,Bacskai B,Westerman M,et al.Reversiblememory loss in amouse transgenicmodel of Alzheimer 's disease[J].JNeurosci,2002,22(15):6331-6335.
[24]Raymond SB,Treat LH,Dewey JD,etal.Ultrasound enhanced delivery of molecular imaging and therapeutic agents in Alzheimer's disease mouse models[J].PloS One,2008,3(5):e2175.
[25]Jordão JF,Ayala-Grosso CA,Markham K,et al.Antibodies targeted to the brain with image-guided focused ultrasound reduces amyloid-beta plaque load in the TgCRND8 mousemodel of Alzheimer's disease[J].PLoS One,2010,5(5):e10549.
[26]Burgess A,Nhan T,Moffatt C,etal.Analysis of focused ultrasound-induced blood-brain barrier permeability in amousemodel of Alzheimer's disease using two-photon microscopy[J].JControl Release,2014,192c:243-248.
[27]Jordão JF,Thevenot E,Markham-Coultes K,etal.Amyloid-βplaque reduction,endogenous antibody delivery and glial activation by brain-targeted,transcranial focused ultrasound[J].Exp Neurol,2013,248:16-29.
[28]Burgess A,Dubey S,Yeung S,et al.Alzheimer disease in a mouse model:MR imaging-guided focused ultrasound targeted to the hippocampus opens the blood-brain barrier and improves pathologic abnormalities and behavior[J].Radiology,2014,273(3):736-745.
[29]Leinenga G,Götz J.Scanning ultrasound removes amyloid -βand restoresmemory in an Alzheimer's diseasemouse model[J].Sci Transl Med,2015,7(278):278ra33.
[30]Blahna K,Svoboda J,Telensky P,et al.Inertial stimuli generated by arena rotation are important for acquisition of the active place avoidance task[J].Behav Brain Res,2011,216(1):207-213.
[31]Lin WT,Chen RC,Lu WW,et al.Protective effects of low-intensity pulsed ultrasound on aluminum-induced cerebral damage in Alzheimer's disease ratmodel[J].Sci Rep,2015,5:9671
[32]Morris R.Developments of a water-maze procedure for studying spatial learning in the rat[J].Neurosci Methods,1984,11(1):47-60.
[33]Brandeis R,Brandys Y,Yehuda S.The use of the Morris watermaze in the study ofmemory and learning[J].Int J Neurosci,1989,48(1-2):29-69.
[34]蔡有利,陈芸.低频聚焦超声联合微泡开放血脑屏障的研究进展[J].中华医学超声杂志,2011,8(8):78 -80.
国产二代基因测序仪面世
日前,中科紫鑫科技有限公司正式推出BIGIS二代测序仪系统。它是由中科院基因组所和半导体所共同参与研发,整合了一系列机电控制、微流体、光学和软件控制系统的高度集成的新一代测序平台。BIGIS测序仪系统可提供包括全基因组测序、靶向区域重测序、数字表达谱分析等在内的全套测序解决方案,广泛应用于感染性疾病的病因鉴定与基因诊断、遗传病基因诊断与筛查、肿瘤与血液病的基因检测与个体化诊疗、检验检疫以及药物基因组学等多种健康与疾病相关领域。
中科紫鑫与中国检验检疫研究院、北京大学人民医院、北京出入境检验检疫局、中国海洋大学、中国中医药大学等客户签订了试用协议。这标志着我国第一款具有自主知识产权的实用型国产测序仪,将在多个领域的测序中得到应用。
BIGIS测序仪外形精致,适合中小型实验室。其成本低于进口设备的三分之一,应用成本低于进口设备的五分之一,它将彻底改变我国基因测序仪依赖进口的局面。
(本刊讯)
Recent Progress of the Treatment of Alzheimer's Disease Using Low-frequency Ultrasound Combined w ith M icrobubbles
CHEN Gaoshu1,GUO Jinxuan1,YANG Xifei2,YING Ming3,SHEN Yuanyuan1
1.National-Regional Key Technology Engineering Laboratory for Medical Ultrasound,Guangdong Key Laboratory for Biomedical Measurements and Ultrasound Imaging,School of Biomedical Engineering,Shenzhen University(Shenzhen,518060)
2.Shenzhen Center for Disease Control and Prevention Key,Laboratory of Modern Toxicology of Shenzhen(Shenzhen,518055)
3.Shenzhen Key Laboratory of Microbial Genetic Engineering,Shenzhen Key Laboratory of Marine Bioresources and Ecology,College of Life Sciences,Shenzhen University(Shenzhen,518060)
The blood-brain barrier is a specialized cellular and metabolic barrier in the central nervous system.It has a highly selective permeability for substances in the blood circulation.Majority of exogenous soluble molecules are prevented entering into the brain from the bloodstream to protect neuron tissues.However,it also hinders the delivery of neurotherapeutic drugs into brain and becomes themain obstacle for the treatment of central nervous system diseases.Low-frequency focused ultrasound combined withmicrobubbles can open the blood-brain barrier transiently,noninvasively and locally,thus has a great potential to deliver drugs into brain.This paper reviews the current progress of therapy of Alzheimer's disease using low-frequency ultrasound with microbubbles.
blood-brain barrier,low-frequency ultrasound,microbubbles,Alzheimer's disease,Beta amyloid protein(Aβ)
R454
A
1674-1242(2015)03-0153-06
10.3969/j.issn.1674-1242.2015.03.007
2015-07-07)
深圳市战略新兴产业发展专项资金基础研究项目(JCYJ20140828163634004)
陈高舒,研究生,研究方向:生物医学工程,E-mail:1573437216@qq.com
沈圆圆,讲师,硕士生导师,E-mail:shenyy@szu.edu.cn