HPLC法测定猴头菇核苷类成分腺苷的含量
2015-06-01岳显可杜伟锋
岳显可,曹 岗,吴 瑶,陈 忠,杜伟锋*
HPLC法测定猴头菇核苷类成分腺苷的含量
岳显可1,2,曹 岗1,吴 瑶1,陈 忠2,杜伟锋1*
目的 建立HPLC法测定猴头菇中核苷类成分腺苷的含量。方法 采用HPLC法,分别对系统适用性、准确性、重复性、线性范围、耐用性进行研究;分别考察样品制备的提取方法、提取溶剂、提取时间和料液比。结果 本方法的系统适用性、准确度、重复性、线性范围、耐用性均符合要求。结论 本法科学合理、准确可靠,可作为猴头菇药材中腺苷含量测定的分析方法。
猴头菇;腺苷;HPLC
0 引言
猴头菇又名猴头菌、刺猬菌、山伏菌或花菜菌等,性平味甘,入胃经,有助于消化,利五脏,扶正固本,具有健脑提神的功效[1]。猴头菇含多糖、多肽类、氨基酸等物质,具有免疫调节、保护胃肠道等作用。临床上常用于治疗胃溃疡与十二指肠溃疡等消化道疾病,疗效良好[2-3]。腺苷作为一种重要的核苷类成分,具有防止心律失常、改善心脑血液循环、抑制神经递质释放等药理作用[4-5]。猴头菇中含有较大含量的腺苷[2],后者为猴头菇的重要物质组成部分,因此,以腺苷作为指标对猴头菇质量进行评价具有重要意义。
1 仪器与试药
1.1 仪器 Ultimate3000型高效液相色谱仪(美国戴安公司),KS-80中草药粉碎机(天津泰斯特仪器有限公司),R-201恒温水浴锅(上海申生科技有限公司),十八烷基硅烷键合硅胶为填充剂:Inertsil ODS-SP Extend C18(250 mm × 4.6 mm,5.0 μm)。
1.2 试药 猴头菇药材(批号:20140417),产地东北,购于浙江中医药大学中药饮片有限公司。腺苷对照品(批号:110879-200202)购自中国药品生物制品检定所。甲醇为色谱纯,水为重蒸水,乙醇为分析纯。
2 提取方法考察
2.1 溶剂的选择 以超声时间45 min、超声频率40 Hz、料液比1∶40为条件,分别以甲醇体积分数为0、20%、40%、60%、80%、100%进行提取,考察甲醇体积分数对猴头菇腺苷提取量的影响。如图1所示,甲醇体积分数为0时(水提取),腺苷得率最高。
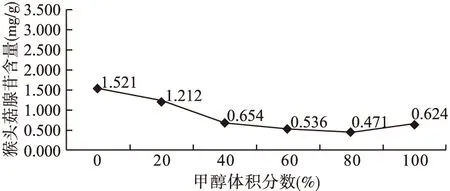
图1 甲醇体积分数对猴头菇腺苷含量的影响
2.2 超声时间的选择 以水为提取溶剂、超声频率40 Hz、料液比1∶40为条件,分别超声15、30、45、60、75、90 min进行提取,考察超声时间对猴头菇腺苷提取量的影响。如图2所示,不同超声时间所得猴头菇腺苷得率差异无统计学意义,故选择45 min为超声提取时间。
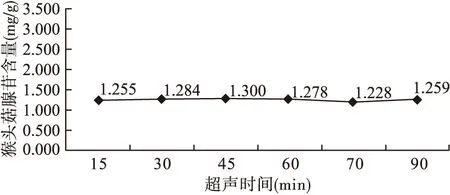
图2 超声时间对猴头菇腺苷含量的影响
2.3 超声频率的选择 以水为提取溶剂、超声时间45 min、料液比1∶40为条件,分别超声频率20、30、40、50、60、70 Hz进行提取,考察超声频率对猴头菇腺苷提取量的影响。如图3所示,不同超声频率下的猴头菇腺苷得率差异无统计学意义,故选择40 Hz为超声频率。
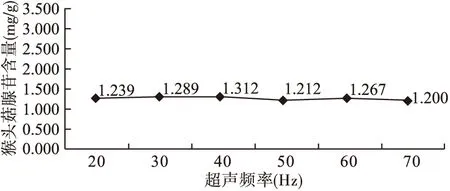
图3 超声频率对猴头菇腺苷含量的影响
2.4 料液比的选择 以水为提取溶剂、超声时间45 min、超声频率40 Hz为条件,分别以料液比1∶30、1∶40、1∶50、1∶60、1∶70、1∶80进行提取,考察料液比对猴头菇腺苷提取量的影响。如图4所示,不同的料液比所得猴头菇腺苷得率差异无统计学意义,故选择料液比1∶50进行提取。
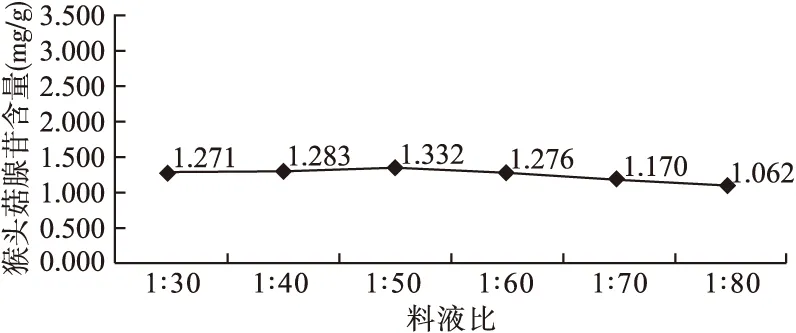
图4 料液比对猴头菇腺苷含量的影响
2.5 猴头菇腺苷提取工艺的优化
2.5.1 猴头菇水提物稳定性考察 对猴头菇水提液样品进行稳定性考察,结果发现,在32 h内,猴头菇腺苷含量由0 h的1.350 mg/g降至32 h的0.071 mg/g。见图5。由图5可知,猴头菇水提物的稳定性差。

图5 猴头菇水提液腺苷稳定性趋势
2.5.2 猴头菇腺苷转移率考察 取猴头菇水提物滤液5 mL,蒸干,加甲醇溶解,于5 mL容量瓶定容。对水提液中的腺苷含量与转移后的腺苷含量进行比较,并计算转移率,见表1。由表1可知,先水提,蒸干,再以甲醇溶解,腺苷含量的平均转移率为99.97%。

表1 猴头菇腺苷转移率
2.5.3 优化后猴头菇供试品的稳定性 转移后,样品溶剂为甲醇,比较30 h内猴头菇腺苷的变化情况,结果RSD=1.14%,见表2。

表2 猴头菇供试品稳定性考察结果
2.6 提取方法的确定 通过上述实验,确定猴头菇腺苷的提取方法:以水为提取溶剂,在超声频率为40 Hz、料液比为1∶50下超声45 min,取滤液5 mL,蒸干,加甲醇溶解,于5 mL容量瓶定容,供试液过膜净化,取相应量进样,检测。
3 色谱条件的考察
3.1 波长的选择 取适量腺苷标准品1.62 mg于10 mL容量瓶中,加甲醇溶解,定容,再精密吸取1 mL于20 mL容量瓶中,加甲醇定容,进行标准测定。取对照品溶液,置紫外分光光度计下记录其紫外吸收光谱,结果显示,腺苷在260 nm波长处有最大吸收,故选择260 nm为测定波长。
3.2 色谱条件 用十八烷基硅烷键合硅胶为填充剂:Inertsil ODS-SP Extend C18(250 mm×4.6 mm,5.0 μm)。甲醇为流动相A,水为流动相B,梯度洗脱:0~10 min,1%~5%A;10~15 min,5%~15% A;15~20 min,15%~20% A;20~30 min,20% A;30~35 min,20%~35% A;35~40 min,35%~1% A。柱温25 ℃,流速1 mL/min,检测波长为260 nm。色谱图见图6。

图6 腺苷标准品(A)及猴头菇样品(B)色谱图
3.3 线性关系考察 以进样量(μg)为横坐标、测定峰面积为纵坐标做标准曲线。并以最小二乘法计算得回归方程:Y=0.066 5 X+0.134 6,R2=0.999 9,结果显示,进样量在16.2~97.2 μg/mL范围内有良好的线性关系。结果见表3。
3.4 精密度考察 取供试品溶液,按以上色谱条件,重复进样6次,测定峰面积,结果RSD为0.51%(n=6),见表4。
3.5 准确度考察 精密称取已知含量的猴头菇样品(批号:20140417)6份,精密加入腺苷对照品适量,按上文方法提取,测得峰面积并计算含量。平均回收率为96.81%,RSD=0.33%。见表5。

表3 腺苷线性关系考察结果
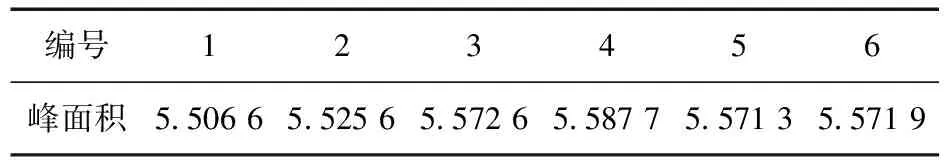
表4 腺苷精密度考察结果

表5 腺苷回收率试验结果(mg/g)
4 系统适用性考察
4.1 检测波长的考察 色谱柱:十八烷基硅烷键合硅胶为填充剂:Inertsil ODS-SP Extend C18(250 mm×4.6 mm,5.0 μm);流动相:如上述流动相梯度洗脱;流速:1.0 mL/min;柱温:25 ℃。精密吸取供试品溶液和对照品溶液各10 μL,分别进样,按不同波长条件下测定,见表6。

表6 不同检测波长耐用性试验结果
4.2 柱温考察 色谱柱、流动相、流速同“4.1”项下内容,波长:260 nm。精密吸取供试品和对照品各10 μL,分别进样,在不同柱温条件下测定,结果见表7。
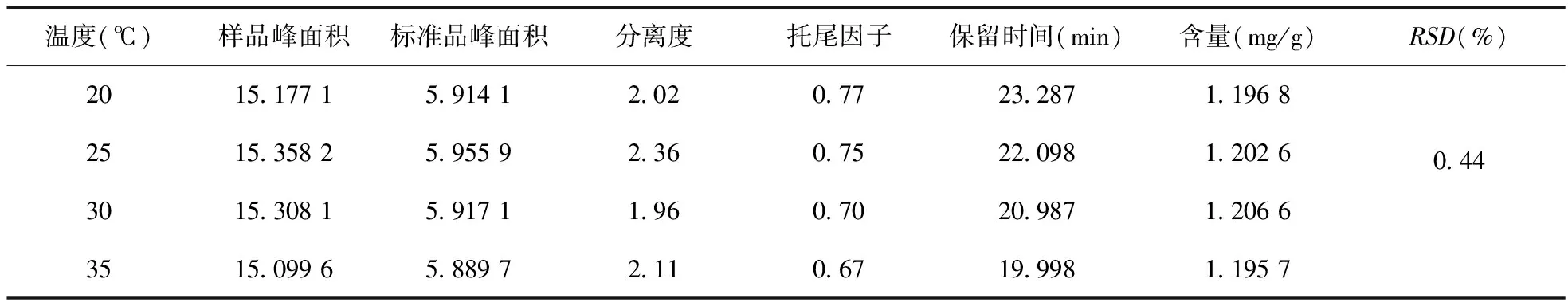
表7 不同柱温耐用性试验结果
4.3 流速考察 色谱柱、流动相、柱温同“4.1”项下内容,波长:260 nm。精密吸取供试品溶液和对照品溶液各10 μL,分别进样,在不同流速条件下进行测定,结果见表8。
4.4 流动相组成比例考察 色谱柱:流速、柱温同“4.1”,波长:260 nm。精密吸取供试品和对照品各10 μL,分别进样,在20~30 min处对流动相组成比例进行变换测定,见表9。

表8 不同流速耐用性试验结果

表9 不同流动相比例耐用性试验结果
4.5 样品测定及重复性考察 精密称取同一批号猴头菇样品6份,按正文方法提取,测定峰面积,并计算腺苷含量(mg/g),结果见表10。

表10 猴头菇供试品重复性考察结果
5 结论
5.1 提取方法的选择 本试验先对提取溶剂、超声时间、超声频率、料液比等单因素进行考察,筛选以水为提取溶剂、料液比1∶50、40 Hz频率下超声45 min,腺苷提取率最高。然而,通过稳定性考察,猴头菇水提液稳定性差,在32 h内猴头菇腺苷由0 h的1.350 3 mg/g降至0.071 3 mg/g。因此,本试验对水提液蒸干,甲醇再溶,腺苷转移率达到99.97%,且样品在30 h内检测,含量无显著性变化,RSD为1.14%。故水提醇溶为猴头菇腺苷的最优提取工艺。
5.2 色谱条件的选择 本研究对检测波长、柱温、流速、流动相等进行耐用性考察,结果均符合要求。同时也对线性关系、精密度、准确度及重复性进行测定,最后筛选猴头菇腺苷的最佳检测条件为以岛津Inertsil ODS-SP Extend C18(250 mm×4.6 mm,5.0 μm)为色谱柱,甲醇(A)-水溶液(B)为流动相梯度洗脱(0~10 min,1%~5%A;10~15 min,5%~15% A;15~20 min,15%~20% A;20~30 min,20% A;30~35 min,20%~35% A;35~40 min,35%~1% A),流速:1 mL/min,柱温:25 ℃,检测波长:260 nm,进样量为10 μL。
5.3 前景与展望 猴头菇作为一种大型真菌,营养丰富,是珍贵的药膳兼用菌。在保肝护肝、健脾益胃和抗癌均有一定疗效[6-7]。鉴于猴头菇的营养价值,目前猴头菇胶囊、猴头菇保健醋等已被开发并进入市场。为确保猴头菇及相关产品的安全、有效,本试验以腺苷为评价指标,建立猴头菇质量标准,为进一步研究和开发猴头菇奠定基础。
[1] 周萍,李新胜,王朝川,等.常见的用于保健及预防疾病的食用菌种类[J].中国果蔬,2012,(6):59-60.
[2] 李洁莉,陆玲,陈坤,等.猴头菌及其药物制品腺苷等药效成分分析[J].中国食用菌,2002,21(3):32-34.
[3] 周静安.RP-HPLC测定复方猴头颗粒制剂中腺苷的含量[J].中成药,2005,27(2):213-214.
[4] 郝宇华,高春霖.腺苷对缺血心肌的保护作用[J].医学综述,2008,14(5):769.
[5] 臧伟进,孙蕾,于晓江.腺苷和乙酰胆碱后适应诱导的心肌保护作用[J].生理学报,2007,59(5):593.
[6] 仲启祥,朱锦福,刁治民.蕈菌猴头菇的经济价值及开发应用[J].青海草业,2010,(3):13-17.
[7] 王薇.猴头菇的营养保健功能及其在食品工业中的应用[J].食品与药品,2006,(4):24-26.
Determination of the nucleosides of adenosine in Hericium erinaceus by HPLC
YUE Xian-ke1,2,CAO Gang1,WU Yao1,CHEN Zhong2,DU Wei-feng1*
(1.Zhejiang Chinese Medical University,Hangzhou 310053,China; 2.Medical Pieces LTD,Zhejiang Chinese Medical University,Hangzhou 311400,China)
Objective To establish an HPLC method for determining the nucleosides of adenosine in Hericium erinaceus.Methods The suitability,accuracy,repeatability,linearity,linear range and durability were studied by HPLC.The main factors affecting sample solution were observed,including extraction method,extraction solvent,extraction time and solid-liquid ratio.Results The suitability,accuracy,repeatability,linearity,linear range durability of the method all met the relative requirements.Conclusion This method can be applied as the quantity determination of adenosine in Hericium erinaceus with good accuracy and reliability.
Hericium erinaceus; Adenosine; HPLC
2014-08-03
1.浙江中医药大学,杭州 310053;2.浙江中医药大学中药饮片有限公司,杭州 311400
*通信作者
10.14053/j.cnki.ppcr.201504016
