探讨血浆同型半胱氨酸水平与阿尔茨海默病患者认知功能评分的相关性
2015-06-01王变荣时建铨顾小花韦存胜潘晓东孙奕张长春徐俊
王变荣 时建铨 顾小花 韦存胜 潘晓东 孙奕 张长春 徐俊
探讨血浆同型半胱氨酸水平与阿尔茨海默病患者认知功能评分的相关性
王变荣 时建铨 顾小花 韦存胜 潘晓东 孙奕 张长春 徐俊
目的 探讨血浆同型半胱氨酸(Hcy)水平与阿尔茨海默病(AD)患者认知功能评分的相关性。 方法 选取AD患者39例,认知功能正常者44例,收集2组患者性别、年龄、受教育程度、24 h平均血压、血糖、总胆固醇、Hcy情况,采用Addenbrooke改良认知评估量表(ACE-R)及认知障碍简明评价表(Cog-12)进行认知功能测评,利用Logistic回归模型分析影响认知功能减退的危险因素。 结果 AD组Hcy水平高于认知功能正常组,差异具有统计学意义(P<0.05); Logistic回归分析显示年龄和Hcy是认知功能减退的危险因素, Hcy水平与注意力定向力、记忆、语言、视空间评分有相关性,与语言流利性评分无明显相关性。 结论 高Hcy是老年患者认知功能减退的危险因素。
阿尔茨海默病; 同型半胱氨酸; Addenbrooke改良认知评估量表; 认知障碍简明评价表
阿尔茨海默病(Alzheimer’s disease,AD)是以进行性认知功能障碍和精神行为损害为特征的中枢神经系统退行性病变,随着人口老龄化进展,AD已成为严重致残疾病之一,早期诊断、早期治疗成为临床探索重点。而AD发病机制尚未明确,脑脊液中β淀粉样蛋白(Aβ)和 tau 蛋白是AD诊断主要生物标志物,但由于老年患者脑脊液获取困难,使其在临床应用中受到限制,寻找简便准确的生物标志物成为研究热点。越来越多证据表明,血管性危险因素在AD发病及进展中起重要作用,高同型半胱氨酸(homocysteine,Hcy)与AD发病具有一定相关性,多项横断面及纵向研究表明高Hcy血症是认知功能损害的独立危险因素[1-3],但也有些研究认为高Hcy与认知损害无关[4]。血清Hcy能否成为AD外周标志物值得探讨。
Addenbrooke改良认知评估量表(the Addenbrooke’s cognitive examination-revised, ACE-R)对 AD的研究已得到国际上认可并得到广泛的运用。本研究旨在探讨血清Hcy水平与ACE-R评分相关性,以期发现Hcy是否为AD危险因素,为AD早期诊断、干预提供新靶点。
1 资料和方法
1.1 研究对象 选取2013年9月至2014年7月江苏省老年医院神经科病房及记忆减退门诊就诊AD患者39例,认知功能正常者44例,研究对象共83例,男49例,女34例,男女比例为1.4:1;AD组男25例,女14例,认知正常组男24例,女20例,2组患者性别比例无明显统计学差异(P=0.105);AD组年龄为62~90岁,平均(79.03±7.51)岁,认知正常组年龄为55~82岁,平均(68.75±9.89)岁,2组患者年龄具有统计学差异(P=0.000);所有患者均接受教育,受教育时间3~15年,平均(11.96±3.44)年。上述患者诊断符合美国精神病学会制定的第四版精神疾病诊断与统计手册。排除标准:(1)急性心脑血管病患者;(2)既往或现在正在饮酒或吸烟者;(3)合并抑郁、其他影响认知功能疾病者;(4)正在服用维生素B6、B12、叶酸及其他影响Hcy代谢药物者。
1.2 方法
1.2.1 血浆Hcy水平测定:空腹静脉采血3 ml,EDTA抗凝并分离血浆,采用循环酶法在罗氏P800全自动生化分析仪上检测血浆Hcy,正常参考值范围为5~15 μmol/L。
1.2.2 认知功能评估:(1)ACE-R量表:因ACE-R包含了简易智能状态检查量表(mini-mental state examination, MMSE),研究对象应用ACE-R进行认知测评的同时也可以得到 MMSE的结果。ACE-R总分为100分,目前常用的认知功能损害筛查界值是ACE-R≤83分[5],MMSE 总分为30分,根据教育程度以下列临界值为认知功能损害筛查界值,文盲组<17分,小学组<20分,中学组<22分,大学或以上组<23分。(2)认知障碍简明评价表(cognitive-12 scale,Cog-12):由2部分组成,第一部分是对患者思维判断及学习记忆能力的评估,即AD8部分;第二部分是新增部分,主要是对患者精神行为及语言能力的检查,包括心理情绪、行为异常、个性改变及语言能力4个方面的内容,每一项均从无到显著影响日常生活能力分为5个等级,记为0~4 分。 Cog-12评分越高,表示其认知功能越差。所有量表均由经统一培训的神经内科专业医师进行评估,所有受试者在评估期间均保持良好的精神状态和较好的依从性,并签署知情同意书。
1.2.3 糖化血红蛋白、总胆固醇、24 h平均血压测定:留取空腹静脉血5 ml,分离血清,采用罗氏P800全自动生化分析仪检测总胆固醇,采用ELISA法测定空腹抗凝静脉血中糖化血红蛋白水平。应用Mobil-O-Graphy动态血压监测系统对所有患者进行血压监测,取平均血压值作为该患者的收缩压(SBP)和舒张压(DBP)。
1.3 统计学处理 采用SPSS 16.0统计软件。计量资料以均数±标准差表示,组间比较用t检验,采用Pearson 相关分析及Logistic回归分析AD影响因素,P<0.05为差异有统计学意义。
2 结果
2.1 2组基本资料、认知功能与Hcy关系 2组间患者年龄比较具有统计学差异(P=0.000),文化程度在2组之间无明显差异(P=0.106),2组患者平均血压、糖化血红蛋白、总胆固醇之间无明显差异(P>0.05)。AD组血Hcy水平明显高于认知正常组,差异具有统计学意义(P=0.002),AD组Cog-12评分显著高于认知正常组(P=0.000)。AD组MMSE评分、ACE-R评分显著低于认知正常组(P<0.01)。见表1。

表1 2组基本资料、生化及认知功能指标比较
注:与认知正常组比较,**P<0.01
2.2 Hcy与认知功能关系 将研究对象分为高Hcy组(Hcy≥15 μmol/L)和正常Hcy组(Hcy<15 μmol/L),观察2组间认知功能差异。2组患者的年龄、文化程度、平均血压、糖化血红蛋白、总胆固醇比较无统计学差异(P>0.05)。2组患者MMSE、Cog-12、ACE-R评分差异具有统计学意义(P<0.05)。2组研究对象之间注意力及定向、记忆、语言及视空间评分均具有统计学差异(P<0.05), 语言流利性评分无统计学差异。见表2。
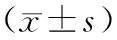
表2 2组患者一般资料、生化指标及认知功能评分
注:与正常Hcy组比较,*P<0.05,**P<0.01
2.3 Hcy与认知功能评分相关性分析 Hcy与认知功能评分相关分析结果显示,Hcy与MMSE、ACE-R评分呈负相关,与Cog-12评分成正相关(P<0.05),Hcy水平与MMSE、Cog-12、ACE-R、注意力和定向、记忆力、语言、视空间具有相关性,与语言流利性无相关性。Hcy水平与年龄、文化程度无明显相关性(P>0.05)。
2.4 认知功能的影响因素分析 将年龄、性别、文化程度、Hcy、糖化血红蛋白、平均血压、总胆固醇进行多因素Logistic回归分析,结果显示,高年龄、高Hcy是认知功能损害的独立危险因素(P<0.05或0.01)。见表3。
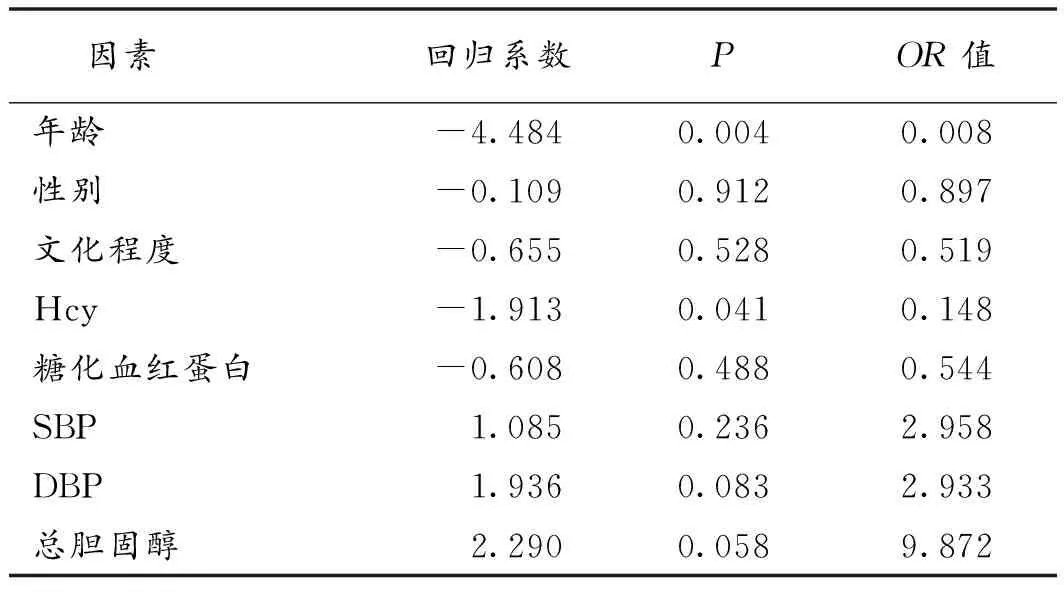
表3 认知功能减退的影响因素
3 讨论
神经心理评估在AD临床诊断中具有重要作用,MMSE因其简便快速而成为AD常用认知功能评估量表,但MMSE涵盖认知领域较少,主要关注记忆和语言功能,缺少对执行功能、抽象思维等的评估,同时存在“天花板效应”和“地板效应”,故对AD诊断缺乏敏感性。ACE量表是由英国剑桥大学制定的认知功能评估工具[6],而Mioshi等[7]于2006年对ACE量表进行了修正,使其具有更高的准确性以及心理学特性,称之ACE-R。ACE-R不仅是对MMSE的扩展,更能对认知功能多个领域进行快速评估,尤其是非记忆功能有独特优势,ACE-R测评包含注意力及定向、记忆、语言流利性、语言及视空间等多个项目,但ACE-R缺乏对情绪情感障碍、行为异常的评价,而这2项是AD重要症状,并加重认知损害,为此本课题组制定了认知障碍简明评价表(Cog-12)。Cog-12对中重度AD患者有较好的区分能力,其敏感度高达90.9%,特异度达70.5%[8],其对早期轻度AD及轻度认知功能障碍也具有较高敏感性。Cog-12与ACE-R评分存在显著负相关[9],其操作简便快速,可作为ACE-R测评的简化版,同时还可以早期发现受试者情绪改变及行为异常。工作人员通过问卷和图片等形式进行测试,其包括5个方面神经心理学领域:定向和注意力、记忆、语言流利性、语言、视觉空间功能,总分为100分[10]。无论从定性和定量的角度,还是对于患者的认知特征,各个认知测试项目都能提供一个更完整的描述,进而更加全面了解AD的认知功能,并且ACE-R对认知功能的检测具有较高的敏感性[10]。课题组的前期研究以ACE-R量表作为Cog-12 量表的效度检验标准,结果显示Cog-12量表与ACE-R呈显著负相关,且相关程度显著优于MMSE,提示Cog-12量表对于认知功能检测具有良好的效度[9]。
Hcy是人体内含硫氨基酸的一个重要的代谢中间产物,高Hcy血症被认为是冠心病、脑梗死等心脑血管疾病的新型危险因子[11]。越来越多证据提示高Hcy与痴呆患者认知功能减退有关[12-13],研究者发现在正常老年患者及轻度认知功能障碍患者中Hcy水平升高也与认知功能下降相关[14]。
Hcy对认知功能影响可能是通过血管和神经双重损害发挥作用。其机制可能包括以下方面:(1)对神经系统的直接毒性:Hcy可激活 N-甲基D-天门冬氨酸受体,其具有神经细胞毒性,转化产物具有兴奋毒性作用,促进神经细胞死亡;(2)高水平的Hcy能提高细胞内活性氧的合成量,同时对细胞内的抗氧化系统酶类产生抑制作用,能够直接提高内皮细胞内的氧化损伤程度,使一氧化氮等血管活性物质分泌增加,增加血管扩张功能的紊乱;(3)高Hcy与叶酸、维生素B6、维生素B12缺乏相关[15];(4)高Hcy与脑梗死、脑萎缩、海马萎缩、无症状性腔隙性脑梗死相关[16-17];(5)动物实验显示高水平Hcy加速转基因AD小鼠Aβ沉积及tau蛋白磷酸化[18],而Aβ及tau蛋白是目前公认的AD两大病理损害。
本课题选取研究对象文化程度相对较高,平均受教育(11.96±3.44)年,AD组及对照组文化程度无明显差异,这与Collie等[19]的研究结果一致,他们发现认知功能与受教育年限无关。本课题所测血压、血脂、血糖均为经药物控制后水平,正常对照组与AD患者之间在血压、总胆固醇、糖化血红蛋白水平无统计学差异,但不能排除血压、血脂、血糖也是AD发病的危险因素。Elias等[14]报道认为年龄与血浆Hcy存在明显正相关性,而我们数据显示Hcy水平与年龄无关,这可能与不同人群饮食习惯及生活方式等差异有关。早期研究发现年龄是认知功能减退的独立危险因素,本研究再次证实了该观点。本研究同时发现Hcy升高是认知功能减退的独立危险因素,Hcy水平与MMSE及ACE-R评分呈负相关,与Cog-12评分呈正相关,Hcy水平与MMSE、ACE-R、注意力和定向、记忆力、语言及视空间评分具有相关性,与语言流利性评分无相关性,提示其可能在AD发生发展中起到一定作用,但本文样本量偏少,尚需大规模随机对照试验进一步证实。Cog-12量表与MMSE及ACE-R评分存在显著负相关,对AD患者检测灵敏度高,并且可以早期发现患者情绪情感障碍及行为异常,量表简单易懂,评估方便快速,值得临床推广。
[1] Schafer JH, Glass TA, Bolla KI, et al. Homocysteine and cognitive function in a population-based study of older adults[J]. J Am Geriatr Soc, 2005, 53(3): 381-388.
[2] Seshadri S, Beiser A, Selhub J, et al. Plasma homocysteine as a risk factor for dementia and Alzheimer’s disease[J]. N Engl J Med, 2002, 346(7): 476-483.
[3] Prins ND, den Heijer T, Hofman A, et al. Homocysteine and cognitive function in the elderly: the Rotterdam Scan Study [J]. Neurology, 2002, 59(9): 1375-1380.
[4] Luchsinger JA, Tang MX, Shea S, et al. Plasma homocysteine levels and risk of Alzheimer disease[J]. Neurology, 2004, 62(11): 1972-1976.
[5] Reyes MA,Perez-Lloret S,Roldan Gerschcovich E,et al. Addenbrooke’s Cognitive Examination validation in Parkinson’s disease[J].Eur J Neurol, 2009, 16(1):142-147.
[6] Mathuranath PS,Nestor PJ,Berrios GE,et al.A brief cognitive test battery to differentiate Alzheimer’s disease and frontotemporal dementia[J].Neurology, 2000, 55(11):1613-1620.
[7] Mioshi E,Dawson K,Mitchell J,et al.The Addenbrooke’s cognitive examination revised(ACE-R):a brief cognitive test batery for dementia screening[J].Int J Geriatr Psychiatry, 2006, 21(11):1078-1085.
[8] 梅刚,陆蓉,徐俊,等.认知障碍初步评价表在中重度阿尔茨海默病中的初步应用[J]. 南京医科大学学报:自然科学版, 2014,34(5):637-640.
[9] 韦存胜,徐俊,孙彬,等.Cog-12量表在筛查慢性肾衰竭患者认知功能障碍中的应用[J].中国神经免疫与神经病学杂志, 2014,21(5):319-322.
[10]蔡荇, 徐俊. Addenbrooke 改良认知评估量表的研究和应用[J].实用老年医学,2015,29(3):245-248.
[11]Selhub J, Jacques PF, Bostom AG, et al. Association between plasma homocysteine concentrations and extracranial carotidartery stenosis [J]. N Engl J Med, 1995, 332(5):286-291.
[12]Petras M, Tatarkova Z, Kovalska M, et al. Hyperhomocysteinemia as a risk factor for the neuronal system disorders[J]. J Physiol Pharmacol, 2014, 65(1):15-23.
[13]Hooshmand B, Polvikoski T, Kivipelto M, et al. Plasma homocysteine, Alzheimer and cerebrovascular pathology: a population-based autopsy study[J]. Brain, 2013, 136(Pt 9):2707-2716.
[14]Elias MF, Sullivan LM, D’Agostino RB, et al. Homocysteine and cognitive performance in the Framingham Offspring Study: age is important [J]. Am J Epidemiol, 2005, 162(7):644-653.
[15]Smith AD. Homocysteine, B vitamins, and cognitive deficit in the elderly [J]. Am J Clin Nutr, 2002, 75(5):785-786.
[16]Matsui T, Arai H, Yuzuriha T, et al. Elevated plasma homocysteine levels and risk of silent brain infarction in elderly people [J]. Stroke, 2001, 32(5):1116-1119.
[17]David Smith A, Smith SM, de Jager CA, et al. Homocysteine-lowering by B vitamins slows the rate of accelerated brain atrophy in mild cognitive impairment: a randomized controlled trial [J]. PLoS One, 2010, 5(9):e12244.
[18]Li JG, Chu J, Barrero C, et al. Homocysteine exacerbates β-amyloid pathology, tau pathology, and cognitive deficit in a mouse model of Alzheimer disease with plaques and tangles[J].Ann Neurol,2014, 75(6):851-863.
[19]Collie A, Maruff P, Shafiq-Antonacci R, et al. Memory decline in healthy older people implications for identifying mild cognitive impairment[J]. Neurology, 2001, 56(11):1533-1538.
Relationship between plasma homocysteine and cognitive functions in Alzheimer’s disease patients
WANGBian-rong,GUXiao-hua,WEICun-sheng,PANXiao-dong,SUNYi,ZHANGChang-chun,XUJun.DepartmentofNeurology,JiangsuProvinceGeriatricHospital,Nanjing210024,China;SHIJian-quan,DepartmentofNeurology,NanjingHospitalAffiliatedtoNanjingMedicalUniversity,Nanjing210006,China
Objective To investigate the relationship between plasma homocysteine (Hcy) and cognition function assessed by Addenbrooke’s Cognitive Examination-Revised (ACE-R) and Cognitive-12 scale (Cog-12) in patients with Alzheimer’s disease(AD). Methods Thirty-nine patients with AD and forty-four healthy controls were enrolled in the study. The general clinical data and serum biochemical were collected. Cognitive functions were assessed using ACE-R and Cog-12 scale. Multiple Logistic regression analysis was conducted to investigate the risk factors of the decrease of cognitive functions. Results Hcy level in AD group was significantly higher than that in control group(P<0.05). Statistically significant inverse association was found between plasma Hcy and ACE-R scores after adjustment for age, education years, mean blood pressure,glycosylated hemoglobin and total cholesterol. Statistically significant negative correlation was found between plasma Hcy level and orientation, attention, memory, language and visuospatial scores of ACE-R scale but not verbal fluency scores. Statistically significant positive correlation was found between plasma Hcy level and Cog-12 scale. Conclusions Hcy level is the risk factor of dementia in elderly subjects.
Alzheimer’s disease; homocysteine; Addenbrooke’s cognitive examination-revised; cognitive-12 scale
210024江苏省南京市,江苏省老年医院神经科(王变荣,顾小花,韦存胜,潘晓东,孙奕,张长春,徐俊); 210006江苏省南京市,南京医科大学附属南京医院神经科(时建铨)
徐俊,Email: neurojun@126.com
R 749.16
A
10.3969/j.issn.1003-9198.2015.11.010
2015-01-16)
