康柏西普对高糖环境下人视网膜微血管内皮细胞屏障功能及VEGF表达的影响*
2015-06-01张婷李明新
张婷 李明新
(1.徐州医学院;2.徐州医学院附属医院,江苏徐州221000)
康柏西普对高糖环境下人视网膜微血管内皮细胞屏障功能及VEGF表达的影响*
张婷1李明新2
(1.徐州医学院;2.徐州医学院附属医院,江苏徐州221000)
目的探讨康柏西普对高糖环境下人视网膜微血管内皮细胞屏障功能及VEGF表达的影响。方法将人视网膜血管内皮细胞分为正常组(5.5mol/L葡萄糖)、高糖组(25mol/L葡萄糖)、高糖+不同浓度(25μg/L、2.5 μg/L、0.25μg/L)的康柏西普组。应用酶联免疫吸附测定(ELISA)检测各组细胞上清液中血管内皮生长因子(VEGF)的浓度;跨膜电阻(TER)及辣根过氧化物酶(HRP)通透性的检测,以评价细胞屏障的稳定性;蛋白质印迹法(Western Blot)检测紧密连接相关蛋白occludin的表达。结果ELISA结果示:高糖组分泌的VEGF比正常组高,增加差异具有统计学意义(P<0.05),各康柏西普组能抑制高糖环境下人视网膜微血管内皮细胞VEGF的分泌; Western blot示:25μg/L、2.5μg/L康柏西普组occludin蛋白表达量较高糖组高(P<0.05),但0.25μg/L康柏西普与高糖组无明显差异(P>0.05);TER值、HRP通透性检测示:康柏西普能抑制高糖组TER值的降低,并抑制HRP通透性的增加。结论康柏西普对高糖环境下血视网膜内屏障具有一定的保护作用,其机制可能与VEGF有关。
康柏西普;高糖;视网膜微血管内皮细胞;屏障功能
糖尿病视网膜病变(diabetic retinopathy,DR)是糖尿病相关眼病的最为严重的并发症,DR引起的黄斑水肿(DME),也是世界上最常见的致盲眼疾[1]。血管内皮生长因子(vascular endothelial growth factor,VEGF)在糖尿病视网膜病变的发病机制中具有重要的作用,VEGF的高表达在DR的各期均可出现[2],而过多的VEGF会破坏血-视网膜屏障(blood-retinal barrier,BRB)的形成及功能[3-4]。内层血-视网膜屏障主要由视网膜微血管内皮细胞及细胞之间的连接共同构成,阻碍血液的渗透及内源性物质和外源性物质在视网膜中的自由扩散,以稳定视网膜内环境。近年来,抗VEGF药物在减轻血管渗漏和改善黄斑水肿的治疗中取得了一定的进展,使患者的视力得到了一定的改善[5-7]。本研究旨在探讨康柏西普对高糖环境下人视网膜微血管内皮细胞(human retinalmicrovascular endothelial cells,hRMECs)内屏障的影响。
1 材料与方法
1.1 材料人视网膜微血管内皮细胞(上海拜力公司,编号:6520);高糖DMEM(美国Hyclone公司),低糖DMEM(美国Hyclone公司);胎牛血清(上海玉博);0.25%胰酶(碧云天);青链霉素(碧云天);人血管内皮生长因子酶联免疫吸附法(enzyme linked immunosorbant assay,ELISA)试剂盒(上海玉博);兔源性occludin抗体(美国Abcam公司);碱性磷酸酶标记山羊抗兔IgG抗体(北京中杉金桥);6孔板、24孔板(美国corning公司);Millicell插入式培养皿(美国millipro公司);辣根过氧化物酶(美国sigma公司);TBM显色剂(碧云天);蛋白质印迹法相关试剂(碧云天);康柏西普(成都康弘)。
1.2 方法与步骤
1.2.1 人视网膜微血管内皮细胞的培养采用含10%胎牛血清的低糖DMEM(5.5 mmol/L的葡萄糖)在37℃、5%CO2饱和湿度培养箱中培养,每2~3天传代1次,取对数生长期细胞用于实验。
1.2.2 实验分组细胞经胰酶消化后,以适当比例接种于6孔、24孔细胞培养板中,待其贴壁后,用含5%胎牛血清DMEM低糖培养基培养24 h使细胞生长同步化,将细胞分组,分别给予如下干预:正常组(N组,5.5 mmol/L的葡萄糖)、高糖组(H组,25 mmol/L的葡萄糖)、高糖+康柏西普组(H125μg/ m l、H22.5μg/ml、H30.25μg/ml)。
1.2.3 VEGF的检测以4×105个/孔的密度将细胞接种于6孔板中,按实验分组进行干预,再培养24小时后收集上清液,,按照人血管内皮生长因子ELISA试剂盒说明进行操作。酶标仪450 nm波长处读取A值,绘制标准曲线,查出相应VEGF的浓度。
1.2.4 跨细胞膜电阻(TER)的检测应用细胞电阻仪(EVOM)测定各组细胞24 h、46 h、48 h、60 h、72 h的TER值,未接种细胞,仅有培养液的实验孔为空白对照。将STX2筷式电极的短臂与长臂分别置于millicell插入式培养池的内、外室,待读数稳定后记录数值,每个培养池测量3次,取平均值[8]。RPE细胞TER值=(实验孔电阻值-空白孔电阻值)/0.33,单位为Ω/cm2。
1.2.5 HRP通透性的检测以5×104个/ml的密度将hRMECs细胞悬液500μl接种于Millicell插入式细胞培养皿(直径6.5 mm,孔径0.4μm)上;常规条件下培养待其铺满单层,加药干预24小时后,上室加入50 mg/L的HRP,2 min后收集下室液体以10μl/孔置于96孔板中,加入200μl TMB显色液,15 min后用酶标仪测定A值,用A值反映血管内皮细胞的相对通透性[9]。实验重复3次,取均值。
1.2.6 Western blot检测occludin蛋白的表达提取各组细胞的总蛋白,加入80μl含蛋白酶抑制剂的细胞裂解液,冰上裂解30 min,将各组蛋白浓度调一致后,加入上样缓冲液,沸水煮5分钟。取蛋白样品于SDS-PAGE凝胶中电泳,待目的蛋白接近凝胶底部时停止电泳,4℃、120 V恒压电转移至PVDF膜上,质量分数5%脱脂奶粉室温封闭2 h,稀释的一抗4℃过夜,漂洗后,稀释的二抗室温孵育1小时。漂洗后用ECL定影、显影,并扫描分析。用Image J医学图文分析系统分析图像,测定其灰度值。以β-actin为参照,测定occludin蛋白的相对表达量。
1.2.7 统计学处理采用SPSS15.0统计软件包进行数据处理,计量资料用均数±标准差描述,方差齐时多组间比较采用单因素方差分析,进一步两两比较采用LSD-t检验,方差不齐时用Welch校正后使用Dunnett’s T3检验。检验水准α=0.05,当P≤0.05,认为差异有统计学意义。
2 结果
2.1 VEGF的浓度检测结果各组VEGF浓度见图1。正常组、高糖组及高糖加药组(25μg/m l、2.5 μg/ml、0.25μg/ml)的VEGF浓度分别为(73.10± 3.32)、(162.06±4.80)、(3.95±2.40)、(11.02± 2.25)、(29.73±2.98)pg/ml,H组与N组相比VEGF浓度明显增加,差异具有统计学意义(F= 1.18,P<0.05);康柏西普能够显著降低细胞VEGF的分泌量,H组与各加药组之间的差异均具有统计学意义(P<0.05),且VEGF的表达随康柏西普浓度增加而降低;加药各组VEGF的表达均低于正常组(P<0.05)。

图1 各组细胞分泌VEGF的浓度(pg/m l)
2.2 TER检测结果各组hRMECs单层细胞TER值得检测结果见表1。24 h、36 h、48 h、60 h、72 h各组间差异均具有统计学意义(P<0.05);各时间段N组TER值均明显高于H组(P<0.05);各时间段加药各组检测的TER值均大于H组(P<0.05);各时间段组间进行两两比较,24 h、36 h、48 h时H2、H3比较差异无统计学意义(P>0.05),72h时N组与H1组的TER值差异无统计学意义;H组TER值从36小时开始随时间的延长逐渐减小。
表1 各组不同时间细胞屏障TER值

表1 各组不同时间细胞屏障TER值
注:不同时间段,N组与H组比较,P<0.05,H组与加药组比较,P<0.05,H组TER值从36小时开始随时间延长而减少。
9.6组别9.7±3.5 H组80.6±2.2 83.2±1.7 74.0±4.3 65.6±5.5 55.5±4.6 H1组101.3±6.7 120.7±2.6 109.8±6.5 128.7±2.9 139.1±6.8 H2组92.2±3.6 102.1±3.9 100.6±3.2 115.1±4.7 125.1±4.1 H3组90.1±6.1 96.9±5.1 96.4±4.1 106.1±3.4 112.1± 24h 36h 48h 60h 72h N组126.1±3.9 134.7±2.4 135.8±8.1 135.4±4.33 13
2.3 各组HRP通透性检测结果各组辣根过氧化物酶通透性检测的A值见表2。各个时段高糖作用下的HRP通透性检测结果均明显高于正常组(P<0.05);24h、48h、72h组间进行两两比较(P<0.05);各个时段加药组HRP通透性A值均小于高糖组(P<0.05);高糖组A值随时间的延长不断增加;各组间交互图见图2。
表2 各组不同时间HRP通透性
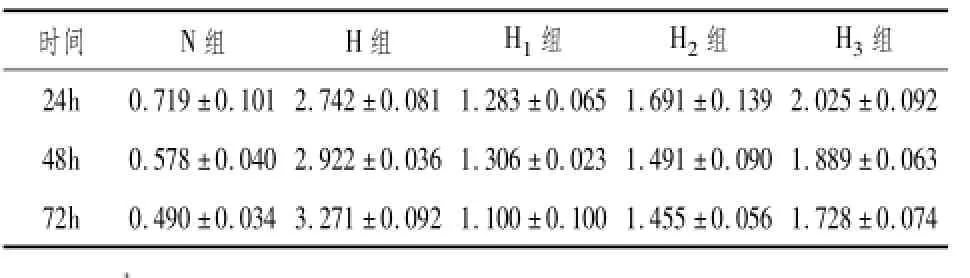
表2 各组不同时间HRP通透性
时间N组H组H1组H2组H3组24h 0.719±0.101 2.742±0.081 1.283±0.065 1.691±0.139 2.025±0.092 48h 0.578±0.040 2.922±0.036 1.306±0.023 1.491±0.090 1.889±0.063 72h 0.490±0.034 3.271±0.092 1.100±0.100 1.455±0.056 1.728±0.074
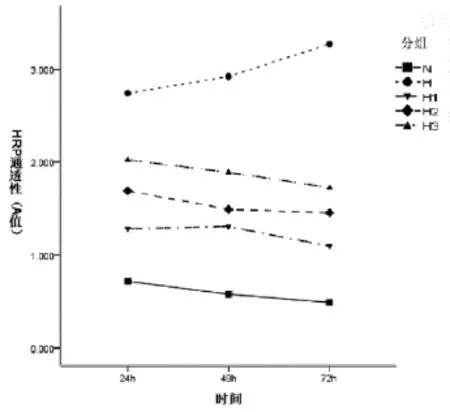
图2 各组细胞HRP通透性(A值)
2.4 Western blot检测结果各组泳道均有occludin蛋白表达的特异性条带(图3)。高糖环境下occludin的表达较正常组低(P<0.05);2.5μg/ml、25μg/ml加药组occludin的表达高于H组(P< 0.05);0.25μg/ml组与H组相比occludin的表达无明显差异(P>0.05)。

图3 各组细胞occludin蛋白表达量
3 讨论
越来越多的实验证明了VEGF是DR、DME的发生以及发展的重要因子[11-13],其中的一个原因就是引起细胞的渗透性增加,而这种渗透性又是由紧密连接蛋白决定的[14]。occludin蛋白是紧密连接中重要的结构蛋白,与其他紧密连接蛋白结合产生严密的细胞旁封闭,共同维持细胞间紧密连接屏障的正常生理功能。目前认为occludin功能广泛,包括屏障功能,维持细胞两侧的物质差异和保持细胞的极性,还可调节细胞的生长、增殖和分化[15-16]。糖尿病性视网膜病变中显著表达升高的VEGF可使内皮细胞间紧密连接的Occludin和ZO-l蛋白磷酸化[17],使这些蛋白的数量以及分布发生异常,导致内皮细胞间连接出现窗口甚至中断[18-19],这是VEGF导致血管渗漏的重要机制。因此,拮抗VEGF过度表达可以作为治疗DM继发黄斑水肿的重要手段。
目前,应用于眼科的抗VEGF的药物有阿柏西普(aflibercept),雷珠单抗(ranibizumab),贝伐单抗(bevacizumab)和康柏西普(conbercept),康柏西普由我国康弘公司生产,2013年12月批准用于治疗湿性年龄相关性黄斑变性(AMD)。康柏西普作为一种抗血管内皮生长因子的融合蛋白,可阻断VEGF-A所有亚型、VEGF-B及胎盘生长因子,可完全穿透视网膜,亲和力强、作用时间长[20-21]。本实验将康柏西普作用于高糖下生长的hRMECs,通过观察细胞通透性指标,评价康柏西普对单层hRMEC屏障作用的影响。
本研究中,通过不同葡萄糖浓度的培养基作为对比,以葡萄糖浓度为5.5 mmol/L的培养基为正常组,葡萄糖浓度为25 mmol/L的培养基为高糖组,以高浓度的葡萄糖模拟患者组织及细胞所处的高糖环境。结果显示,高糖组视网膜微血管内皮细胞分泌VEGF明显增加,而对高糖环境下的hRMECs加入不同浓度的康柏西普后,显著的抑制了VEGF的表达,同时,我们还观察到加药组的VEGF表达低于正常组。Boyd等[22]发现,基础水平的VEGF起着维持原有血管密度及维持血管对运输营养物质所必需的通透性的作用,那么,康柏西普显著抑制VEGF的同时是否影响VEGF正常生理功能的发挥,还有待进一步的研究。血管内皮细胞具有离子电荷屏障的功能特性,TER[23]是由离子经细胞旁间隔的流动形成的,离子的流动受多种因素的影响,如细胞本身状态、培养基的成分、孔径等因素。因此在体外条件下,通过检测融合成状单层的内皮细胞的TER值,能够反映出内皮细胞离子电荷屏障的某些生理学特征,反映出内皮细胞间的完整性。各个时段高糖组TER值与其他组比较均为最低,不同药物浓度的康柏西普组的TER值在各时段均高于高糖组。各个时段高糖组HRP检测的A值均高于正常组,各时段各加药组A值均小于高糖组。TER的测量和用HRP进行的通透性检测可间接地反映屏障功能的完整性,是可以用来描述屏障功能建立情况的客观指标。由以上结果仍可得出,通透性的提高往往伴随着TER的降低,TER值越高,单层细胞的屏障功能越稳定。
综上所述,康柏西普能抑制高糖环境下hRMECs分泌VEGF,使occludin蛋白的表达增加,hRMECs单层细胞通透性降低。但康柏西普对单层细胞屏障功能的机制尚未得到阐明,以及康柏西普对抑制VEGF与受体结合所可能引起的不良反应还有待进一步的研究。因此,为使康柏西普更合理、有效、安全的应用于临床,进一步更深入探讨康柏西普的作用机制具有重大意义。
[1]Rosales M A,Silva K C,Duarte D A,et al.Endocytosis of tight junctions caveolin nitrosylation dependent is improved by cocoa via opioid receptoron RPE cells in diabetic conditions[J].Investigative Ophthalmology&Visual Science,2014,55(9):6090-6100.
[2]Deissler H L,Lang G K,Lang G E.Capacity of aflibercept to counteract VEGF-stimulated abnormalbehavior of retinalmicrovascular endothelial cells[J].Experimental Eye Research,2014,122:20-31.
[3]Barber AJ,Antonetti DA,Gardner TW,et al.Altered expression of retinal occludin and glial fibrillary acidic protein in experimental diabetes[J].InvestOphthalmol Vis Sci,2000,4 1:3561-3568.
[4]Murata T,Ishibashi T,Khalil A,et al.Vascular endothelial growth factor p lays a role in hyperpermeability of diabetic retinalvessels[J].Ophthalmic Res,1995,27:48-52.
[5]Stefani F R,Badaro E,Falabella P,et al.Anti-VEGF for the management of diabeticmacular edema[J].Journal of Immunology Research,2014,2014:632307.
[6]Klettner A,Recber M,Rodider J.Comparison of the efficacy of aflibercept,ranibizumab,and bevacizumab in an RPE/choroid organ culture[J].Graefe's Archive for Clinical and Experimental Ophthalmology,2014,252(10):1593-1598.
[7]刘姝林,陈有信.抗VEGF药物治疗视网膜中央静脉阻塞并发黄斑水肿的Meta分析[J].中华实验眼科杂志,2014,32(1):56-61.
[8]Liu Z,Meyer C H,Stanzel B V,et al.Effect of novel vital dyes on outer blood-retina barrier function in cultured human retinal pigment epithelium[J].Ophthalmologica Journal International d'ophtalmologie International journal of ophthalmology Zeitschrift fur Augenheilkunde,2013,230(2):33-40.
[9]古妮娜,张丹,罗丽,等.嗜铬粒蛋白A衍生多肽CGA47-66抑制脓毒症血清所致血管内皮细胞高通透性的研究,[J].中华危重病急救医学2013,12(8):715-719.
[10]W ill Whitmire,Mohammed MH Al-Gayyar,Mohammed Abdelsaid,et al.Alteration ofgrowth factors and neuronal death in diabetic retinopathy:whatwe have learned so far[J].Molecular Vision,2011,17:300-308.
[11]StewartMW.Critical appraisalof ranibizumab in the treatment of diabetic macular edema[J].Clinical ophthalmology,2013,7: 1257-1267.
[12]Wang J,Xu X,Elliott M H,et al.Muller cell-derived VEGF is essential for diabetes-induced retinal inflammation and vascular leakage[J].Diabetes,2010,59(9):2297-2305.
[13]Kowluru R A,Zhong Q,Kanwar M.Metabolicmemory and diabetic retinopathy:role of inflammatory mediators in retinal pericytes[J].Experimental eye research,2010,90(5):617-623.
[14]Haurigot V,Villacampa P,Ribera A,et al.Increased intraocular insulin-like growth factor-I triggers blood-retinal barrier breakdown[J].JBiol Chem 2009,284:22961-22969.
[15]Koval M,Ward C,Findley MK,et al.Extracellular matrix influences alveolar epithelial claudin expression and barrier function[J].Am JRespir Cell Mol Biol,2010,42:172-180.
[16]Tsukita S,Yamazaki Y,Katsuno T,et al.Tight junctionbased epithelial microenvironment and cell proliferation[J].Oncogene,2008,27:6930-6938.
[17]Antonetti DA,Barber AJ,Khin S,et al.Vascular permeability in experimental diabetes is associated with reduced endothelial occludin content:vascular endothelial growth factor decreases occludin in retinal endothelial cells[J].Penn State Retina Research Group Diabetes,1998,47:1953-1959.
[18]Esser S,Wolburg K,Wolburg H,et al.Vascular endothelial growth factor induces endothelial fenestrations in vitro[J].JCell Biol,1998,140:947-959.
[19]Dobroguwska DH,Lossinsky AS,Tarnawski M,et al.Increased blood-brain barrier permeability and endothelial abnormalities induced by vascular endothelial growth factor[J].J Neurseytol,1998,27:163-173.
[20]Wang Q,Li T,Wu Z,et al.Novel VEGF decoy receptor fusion protein conbercept targetingmultiple VEGF isoforms provide remarkable anti-angiogenesis effect in vivo[J].PLoSOne,2013,8 (8):8-12.
[21]Wu Zh,Zhou P,Li X,et a1.Structural characterization of a recombinant fusion protein by instrumental analysis and molecular modeling[J].PLoSOne,2013,8(3):3-4.
[22]Boyd SR,Zachary I,Chakravarthy U,et al.Correlation of increased vascular endothelial growthfactor with neovascularization and permeability in ischemic central vein occlusion[J].Arch 0phthalm,2002,120(12):1644-1650.
[23]Cai RL,Wang M,Qi Y,et al.Selection and utilization on the evaluation criterions of Caco-2 cell model[J].Chin Pham J,2008,43:1871-1875.
Effects of conbercept on human retinalm icrovascular endothelial cells barrier function and expression of VEGF in high glucose environment
ZHANG Ting1LIMing-xin2
(1.Xuzhou Medical College,2.The Affiliated Hospital of Xuzhou Medical College,Xuzhou 221000,China)
Objective:To investigate the effects of conbercept on human retinal microvascular endothelial cells (hRMECs)barrier function and expression of VEGF in high glucose environment.Methods:The hRMECs were divided into 5 groups:controlgroup(Group N),high glucose group(Group H),and treatment groups(high glucose with different concentration of conbercept).The examination of vascular endothelial growth factor(VEGF)was done by enzyme linked immunosorbent assay(ELISA).The protein level of occludin in each group was detected by western blot.Transendothelial electrical resistance(TER)and the permeability of horseradish peroxidase(HRP)were detected to evaluate the stability of barrier function of hRMEC.Results:The level of VEGF in group H is significantly different from that in group N(P<0.05).However,this effectwas significantly inhibited by conbercept treatment(P<0.05).The concentration of25μg/L,2.5μg/L conbercept increased protein level of occludin compared with group H,which was not found in the concentration of 0.25μg/L conbercept.Conbercept suppressed not only the reducation of TER value but also the increase in permeability of HRP.Conclusion:Conbercept can protect the barrier function of hRMECs against high glucose,whosemechanism might be associated with VEGF.
conbercept;high glucose;retinalmicrovascular endothelial cells;barrier function
R774
A
1004-7115(2015)09-0985-04
10.3969/j.issn.1004-7115.2015.09.001
2015-04-01)
张婷(1988—),女,硕士研究生,研究方向:眼底病。
李明新。
