维生素D在DSS诱导的实验性肠炎中的作用研究
2015-06-01车千红
赵 晴,娄 岩,孙 灿,付 瑜,车千红,孔 娟*
·论著·
维生素D在DSS诱导的实验性肠炎中的作用研究
赵 晴1,娄 岩2,孙 灿1,付 瑜1,车千红1,孔 娟1*
目的 探讨维生素D在2.5% 硫酸葡聚糖钠(DSS)诱导的实验性肠炎中的作用。方法 随机抽取C57BL/6源性的野生小鼠10只和VDR敲除小鼠10只分别为对照组和实验组,将DSS加入饮用水中配成2.5%DSS溶液分别喂食,评估两组症状评分及生存时间。另行体外实验,应用5%的DSS溶液刺激Caco-2细胞单层,实验组加入1,25(OH)2D3,对照组不予额外处理,测量两组细胞跨膜电阻。结果 正常野生鼠对2.5% DSS诱导的实验性肠炎可耐受,VDR敲除鼠出现严重腹泻,直肠出血,体重显著降低等,相对于对照组症状评分增高,生存时间缩短。对照组的细胞跨膜电阻在4 h内逐渐下降,而实验组细胞的跨膜电位在初始阶段有所下降,4 h后恢复正常。结论 维生素D在2.5% DSS诱导的实验性肠炎中能够起到保护作用。在体外试验中,1,25(OH)2D3能够抵御DSS诱导的实验性肠炎,为进一步研究维生素D及其信号系统的功能提供了理论依据。
维生素D;硫酸葡聚糖钠;实验性肠炎;Caco-2细胞
0 引言
维生素D是一种脂溶性维生素,近年来的研究显示,其能作为激素参与调节机体的多种生理功能[1]。维生素D是核受体家族的一员,通过与维生素D受体(VDR)结合而发挥调节下位基因的作用。维生素D受体(VDR)广泛存在于各种组织和器官中,与活化的1,25(OH)维生素D结合,调节下游信号系统[2]。研究发现,维生素D具有极其重要的生理功能,除调节体内钙磷平衡外[3],还影响免疫、神经、生殖、内分泌、上皮及毛发生长等[4-5]。故有学者认为,维生素D是一种激素而不只是单纯的维生素[6],称之为维生素D内分泌系统[7]。
炎症性肠病(IBD)的发病机制尚未阐明,一般认为IBD是由遗传、环境、微生物、免疫因子等因素的复杂的相互作用所致[8]。以往研究应用硫酸葡聚糖钠(DSS)诱导小鼠肠炎模型,可见小鼠呈现不同程度的急性肠炎表现,包括体重增长缓慢、便血、腹泻等,病理显示小鼠结肠有不同程度的结肠粘膜腺体结构紊乱,单核细胞和多核细胞浸润[9-10]即DSS诱导的实验性肠炎。
既往的研究表明,维生素D缺乏会增加患炎症性肠病的风险[11-12]。也曾有临床病例分析提示,溃疡性结肠炎患者机体内维生素D储备降低,维生素D缺乏与疾病活动性相关[13]。总之,越来越多的证据支持维生素D缺乏与炎症性肠病之间存在病理性联系。为了探索相关机制,本研究应用DSS诱导的急性实验性肠炎模型来观察维生素D对肠道损伤的保护作用。
1 材料与方法
1.1 实验动物 随机抽取C57BL/6源性的野生小鼠10只和VDR敲除小鼠10只,分别为对照组和实验组,2月龄,体重20~25 g,性别不限,室温饲养,饲料为普通动物饲料。
1.2 试剂与材料 DSS(Wako Pure Chemical Industries Ltd.,日本和光纯药工业株式会社),Caco-2细胞株(American Type Culture Collection,Rochville,MD,美国),胎牛血清(Hyclone,美国);DMEM 高糖培养基(GIBCO,美国);Millicell 小室(Millipore,美国);Transwell 24 孔培养板(Corning,美国);Millicell ERS 电子伏特计(美国Millicell 公司);超净工作台、细胞培养箱(德国Heraeus公司)。
1.3 实验性肠炎模型的建立 将DSS加入蒸馏水中配成2.5%DSS 溶液,分别给两组小鼠喂食6 d,自第7天起喂食正常蒸馏水,自然死亡或至12 d后统一处死。
1.4 肠炎的评估 密切监测小鼠的体重及症状,包括腹泻程度、直肠出血等。症状评分总分为6分,评分标准如下:①大便次数。0分:1~2次/d;1分:3~5次/d;2分:>5次/d。②肉眼血便。0分:无;1分:有。③直肠脱垂。0分:无;1分:有。
1.5 Caco-2单层细胞模型的建立 将Caco-2细胞置于含10%胎牛血清的DMEM培养液中,置于37 ℃、含5% CO2、相对湿度90% 的环境中。将Caco-2 细胞种植于Transwell 培养板上的Millicell 聚碳酸酯膜小室上(Pore sizes 0.4 μm),细胞种植密度为 5.5×105个/mL。接种后隔日换液,1周后每日换液,培养至21 d,满足跨膜电阻TEER>200 Ω*cm2。
1.6 细胞转运实验 将分化良好的Caco-2 细胞接种于六孔板上培养24 h,接种密度为1 × 107个/mL。用PBS将分离的细胞冲洗掉。余下的细胞单层分为实验组和对照组,对照组继续置于含1%胎牛血清的DMEM培养液中48 h,实验组在培养液中加入1,25(OH)2D3,培养相同时间。应用5%的DSS溶液刺激两组细胞单层10 min,用跨膜电阻仪分别于10、20、30、60、90、120、180、240 min测量两组细胞单层跨膜电阻。
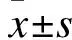
2 结果
2.1 两组小鼠发生结肠炎的状况分析 比较两组小鼠的结肠炎临床症状,发现VDR敲除鼠进展为更为严重的结肠炎,腹泻次数明显增多,多数可见肉眼血便,更有甚者发生了直肠脱垂。依照症状评分标准,评分越高代表结肠炎临床症状越严重。在给予饮用DSS溶液的第2天和第6天,分别对两组小鼠进行症状评分。图1显示,第2天两组小鼠的症状评分较初始状态升高,证明实验性肠炎模型建立成功,而VDR敲除鼠的症状评分较正常野生对照组明显升高。在第6天,对照组评分逐渐下降,而实验组仍有上升。说明正常野生鼠对2.5% DSS溶液基本耐受,其肠道黏膜可在一定范围内自行修复,肠道功能也可逐渐恢复,而VDR敲除鼠丧失了肠道修复的能力,随着时间延长,其结肠炎临床症状反而加重。
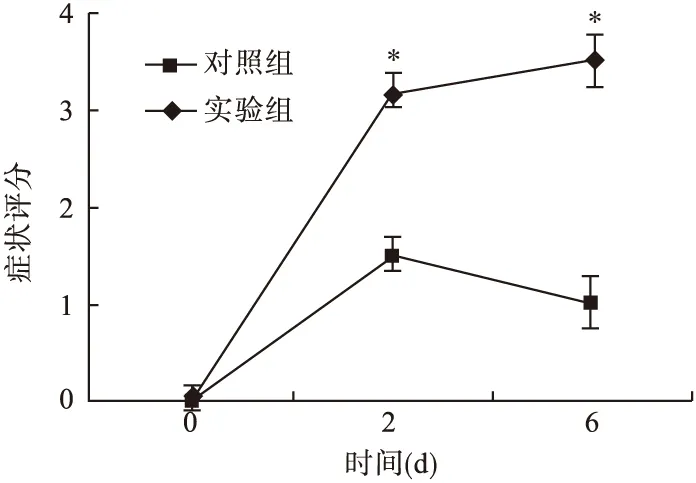
图1 两组小鼠症状评分比较
2.2 两组小鼠的体重变化比较 如图2所示,0 d为两组小鼠的初始体重。在给予DSS溶液的第1天,两组小鼠体重未见明显改变,第2天~第6天,两组小鼠开始出现较明显的结肠炎症状,导致体重均有所下降,其中VDR敲除鼠体重下降更为明显。第6天起,正常野生鼠的体重开始回升,结合图1的症状评分,与该组小鼠已从实验性肠炎中逐渐恢复有关。而后将DSS溶液更换为正常蒸馏水,对照组小鼠体重上升更为明显,至第8天,正常野生鼠的体重已增长至初始体重的105%。实验组尽管DSS溶液已撤除,更换为正常蒸馏水,仍未能阻止VDR敲除鼠体重持续下降的趋势。

图2 两组小鼠体重比较
2.3 两组小鼠的存活率比较 如图3所示。在给予DSS溶液后的6 d内,对照组小鼠全部存活,而VDR敲除鼠随着肠炎症状加重存活率逐渐下降,相应的死亡率上升。第7天起,更换DSS溶液为正常蒸馏水至第12 天,VDR敲除鼠并未因此恢复,呈现出更低的存活率,至实验结束共12 d,80%的VDR敲除鼠死亡。对照组无一例死亡。

图3 两组小鼠存活率比较
2.4 两组跨膜电阻比较 Caco-2细胞单层体外培养实验中,以1,25(OH)2D3加入培养液中的细胞作为实验组,未处理的细胞作为对照组,分别测量两组细胞经5%DSS溶液浸润后的跨膜电阻,结果见图4。对照组的细胞跨膜电阻在4 h内逐渐下降,证明DSS溶液对Caco-2细胞单层造成了损害。而实验组的细胞跨膜电阻初始阶段有所下降,4 h后恢复正常。提示1,25(OH)2D3能够抵御DSS诱导的实验性肠炎,在一定程度上起到保护和修复肠道粘膜屏障的作用。
3 讨论
流行病学证据表明,维生素D缺乏与IBD风险增加之间存在相关性[11],DSS诱导的实验性肠炎模型具有人类溃疡性结肠炎溃疡和肠道屏障功能丧失的临床和病理特点。尽管DSS产生的确切作用尚不清楚,但DSS能够引起肠道粘膜损伤,最终导致炎症。为了制造维生素D缺乏的模型,本研究采用VDR敲除鼠。正常条件下VDR敲除鼠除了会出现一定程度的结肠粘膜细胞增生外[14],并不会出现肠道功能异常。而在DSS诱导下,VDR敲除鼠肠道粘膜会出现大量溃疡。既往有研究报道了VDR敲除鼠经DSS处理后结肠的初始免疫应答[15],维生素D在抗感染的同时,调控抑菌肽的表达,既能维持肠道黏膜表层屏障的完整,又可修复肠黏膜通透性。近年来有关维生素D在免疫系统中的调节作用是研究热点,维生素D可通过抑制细胞免疫及自身细胞毒性T细胞的激活,来调节免疫反应。因此,维生素D缺乏可危害黏膜屏障,导致黏膜损伤及产生IBD的风险加大[16]。维生素D在调节黏膜表面菌群、抑制肠腔细菌黏附、调整紧密连接蛋白、维持黏膜屏障完整性、抑制致病菌入侵及移位、调节免疫反应等IBD发病的环节均发挥着重要作用[17]。本研究显示,野生鼠大部分对2.5% DSS耐受,症状评分较低,并随着用正常蒸馏水代替DSS溶液,野生鼠逐渐恢复,症状评分进一步降低,体重从初期略有下降直至实验结束后反而有所上升,实验过程中存活率100%。VDR敲除鼠发生严重腹泻、直肠出血、脱水、明显体重降低,症状评分显著增高,以至于12 d内大量死亡。结果表明,对于DSS诱导的粘膜损伤,VDR敲除鼠比正常鼠易感得多。
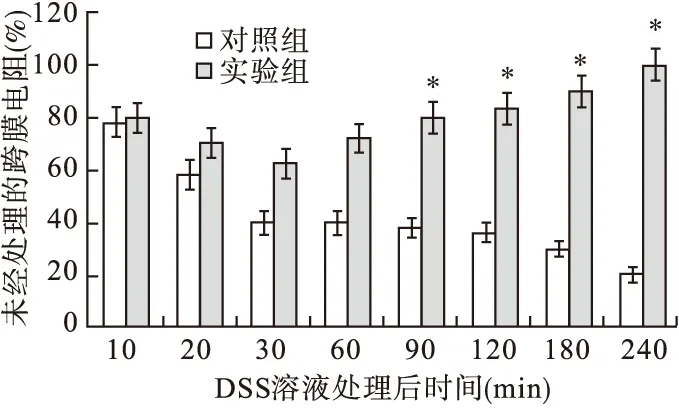
图4 两组跨膜电位比较
Caco-2细胞来源于人类结肠癌细胞,是目前药物吸收的主要研究方法之一。Caco-2细胞单层模型是目前公认的理想的体外模型,Caco-2 细胞可在培养条件下,在多孔的可渗透聚碳酸酯膜上生长、融合,并自发进行上皮样分化和形成紧密联结,分化出绒毛面(肠腔侧)和基底面(肠壁侧),其形态学、标志酶的功能表达与小肠上皮细胞相似,因此该细胞模型成为预测药物在人体小肠吸收以及药物转运机制研究的标准筛选工具,是体外考察药物吸收、代谢等的一个经典模型[18-19]。细胞亚显微结构研究表明,Caco-2细胞与人小肠上皮细胞在形态学上极为相似,具有相同的细胞极性和紧密连接[20],并含有与小肠刷状缘上皮相关的酶系。胞饮功能的检测也表明,Caco-2细胞与人小肠上皮细胞类似,其结构和生化功能均接近于人体小肠上皮细胞屏障[21]。以上的特性可以恒定维持约20 d。因此可以在这段时间进行药物的跨膜转运实验[22]。
曾有文献推测在Caco-2细胞培养中,1,25(OH)2D3可通过增加连接蛋白表达提高由人肠道上皮细胞系单层形成的连接紧密性并保留在DSS存在下的紧密连接的结构完整性[8]。本实验利用相同浓度的DSS溶液在相同条件和时间刺激Caco-2细胞单层,加入1,25(OH)2D3实验组表现出细胞跨膜电阻轻度损伤后迅速恢复,而未加入1,25(OH)2D3的对照组表现出细胞跨膜电阻持续下降,由此证明两组细胞跨膜电阻的差距来源于是否添加1,25(OH)2D3,推测1,25(OH)2D3能够抵御DSS诱导的实验性肠炎。
综上所述,本研究表明,当维生素D受体缺失时,小鼠会出现更加严重的结肠炎临床症状,表现为体重下降、症状评分升高、死亡率上升;另一方面,添加了活性维生素D的细胞抵御DSS诱导的实验性肠炎能力增强。由此可见,1,25(OH)2D3在肠道损伤的情况下,能够起到保护肠道粘膜屏障的作用,为临床上应用1,25(OH)2D3作为炎症性肠病的一种辅助治疗预防复发的有效措施提供了理论依据[23]。
[1] 张秀敏,李宇宁.慢性肾脏疾病患儿维生素D水平研究进展[J].国际儿科学杂志,2013,40(5):470-473.
[2] 李榕,楼煜清,颜波,等.维生素D受体基因多态性位点rs7975232与肺癌发病风险的相关性[J].实用医学杂志,2013,8(10):1390-1392.
[3] 于静,李卫国,李宇宁,等.维生素D和钙剂治疗营养性佝偻病疗效的Meta分析[J].国际儿科学杂志,2014,41(5):548-554.
[4] 杨李娜,陈宜锋.维生素D在骨骼病变外的应用研究进展[J].中国医药,2014,9(4):606-608.
[5] 陈建平,张春,江赵丹,等.1,25-二羟维生素D3对人系膜细胞增殖与凋亡的影响[J].实用医学杂志,2014,30(3):342-345.
[6] 徐艳娜,顾剑华,金晓群.血清25-羟维生素D3及总免疫球蛋白E水平与婴幼儿反复喘息的相关性研究[J].中国医药,2014,9(11):1582-1584.
[7] 赵晴,娄岩,李丹,等.维生素D受体对急性肝脏损伤保护作用的研究[J].实用药物与临床,2015,18(1):24-27.
[8] Kong J,Zhang Z,Musch MW,et al.Novel role of the vitamin D receptor in maintaining the integrity of the intestinal mucosal barrier[J].AJP-Gastrointest Liver Physiol,2008,294(1):G208-G216.
[9] 韩英,张静.N-乙酰半胱氨酸对硫酸葡聚糖钠诱导的实验性肠炎的预防及治疗作用[J].中国医药导刊,2008,10(1):130-133.
[10]何双艳,李珏宏,李昌平,等.姜黄素对DSS诱导的溃疡性结肠炎小鼠p38MAPK表达的影响[J].实用医学杂志,2014,30(4):539-541.
[11]Lim WC,Hanauer SB,Li YC.Mechanisms of disease:vitamin D andinflammatory bowel disease[J].Nature Clin Pract Gastroenterol Hepatol,2005,2:308-315.
[12]蓝德云,焦军强,李平,等.维生素D受体基因Fok I位点单核苷酸多态性与溃疡性结肠炎的关系[J].实用医学杂志,2014,30(24):3955-3957.
[13]林艳,周然,林连捷,等.溃疡性结肠炎患者血清25(OH)维生素D水平与疾病活动性的相关性[J].解剖科学进展,2014,20(2):142-144,150.
[14]Kallay E,Pietschmann P,Toyokuni S,et al.Characterization of a vitamin Dreceptor knockout mouse as a model of colorectal hyperproliferation and DNA damage[J].Carcinogenesis,2001,22(9):1429-1435.
[15]Froicu M,Cantorna MT.Vitamin D and the vitamin D receptor arecritical for control of the innate immune response to colonic injury[J].BMC Immuno,2007,18:5.
[16]Guo XQ,Wang SJ,Zhang LW,et al.DNA methylation and loss of protein expression in esophageal squamous cellcarcinogenesis of high-risk area[J].Exp Clin Cancer Res,2007,26:587-594.
[17]樊星,翁谢川.炎症性肠病病因研究进展[J].国际消化病杂志,2013,33(1):6-8,16.
[18]Crivori P,Reinach B,Pezzetta D,et al.Computational models for identifying potential P-glycoprotein substrates and inhibitors[J].Mol Pharm,2006,3(1):33.
[19]Shirasaka Y,Kawasaki M,Sakane T,et al.Induction of human P-gly-coprotein in Caco-2 cells:development of a highly sensitive assay system for P-glycoprotein-mediated drug transport[J].Drug Metab Pharmacokinet,2006,21(5):414.
[20]Yamashita S,Furubayashi,Kataoka M,et al.Optimized conditions for prediction of intestinal drug permeability using Caco-2 cells[J].Eur J Pharm Sci,2000,10(3):195.
[21]余自成,高瑜,田薇薇,等.肠道转运Caco-2细胞单层模型的建立及验证评价[J].中国临床药学杂志,2012,21(4):218-221.
[22]Fossati L,Dechaume R,Hardillier E,et al.Use of simulated intestinal fluid for Caco-2 permeability assay of lipophilic drugs [J].Int J Pharm,2008,360(1-2):148.
[23]麻继臣,张晓岚.维生素D与炎症性肠病的研究进展[J].世界华人消化杂志,2008,16(23):2637-2643.
Effect of vitamin D on dextran sodium sulfate-induced experimental colitis
ZHAO Qing1,LOU Yan2,SUN Can1,FU Yu1,CHE Qian-hong1,KONG Juan1*
(1.Department of Clinical Nutrition,Shengjing Hospital of China Medical University,Shenyang 110004,China;2 Computer Department,China Medical University,Shenyang 110122,China)
Objective To explore the effect of vitamin D on 2.5% DSS-induced experimental colitis.Methods Wild and vitamin D receptor (VDR) knockout C57BL/6 mice were divided into control group (n=10,wild) and experimental group (n=10,VDR knockout).The mice were fed with 2.5% DSS.The symptom score and life time was observed.Invitroexperiments: when Caco-2 monolayers were stimulated with 5% DSS,experimental group was added with 1,25(OH)2D3.The TEER of both groups was determined.Results The mice in control group were mostly resistant to 2.5% DSS-induced experimental colitis.There were a lot of symptoms such as severe diarrhea,rectal bleeding and marked body weight loss in the mice of experimental group.The symptom score of experimental group was higher than that of control group with shorter life time.The TEER gradually decreased within 4 h in control group,in experimental group,the TEER was moderately reduced at the beginning and fully recovered after 4 h.Conclusion Vitamin D can play a protective role on 2.5% DSS-induced experimental colitis,which provides a theoretical evidence for further study of vitamin D and the function of its signal system.
Vitamin D;DSS;Experimental colitis;Caco-2
2015-02-18
1.中国医科大学附属盛京医院临床营养科,沈阳 110004;2.中国医科大学计算机教研室,沈阳 110122
国家自然科学基金(30971401、81170065);辽宁省攀登学者计划;辽宁省十百千计划
10.14053/j.cnki.ppcr.201506001
*通信作者
