2009年冬、夏季南海北部超微型浮游生物的分布特征及其环境相关分析
2015-06-01乐凤凤蔡昱明孙军郝锵刘诚刚翟红昌陈建芳
乐凤凤,蔡昱明,孙军,郝锵,刘诚刚,翟红昌,陈建芳
(1.国家海洋局第二海洋研究所,浙江杭州 310012;2.卫星海洋环境动力学国家重点实验室,浙江杭州 310012;3.国家海洋局海洋生态系统与生物地球化学重点实验室,浙江杭州 310012;4.天津科技大学海洋与环境学院,天津 300457;5.天津科技大学天津市海洋资源与化学重点实验室,天津300457)
2009年冬、夏季南海北部超微型浮游生物的分布特征及其环境相关分析
乐凤凤1,3,蔡昱明1,3,孙军4,5,郝锵1,2,3,刘诚刚1,2,3,翟红昌1,3,陈建芳1,2,3
(1.国家海洋局第二海洋研究所,浙江杭州 310012;2.卫星海洋环境动力学国家重点实验室,浙江杭州 310012;3.国家海洋局海洋生态系统与生物地球化学重点实验室,浙江杭州 310012;4.天津科技大学海洋与环境学院,天津 300457;5.天津科技大学天津市海洋资源与化学重点实验室,天津300457)
2009年2月(冬季)和8月(夏季)在南海北部海域(nSCS)采用流式细胞术对聚球藻、原绿球藻、超微型光合真核生物3类超微型光合浮游生物和异养浮游细菌的丰度和碳生物量的时空分布特征进行了研究,并分析了其与环境因子之间的关系。结果表明,夏季聚球藻和原绿球藻的平均丰度高于冬季,超微型光合真核生物和异养浮游细菌的丰度反之,为冬季高于夏季。聚球藻、超微型光合真核生物和异养浮游细菌在富营养的近岸陆架海域丰度较高,而原绿球藻高丰度则出现在陆坡开阔海域。在垂直分布上,聚球藻主要分布在跃层以上,跃层以下丰度迅速降低;原绿球藻高丰度主要出现在真光层底部;超微型光合真核生物在水层中的高值同样出现在真光层底部,且与Pico级份叶绿素a浓度分布一致;异养浮游细菌在水体中的分布与聚球藻类似。这些分布格局的差异,取决于环境条件的变化和4类超微型浮游生物生态生理适应性的差异。在超微型光合浮游生物群落中,各类群碳生物量的贡献因季节和海域类型的不同而发生变化:聚球藻在夏季近岸陆架区占超微型光合浮游生物总碳生物量的41%,原绿球藻在陆坡开阔海成为主要贡献者(50%),超微型光合真核生物碳生物量以冬季为高(在近岸陆架区占比68%)。冬、夏季异养浮游细菌碳生物量均高于超微型光合浮游生物碳生物量。
南海北部;超微型光合浮游生物;异养浮游细菌;丰度与碳生物量;季节对比
1 引言
自20世纪80年代Paau、Chisholm、Yentsch等[1—3]将流式细胞术引入海洋微型浮游植物研究领域以来,这一举措推动了海洋超微型浮游生物(细胞直径小于2~3μm)的研究进展,利用它们各自的自发荧光可以在流式细胞仪上将他们区分开来[4—7]。超微型浮游生物包括超微型光合浮游生物(photosynthetic picoplankton,phPico):聚球藻(Synechococcus,Syn)、原绿球藻(Prochlorococcus,Pro)和超微型光合真核生物(Picoeukaryotes,PEuk),以及异养浮游细菌(heterotrophic bacteria,HBac)。超微型光合浮游生物分布广泛,并且由于其代谢活性强,繁殖快、生物量循环迅速、能量转换效率高而使其成为水层微型生物食物网(microbial food web)的重要组成部分,其作为纤毛虫的饵料被摄食从而将微食物网和经典食物链连接起来[8—9]。异养浮游细菌对超微型浮游生物总生物量的贡献巨大,它们进行的细菌二次生产过程使其具有与初级生产者同等甚至更大的作用,在海洋生态系统生物地球化学循环中扮演着不可或缺的角色[10—11]。
南海是我国最大的边缘海,也是西太平洋最大的半封闭边缘海,其北部海域包括珠江口和广阔的陆架海域。因此南海北部由一系列不同的生态系统构成,且生物多样性程度较高[12—14]。尽管近岸水体受陆源输入和沿岸上升流的影响而营养丰富,但在开阔海域,各项营养盐浓度均较低,属于贫营养性海域[15]。因此,超微型浮游生物成为南海浮游植物群落中重要的组成部分[16—18]。Yang和Jiao等[19—20]报道了南海北部原绿球藻的丰度及其昼夜变化,并通过培养实验研究了超微型浮游生物对营养盐加富的响应。Huang等[21]则根据从珠江口到东沙岛的断面调查结果,分析了超微型浮游生物的丰度、碳生物量及其群落结构变化,并对昼夜变化的控制机制进行了研究。Ning等[16]对南海北部及北部湾海域不同分区内超微型光合浮游生物与浮游细菌之间的相关关系进行了对比分析,结果显示细菌的上行效应与浮游植物粒级大小显著相关。有关南海北部超微型浮游生物在不同季节的对比研究也有少量报道,钟瑜等[22]对冬夏季雷州半岛附近海域的超微型浮游生物类群进行了对比分析,Liu等[17]深入分析了SEATS站超微型浮游生物的季节变化特征,并讨论了其群落结构变化与ENSO事件的关系,Cai等[18]和Chen等[23]对南海北部大范围海域中超微型浮游生物在冬夏季的不同分布特征进行了对比分析。本文通过2009年在南海北部的冬、夏季航次调查所获数据资料,描述了在不同环境条件下超微型浮游生物各类群的分布特征并对其进行对比分析,以期为南海北部海域生态系结构与功能,特别是微型生物食物网的深入研究提供科学基础。
2 材料和方法
2.1 研究海域和采样方法
2009年2月11-23日和2009年8月12-24日搭载南海分局断面监测航次分别进行冬季和夏季的调查,站位(图1)布设范围在18°~23°N、110°~117°E海域内,设4条断面共22个站位(包括珠江口内2个站位),所有站位沿用南海分局统一编号。S1、S2观测断面垂直于岸线横跨沿岸带、陆架区和陆坡开阔海区,其中S1断面为珠江口向外延伸主断面。沿200 m等深线将调查海域分为近岸陆架海域(包括14个站位)和陆坡开阔海域(包括8个站位)。

图1 2009年冬季和夏季南海北部海域取样观测站位Fig.1 Sampling stations in nSCS during the winter and summer of 2009
水样的采集使用Rosette采水系统,采样层次为表层、10 m、25 m、50 m、75 m、100 m、150 m、200 m和底层。超微型浮游生物检测与计数用水样,用10%多聚甲醛固定(至终浓度1%)摇匀,并在室温保持10 min后放入液氮速冻,带回实验室保存在-80℃的低温下直至分析测定[7,24]。
2.2 超微型光合浮游生物的分析
使用的流式细胞仪型号为FACSCalibur(Becton Dickinson Co.)。冷冻水样融化后,取1 cm3上机测定,采集前角光散射(FSC)和侧角光散射(SSC)—表征细胞大小和质地、(585±21)nm(FL2)—藻红蛋白荧光和大于650 nm(FL3)—叶绿素荧光[25]等数据,用CellQuest软件(Becton Dickinson Co.)处理后存储,并通过多项组合的双参数图进行综合分析,对Syn、Pro和PEuk加以鉴别。
2.3 异养浮游细菌的分析
取0.2 cm3冷冻后融化的水样,加SYBR Green-I至终浓度为1×10-4,混匀后室温条件下黑暗静置15 min以使DNA着色再上机检测,采集(530±15)nm(FL1)—绿色荧光数据[7],数据保存和处理方法同超微型光合浮游生物。
2.4 超微型浮游生物碳生物量的估算
各类别超微型浮游生物的丰度乘以细胞碳含量得出生物量(mg/m3,以碳计)。本文中各类超微型浮游生物的碳转换因子沿用Liu等[17]在南海SEATS站所使用的转换系数(见讨论4.2),其中Syn和Pro两类细胞由于在真光层的位置不同导致其细胞大小和碳含量差异巨大,因此以60 m为界,60 m以浅Syn和Pro碳转换因子分别为67 fg/cell和24 fg/cell,60 m以深则分别为157 fg/cell和62 fg/cell;HBac细胞大小在不同水层中变化不大,统一使用11 fg/cell;PEuk碳转换因子为1 500 fg/cell。
3 结果
3.1 理化环境参数和Chla浓度分布特征
冬季,表层水温、盐度、硝酸盐浓度和Chla浓度分别为(22.67±1.88)℃、(32.59±4.83)、(4.43± 9.39)μmol/L和(1.23±2.38)mg/m3。从图2A~2D可看到等温线大致平行于岸线向外海逐渐增高;表层盐度的分布特征比较独特,S1和S2断面位置盐度高于34,而沿岸海域则盐度相对较低,特别是上下川岛附近的E站,盐度低于32;表层硝酸盐浓度梯度变化非常剧烈,从珠江口A1站高达47.57μmol/L向口门外迅速降低至S1-1站的4.09μmol/L,整体上硝酸盐浓度S1断面高于S2断面,在垂直方向上随着深度的增加而增加,跃层位置出现在100~150 m层,而近岸水体混合比较均匀,表、底层水质均一(断面图未展示)。
与冬季相比,夏季调查海域则表现出相对高温、低盐、高营养盐和低Chla浓度的特征:表层水温、盐度、硝酸盐浓度和Chla浓度分别为(29.63± 0.78)℃、(28.97±8.78)、(10.35±17.19)μmol/L和(0.94±1.77)mg/m3。近岸和最外侧海域表层温度较高,中部海域则呈现斑块状分布,营养盐分布与此类似;表层盐度受夏季增大的珠江径流的影响,等盐线从珠江口向外海辐散,Chla浓度受径流及其携带的大量营养盐影响显著,从珠江口向外海迅速降低(图2a~d)。夏季温、盐跃层非常强大,近岸跃层大约位于20~30 m层,外海则位于50~75 m层,营养盐输送受跃层阻挡,跃层以上营养盐浓度极低,次表层叶绿素最大值现象明显(断面图未展示)。
3.2 超微型浮游生物的平面分布
冬季,4类超微型浮游生物的水层积分平均丰度的分布特征各不相同(图3)。Syn丰度的分布范围在0.0×103cells/m L(A1站的底层)至185.7×103cells/m L(S1-6站的25 m层)之间,调查海区积分平均值为(20.9±15.0)×103cells/mL;高值出现在陆架区香港东南面附近和海南岛东部海域,珠江口内丰度极低。Pro丰度的分布范围在0(A1、A2和A3站未检出Pro)至249.5×103cells/mL(S2-10站的38 m层)之间,调查海区积分平均值为(24.7±23.7)× 103cells/m L,丰度近岸低于外海,北部低于南部(图3)。PEuk丰度的分布范围为0(m站的200 m层)至10.1×103cells/mL(S1-8站的25 m层),调查海区积分平均值为(2.4±1.3)×103cells/m L;高值区分布在海南岛东部海域、珠江口门及南部沿岸海域(图3)。HBac丰度的分布范围为140.1×103cells/mL(S1-9站的150 m层)至2 874.9×103cells/mL(S1-1站的表层),调查海区总平均值为(912.3±366.1)×103cells/m L,高值集中分布在珠江口门和广东沿岸海域(图3)。
夏季,Syn丰度的分布范围在0(A1站的表层)~831.0×103cells/mL(A3站的表层)之间,调查海区总平均值为(28.9±64.1)×103cells/m L;近岸丰度远高于外海,珠江口南部沿岸出现极高值(图4)。Pro丰度的分布范围为0(沿岸站位)至236.9×103cells/mL(S1-8站的20 m层),调查海区总平均值为(48.0± 37.5)×103cells/m L;高值区呈条带状平行于岸线分布在调查海域中部(图4)。PEuk丰度的分布范围为0(外海站位的150 m或200 m层)至14.4×103cells/m L(h站的100 m层),调查海区总平均值为(1.7±1.6)×cells/mL;高值区呈斑块状分布在雷州半岛附近海域、香港东南面海域以及调查海域南部(图4)。HBac丰度的分布范围为143.5×103cells/m L(m站的200 m层)至2 914.6×103cells/m L(S2-1站的15 m层),调查海区总平均值为(844.3±420.6)×103cells/m L,丰度从近岸向外海迅速降低(图4)。
3.3 超微型浮游生物的垂直分布
冬季,S1断面Syn丰度在位于断面中间的S1-6站25 m层出现最大值,其他站位尤其是珠江口及近岸海域Syn丰度很低,陆架和开阔海域Syn主要聚集在50 m以浅水体中,且分布比较均匀,Pro丰度在东侧S1-10站的25 m层达到最高,其余站位与Syn同样主要分布在50 m以浅水体中,PEuk丰度的次表层最大值现象较前二者明显,整条断面25 m层的丰度值高于其他水层,HBac丰度在珠江口内A1和A2站非常高,且分布均匀,随着向外海水深的增加,丰度迅速降低,最大层逐渐下移至S1-8站的50 m层(图5A~D)。HBac高丰度同样出现在50 m以浅水体中,50 m以下迅速降低,这一现象与三类超微型光合真核生物一致。而S2断面与S1断面之间最大的不同之处在于各类超微型光合浮游生物丰度的次表层最大值现象比较明显(图5a~5d),且丰度最大层深度多在50 m附近,75 m以浅水体中各类群丰度均较高;HBac在水体中的分布有很大的区域差异,近岸丰度高值出现在底层,水深为100 m的S1-5站整个水柱中HBac分布均一,而该站以东海域HBac丰度在表层出现高值。

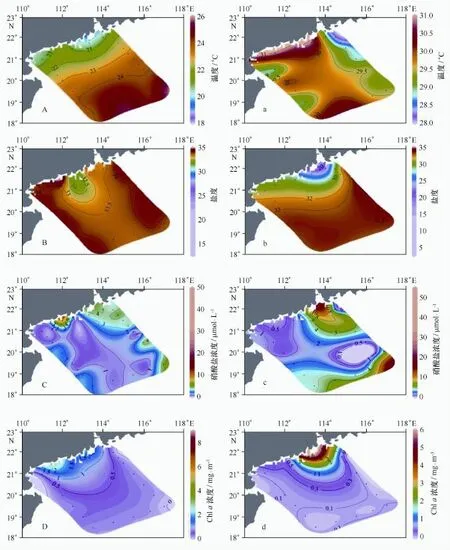
图2 2009年冬季和夏季南海北部海域表层温度、盐度、硝酸盐浓度和Chla浓度的分布Fig.2 Spatial distributions of surface temperature,salinity,nitrate and Chlaconcentrations in winter and summer
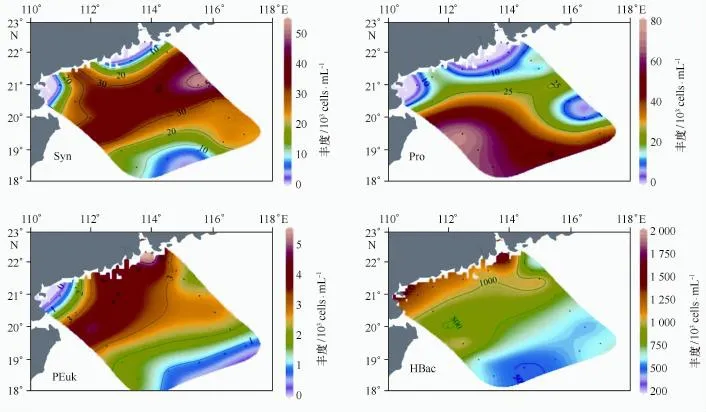
图3 2009年冬季南海北部超微型浮游生物丰度分布Fig.3 Spatial distributions of picoplankton abundances during the winter of 2009

图4 2009年夏季南海北部超微型浮游生物丰度分布Fig.4 Spatial distributions of picoplankton abundances during the summer of 2009

图5 2009年冬季S1断面(A~D)和S2断面(a~d)超微型浮游生物丰度分布Fig.5 Vertical distributions of picoplankton abundances along transect S1(A-D)and S2(a-d)in winter
夏季,S1断面Syn丰度的层化现象比较显著(图6A),表层和次表层明显高于下层水体;Pro丰度在陆坡和开阔海域的25~50 m层出现最大值;PEuk在珠江口内丰度较高,且分布均匀,随着向外海水深的增加,上层水体中丰度迅速降低,高丰度出现在50 m层;HBac同样在近岸海域丰度较高且均匀分布于水体中,在陆架和开阔海则是表层表层丰度较高。与冬季类似,夏季S2断面同样表现出比S1断面更为显著的次表层丰度极大的现象(图6a~6d),尤其是Pro和 PEuk,均在50 m层出现最高丰度;而Syn和HBac在水体中的分布特征比较一致,近岸水体中丰度较高且分布均匀,陆架和开阔海域则次表层最大丰度的现象比较普遍。
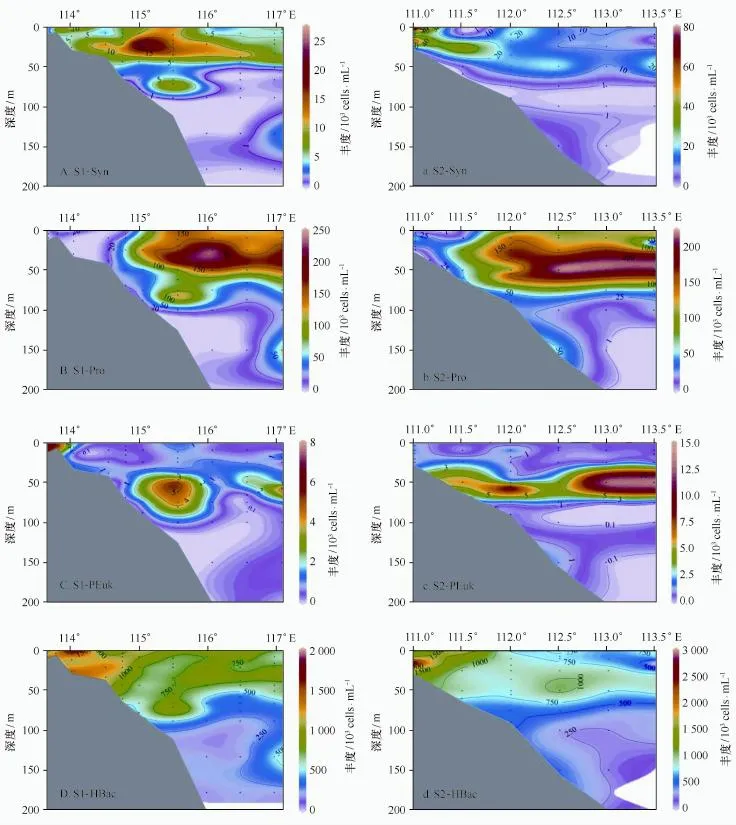
图6 2009年夏季S1断面(A~D)和S2断面(a~d)超微型浮游生物丰度分布Fig.6 Vertical distributions of picoplankton abundances along transect S1(A-D)and S2(a-d)in summer
3.4 超微型浮游生物的碳生物量估算
冬季,Syn的碳生物量分布范围在0.01~12.44 mg/m3之间,平均值为(1.56±1.09)mg/m3;Pro碳生物量分布范围在0~5.99 mg/m3之间,平均为(0.67±0.69)mg/m3;PEuk碳生物量分布范围在0~15.19 mg/m3之间,平均为(3.61±2.02)mg/m3;HBac的碳生物量分布在1.54~31.62 mg/m3之间,平均值为(10.04±4.03)mg/m3,为超微型光合浮游生物的碳生物量的1.7倍。调查海区超微型浮游生物碳生物量绝大部分由HBac贡献,占总超微型浮游生物碳生物量的63%,Syn碳生物量占10%,Pro占4%,PEuk占23%。
夏季,Syn的碳生物量分布范围在0~55.67 mg/m3之间,平均值为(1.96±4.28)mg/m3;Pro的碳生物量分布在0~8.90 mg/m3之间,平均为(1.51 ±1.29)mg/m3;PEuk的碳生物量分布范围为0~21.63 mg/m3,平均为(2.57±2.32)mg/m3;HBac的碳生物量分布范围为1.58~32.06 mg/m3,平均值为(9.29±4.63)mg/m3,为超微型光合浮游生物的碳生物量的1.5倍,较冬季略有下降。调查海区碳生物量的组成与冬季相差不大,大部分由HBac贡献,占到总超微型浮游生物碳生物量的61%,Syn碳生物量占13%,Pro和PEuk分别占10%和17%。
3.5 不同海域超微型浮游生物的丰度和碳生物量组成
冬、夏两季HBac的丰度均比超微型光合浮游生物高1~2个数量级,在超微型浮游生物群落中占绝对优势(图7A)。在冬季近岸陆架海域,HBac丰度占整个超微型浮游生物群落的96%,夏季其所占百分比稍有下降,但在陆坡开阔海域仍占到86%。与丰度构成一致,HBac对超微型浮游生物总碳生物量的贡献同样巨大(图7B),在不同季节不同海域均占60%左右,仅在夏季陆坡海域对Pico碳生物量的贡献稍低,为53%。

图7 2009年冬、夏季不同类群超微型浮游生物在不同海域对丰度(A)和碳生物量(B)的贡献(%)Fig.7 Contribution(%)of different groups of picoplankton to abundance(A)and carbon biomass(B)in the different region of study area during the winter and summer of 2009
超微型光合浮游生物各类群在不同季节不同海域表现出极大的差异。丰度上Syn在近岸陆架海域为优势类群(大于50%),而在陆坡开阔海域其优势地位被Pro取代,尤其夏季,Pro丰度百分比高达94%,是开阔海超微型光合浮游生物群落中的绝对优势类群(图8A)。PEuk丰度所占百分比较小,在冬季近岸海域最高(7%),夏季开阔海域最低,仅占2%,而其在碳生物量构成上具有突出表现:在冬季近岸陆架区PEuk碳生物量占68%,高于Syn(25%)和Pro(7%);在陆坡开阔海域PEuk碳生物量所占比例均高于40%。Syn和Pro对phPico碳生物量的贡献随季节和地域变化较大(图8B):在近岸陆架海域,Syn贡献大于Pro,二者在夏季的贡献均高于冬季;在陆坡开阔海域,冬季Syn碳生物量稍占优势,夏季则由Pro主导(50%),Syn仅占5%。
4 讨论
4.1 不同海域超微型浮游生物的环境适应性

图8 2009年冬、夏季不同类群超微型光合浮游生物在不同海域对丰度(A)和碳生物量(B)的贡献(%)Fig.8 Contribution(%)of different groups of photosynthetic picoplankton to abundance(A)and carbon biomass(B)in the different region of study area during the winter and summer of 2009
冬季,近岸陆架海域受东北季风和底层水涌升的影响[26],水体垂直混合剧烈,表层营养盐得到补充,因此Chla浓度较高(1.91±2.62)mg/m3(表1)。在陆坡开阔海域,受贫营养的外海水影响[27],上层水体中营养盐浓度较低,Chla浓度只有(0.18±0.04)mg/m3(表1)。夏季,珠江径流带来的丰富陆源物质,不断补充浮游植物光合作用所消耗的营养盐,珠江口及附近海区水体肥沃且相对稳定,给浮游植物生长、繁殖带来了有利条件,形成该区域的Chla高值区(图2),但受温跃层的影响,表层以下Chla浓度迅速降低,陆坡开阔海域上层水体营养盐匮乏且因温跃层阻挡得不到补充,浮游植物现存量极低。在这种背景下,各类超微型浮游生物也表现出各自不同的生态分布特点。

表2 超微型浮游生物与环境参数的Pearson相关性分析(括号中为样品数)Tab.2 Pearson correlation analysis between picoplankton and related environmental parameters(sample numbers in the brackets)
已有很多研究表明,Syn是超微型光合浮游生物中对营养盐依赖较强的一类,通常在冬季水体混合增强而给真光层带来丰富营养时该类群具有较高的细胞丰度[28—29],但在南海北部夏季的营养盐由于得到珠江径流和沿岸上升流[27]的补充,营养盐浓度高于冬季,因此近岸陆架区Syn在夏季的丰度是冬季的2倍(表1),这一结论与以往研究一致[18,23]。Syn和Chla浓度的分布具有相当高的一致性,近岸陆架区Syn丰度占超微型光合浮游生物的50%,远高于陆坡开阔海域,说明伴随着近岸微、小型浮游植物的旺发,Syn随之迅速生长繁殖。垂直分布上,Syn主要聚集在50 m以浅的真光层上层水体中,真光层以下则难于生存[30]。
Pro与Syn相反,偏向于在贫营养、低光照环境中生长[4,28,31],层化明显且营养盐处于耗尽状态的海水利于其生长,而在近岸水体中过高的营养盐浓度和重金属成分可能对其生长有毒害作用[32],冬季低温、近岸剧烈的水体混合和高Chla浓度阻碍其进行光吸收作用,均限制其生长繁殖[33—34]。本研究中夏季南海北部陆架、陆坡开阔海域在50 m层附近形成强大的温跃层,跃层以上营养盐浓度极低,Pro则在跃层(真光层底部)附近出现最高丰度(图6B,6b),在夏季S2断面该现象尤为显著,丰度百分比高达94%,是开阔海超微型光合浮游生物群落中的绝对优势类群(图8A)。夏季Pro丰度比冬季有显著的增加,可见温度升高对于Pro生长是有利条件。冬、夏季Pro丰度与温度之间显著的正相关关系也说明了这一点(表2)。有研究认为Pro生长的最低温度为15℃[35],而冬季和夏季南海北部近岸区表层最低温度分别在20~21℃和29~31℃之间,并不构成对Pro生长的限制,因此Pro在近岸区的低丰度甚至“零出现”是受温度以外的上述其他因素的限制,如较低的水体垂直稳定度和高Chla浓度。
与早期研究结果相符[16,18],夏季PEuk与Pico级份Chla浓度之间存在显著的正相关关系(表2)。从夏季S2断面分布图(图6a~d,Pico-Chla断面图未展示)可以看到,PEuk在50 m层出现最大值,呈条带状从近岸向外海延伸,与Pico-Chla在水体中的分布一致。尽管PEuk丰度较小,但由于其细胞体积较大,碳含量较高,它对phPico碳生物量的贡献巨大[36]。在本研究中,PEuk对phPico碳生物量的贡献占40%以上,尤其在冬季近岸陆架海域,其贡献高达68%,这与冬季混合层深度加深,下层富营养水得以进入真光层有关[16—17]。Chen等[23]的研究认为PEuk的高丰度出现在温度、营养盐和Chla浓度处于中等水平的水体中,而其较高的物种多样性可使其丰度在不同环境下保持在较小的波动范围内。
HBac是超微型浮游生物群落中季节变化最小的类群,仅在陆坡开阔海域其丰度有较大的变动(表1)。HBac与盐度之间呈现显著的负相关关系(表2),这可能与外海悬浮有机质和营养物质减少有关。HBac与Chla浓度和各类超微型光合浮游生物也密切相关(表2),这些结果与Le等[37]在东海陆架区的研究结果相符,认为近岸陆架区的高HBac丰度与高Chla浓度带来的高DOC浓度有关。从图5和图6可以看到,HBac在水体中的分布格局与Syn比较相似,以往在南海北部的研究[16,18]也发现了这一点,Syn生长过程中产生的有机质可被HBac利用,而且Syn是超微型光合浮游生物各类群中唯一一类与HBac有持续相关性的超微型浮游生物。
4.2 超微型浮游生物的细胞碳含量转换因子及其碳生物量
超微型浮游生物种类不同,其细胞碳含量的转换因子也不同,而同一类超微型浮游生物在不同季节、不同环境条件下其细胞大小、碳含量也会发生变化[28]。国内外对Syn、Pro、PEuk和HBac细胞体积与碳生物量的转换系数做了很多研究,目前还存在不少争议,本研究参考代表性文献中的转换因子来计算超微型浮游生物的生物量。由表2可看出不同类型的研究海域之间各类超微型浮游生物的碳转换因子存在较大的差异。浮游植物的大小通常随着海域中营养盐浓度的升高而增加,即随着生产力的提高,浮游植物群落从小粒径向大粒径演替[23,38]。Syn和Pro细胞随着水深的增加而变大,尤其是在水体层化明显的夏季;而在平面分布上,Syn和Pro细胞则在近岸海域和营养较为丰富的冬季出现较大粒径[23]。为便于数据比较,本文中各类超微型浮游生物的碳转换因子沿用Liu等[17]在同一海域——南海SEATS站所使用的转换因子,其中Syn和Pro两类细胞由于在真光层的位置不同导致其细胞大小和碳含量差异巨大,因此以60 m为界,60 m以浅Syn和Pro碳转换因子分别为67 fg/cell和24 fg/cell,60m以深则分别为157 fg/cell和62 fg/cell;HBac细胞大小在不同水层中变化不大,统一使用11 fg/cell;PEuk碳转换因子使用1 500 fg/cell。
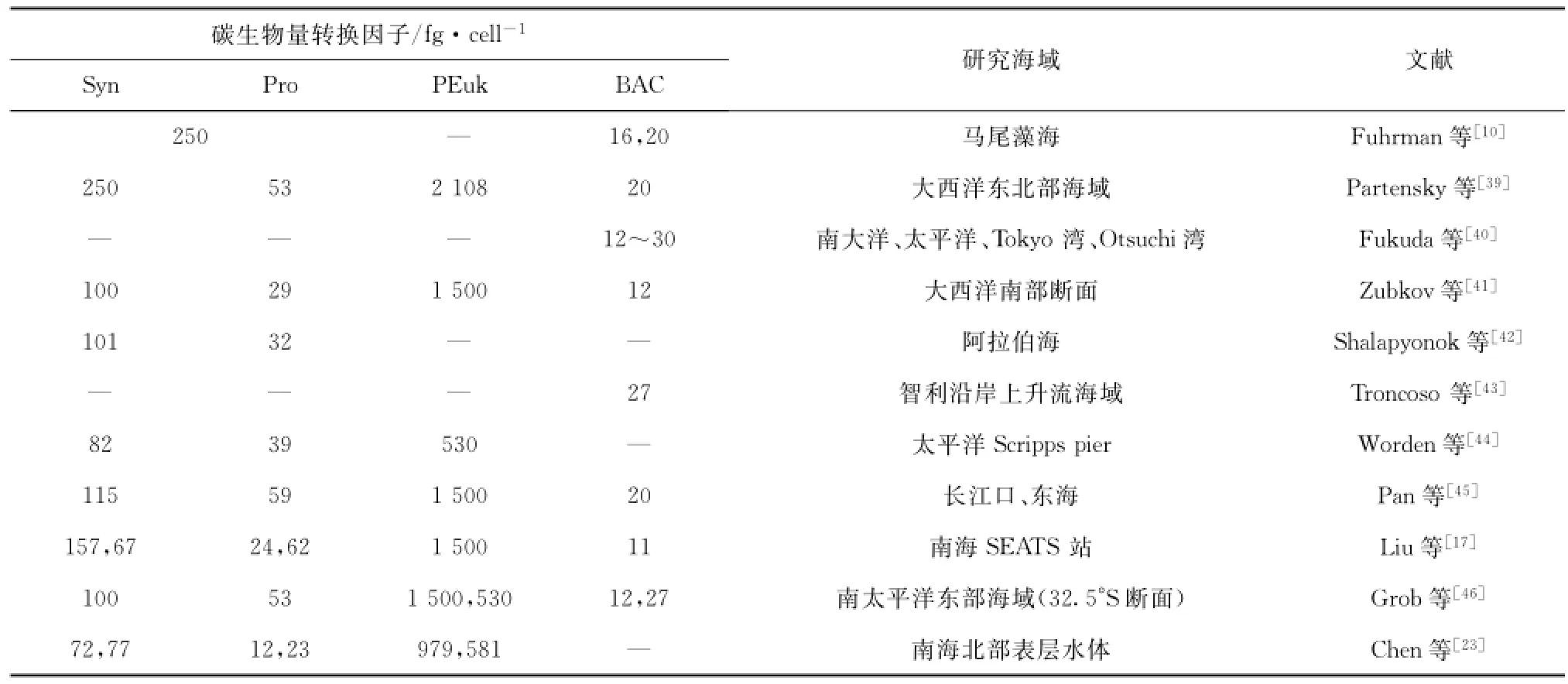
表2 代表性文献中Syn、Pro、PEuk和HBac的碳生物量转换因子Tab.2 Conversion factors from the literature for Syn,Pro,PEuk and HBac carbon biomass
本研究表明,在超微型光合浮游生物群落中,碳生物量的主要贡献者因季节和海域的不同而发生变化。Syn在夏季近岸陆架区碳生物量为(2.97±5.16)mg/m3,占超微型光合浮游生物总碳生物量的41%,而Pro在陆坡开阔海成为主要贡献者(50%),碳生物量为(2.05±0.59)mg/m3。与Syn和Pro不同,PEuk碳生物量以冬季为高,在冬季近岸陆架区达到(4.39 ±2.03)mg/m3,占68%。Chen等[23]和Cai等[18]在南海北部的研究结果显示出超微型光合浮游生物群落结构与本研究具有相同的分布特征。这与Liu等[47]在密西西比河口的研究结果——Syn和PEuk在陆架区丰度高,Pro在外海水中出现高丰度一致。HBac碳生物量在本研究中高于超微型光合浮游生物(表1),该结果与Cai等[18]所得相符,而与Liu等[17]在南海SEATS站的研究结果不一致,SEATS站的结果显示HBac的碳生物量低于超微型光合浮游生物,这与SEATS站位于比本次调查站位更接近贫营养的南海中央海盆有关,低生物量导致HBac可利用的有机质含量低,造成HBac碳生物量低于超微型光合浮游生物[46,48]。
尽管超微型浮游生物个体微小,但它们在海洋上层碳输出方面的作用也是值得被关注的。超微型浮游生物通过聚集、打包作用等过程,形成聚集体直接提高沉降速率,或者通过被摄食进入微型食物环,再通过高营养阶层等的消耗从而间接地输出碳到深海[49—50]。经典理论认为硅藻等大颗粒浮游植物控制了海洋上层的碳通量,尤其在水华发生时,而以超微型浮游生物为主的生态系统内,物质循环主要在上层进行,较少颗粒能输出到真光层以外。然而也有不少研究表明[51],浮游植物对碳输出的贡献与单个细胞的大小并不明显相关。在贫营养性海域,相对小型和微型浮游植物,超微型浮游生物通常有较高的碳生物量并成为高营养级生物的有机碳来源,从而完成从上层海洋向深海的碳输出过程。南海作为我国边缘海中相对贫营养的海域,已有超微型浮游生物碳输出的相关研究工作在该海域开展。
5 结论
2009年冬、夏季在南海北部海域对超微型浮游生物的群落结构、丰度和碳生物量的分布进行研究,发现:
(1)Syn和Pro的平均丰度为夏季高于冬季,PEuk和HBac反之。
(2)Syn、PEuk和HBac丰度在近岸陆架海域高于陆坡开阔海域,Pro则反之。
(3)超微型浮游生物在水体中的分布:Syn和HBac主要分布在跃层以上,跃层以下丰度迅速降低;Pro和PEuk高丰度出现在真光层底部。
以上分布格局的差异取决于环境的变化和4类超微型浮游生物不同的生态生理适应性。
(4)各类群超微型浮游生物碳生物量的贡献因季节和海域类型的不同而变:Syn在夏季近岸陆架区占phPico总碳生物量的41%,Pro在陆坡开阔海成为主要贡献者(50%),PEuk碳生物量以冬季为高(在近岸陆架区占比68%)。冬、夏季HBac碳生物量均高于phPico碳生物量。
(5)相关性分析结果显示Syn与HBac有显著的正相关关系,Syn是超微型光合浮游生物各类群中唯一一类与HBac有持续相关性的超微型浮游生物;Pro丰度与温度之间显著的正相关关系说明温度升高对Pro的生长有利,而其在近岸区的低丰度甚至“零出现”是受温度以外的其他因素(如水体垂直稳定度和高Chla浓度)的限制;PEuk则与Pico-Chla浓度密切相关。致谢:温度、盐度和营养盐数据由国家海洋局南海分局环境监测中心提供,“中国海监81”调查船全体船员对海上采样工作提供无私帮助,谨致谢忱。
[1] Paau A S,Cowles J R,Oro J,et al.Separation of algal mixtures and bacterial mixtures with flow-microfluorometer using chlorophyll and ethidium bromide fluorescence[J].Archives of Microbiology,1979,120(3):271-273.
[2] Yentsch C M,Horan P K.Cytometry in the aquatic sciences[J].Cytometry,1989,10(5):497-499.
[3] Chisholm S W,Olson R J,Zettler E R,et al.A novel free-living prochlorophyte abundant in the oceanic euphotic zone[J].Nature,1988,334(6180):340-343.
[4] Campbell L,Nolla H A,Vaulot D.The importance ofProchlorococcusto community structure in the central North Pacific Ocean[J].Limnology and Oceanography,1994,39(4):954-961.
[5] 宁修仁.流式细胞测定技术在海洋生物和海洋生态环境监测研究中的应用[J].东海海洋,2001,19(3):56-60.
Ning Xiuren.Flow cytometry in marine biological research and ecological environment monitoring[J].Donghai Marine Science,2001,19(3):56-60.
[6] 焦念志,杨燕辉.四类海洋超微型浮游生物的同步监测[J].海洋与湖沼,1999,30(5):506-511.
Jiao Nianzhi,Yang Yanhui.Simultaneous monitoring of autotrophic picoplankton and heterotrophic bacteria[J].Oceanologia et Limnologia Sinica,1999,30(5):506-511.
[7] Marie D,Partensky F,Jacquet S,et al.Enumeration and cell cycle analysis of natural populations of marine picoplankton by flow cytometry using the nucleic acid stain sybr green I[J].Applied and Environmental Microbiology,1997,63(1):186-193.
[8] 于莹,张武昌,蔡昱明,等.冬季和夏季南海北部浮游纤毛虫的分布特点[J].海洋与湖沼,2014,45(4):839-847.
Yu Ying,Zhang Wuchang,Cai Yuming,et al.Distribution patterns of planktonic ciliates in the northern South China Sea in winter and summer,2009[J].Oceanologia et Limnologia Sinica,2014,45(4):839-847.
[9] Campbell L,Vaulot D.Photosynthetic picoplankton community structure in the subtropical North Pacific Ocean near Hawaii(station ALOHA)[J].Deep-Sea Research PartⅠ:Oceanographic Research Papers,1993,40(10):2043-2060.
[10] Fuhrman J A,Sleeter T D,Carlson C A,et al.Dominance of bacterial biomass in the Sargasso Sea and its ecological implications[J].Marine E-cology Progress Series,1989,57:207-217.
[11] Jiao N Z,Yang Y H,Koshikawa H,et al.Microscopic overestimation of heterotrophic bacteria in open waters of China Seas[J].Journal of Microbiology and Biobechnology,2001,11(5):889-901.
[12] Ning X,Chai F,Xue H,et al.Physical-biological oceanographic coupling influencing phytoplankton and primary production in the South China Sea[J].Journal of Geophysical Research,2004,109(C10):C10005.
[13] 乐凤凤,孙军,宁修仁,等.2004年夏季中国南海北部的浮游植物[J].海洋与湖沼,2006,37(3):238-248.
Le Fengfeng,Sun Jun,Ning Xiuren,et al.Phytoplankton in the northern South China Sea in summer 2004[J].Oceanologia et Limnologia Sinica,2006,37(3):238-248.
[14] 孙军,宋书群,乐凤凤,等.2004年冬季南海北部浮游植物[J].海洋学报,2007,29(5):132-145.
Sun Jun,Song Shuqun,Le Fengfeng,et al.Phytoplankton in Northern South China Sea in the winter of 2004[J].Haiyang Xuebao,2007,29(5):132-145.
[15] Wong G T F,Ku T L,Mulholland M,et al.The SouthEast Asian Time-series study(SEATS)and the biogeochemistry of the South China Sea——An overview[J].Deep-Sea Research PartⅡ:Topical Studies in Oceanography,2007,54(14/15):1434-1447.
[16] Ning X R,Li W K W,Cai Y M,et al.Comparative analysis of bacterioplankton and phytoplankton in three ecological provinces of the northern South China Sea[J].Marine Ecology Progress Series,2005,293:17-28.
[17] Liu H B,Chang J,Tseng C M,et al.Seasonal variability of picoplankton in the Northern South China Sea at the SEATS station[J].Deep-Sea Research PartⅡ:Topical Studies in Oceanography,2007,54(14/15):1602-1616.
[18] Cai Y M,Ning X R,Liu C G,et al.Distribution pattern of photosynthetic picoplankton and heterotrophic bacteria in the Northern South China Sea[J].Journal of Integrative Plant Biology,2007,49(3):282-298.
[19] Yang Y H,Jiao N Z.Dynamics of picoplankton in the Nansha Islands area of the South China Sea[J].Acta Oceanologica Sinica,2004,23(3):493-504.
[20] 焦念志,杨燕辉.中国海原绿球藻研究[J].科学通报,2002,47(7):485-491.
Jiao Nianzhi,Yang Yanhui.Ecological studies onProchlorococcusin China seas[J].Science Bulletin,2002,47(15):1243-1250.
[21] Huang B Q,Lin XJ,Liu Y,et al.Ecological study of picoplankton in northern South China Sea[J].Chinese Journal of Oceanology and Limnology,2002,20(S1):22-32.
[22] 钟瑜,黄良民,黄小平,等.冬夏季雷州半岛附近海域微微型光合浮游生物的类群变化及环境影响[J].生态学报,2009,29(6):3000-3008.
Zhong Yu,Huang Liangmin,Huang Xiaoping,et al.Distribution of autotrophic picoplankton and its effect factors in the waters around Leizhou Peninsula in summer and winter[J].Acta Ecologica Sinica,2009,29(6):3000-3008.
[23] Chen B Z,Wang L,Song S Q,et al.Comparisons of picophytoplankton abundance,size,and fluorescence between summer and winter in northern South China Sea[J].Continental Shelf Research,2011,31(14):1527-1540.
[24] Ning X,Sun S,Shi J.The Specification for Observations of Bay Ecosystems[M].Beijing:China Environmental Science Press,2005:337.
[25] Marie D,Partensky F,Vaulot D,et al.Enumeration of phytoplankton,bacteria,and viruses in marine samples[M]//Robinson J P,Darzynkiewicz Z,Dean P N,et al,Current Protocols in Cytometry.New York:John Wiley&Sons Inc,1999.
[26] 薛惠洁,柴扉,王丽娅,等.珠江口及其邻近海域环流模式结构[G]//中国海洋学文集.北京:海洋出版社,2001:138-151.
Xue Huijie,Chai Fei,Wong Lai-an,et al.Zhujiang river estuarine circulation model[G]//Oceanography in China.Beijing:China Ocean Press,2001:138-151.
[27] 柴扉,薛惠洁,侍茂崇.南海升降流区域分布及形成机制分析[G]//中国海洋学文集.北京:海洋出版社,2001:117-128.
Chai Fei,Xue Huijie,Shi Maochong.Formation and distribution of upwelling and downwelling in the South China Sea[G]//Oceanography in China.Beijing:China Ocean Press,2001:117-128.
[28] DuRand M D,Olson RJ,Chisholm SW.Phytoplankton population dynamics at the Bermuda Atlantic Time-seriesstation in the Sargasso Sea[J].Deep-Sea Research PartⅡ:Topical Studies in Oceanography,2001,48(8/9):1983-2003.
[29] Campbell L,Liu H B,Nolla H A,et al.Annual variability of phytoplankton and bacteria in the subtropical North Pacific Ocean at Station ALOHA during the 1991-1994 ENSO event[J].Deep-Sea Research PartⅠ:Oceanographic Research Papers,1997,44(2):167-192.
[30] AgustíS.Viability and niche segregation ofProchlorococcusandSynechococcuscells across the Central Atlantic Ocean[J].Aquatic Microbial E-cology,2004,36(1):53-59.
[31] Lindell D,Post A F.Ultraphytoplankton succession is triggered by deep winter mixing in the Gulf of Aqaba(Eilat),Red Sea[J].Limnology and Oceanography,1995,40(6):1130-1141.
[32] Worden A Z,Binder B J.Application of dilution experiments for measuring growth and mortality rates amongProchlorococcusandSynechococcuspopulations in oligotrophic environments[J].Aquatic Microbial Ecology,2003,30(2):159-174.
[33] Bouman H A,Ulloa O,Barlow R,et al.Water-column stratification governs the community structure of subtropical marine picophytoplankton[J].Environmental Microbiology Reports,2011,3(4):473-482.
[34] Johnson Z I,Zinser E R,Coe A,et al.Niche partitioning amongProchlorococcusecotypes along ocean-scale environmental gradients[J].Science,2006,311(5768):1737-1740.
[35] Olson R J,Chisholm S W,Zettler E R,et al.Spatial and temporal distributions of prochlorophyte picoplankton in the North Atlantic Ocean[J].Deep-Sea Research Part A.Oceanographic Research Papers,1990,37(6):1033-1051.
[36] 宁修仁,蔡昱明,李国为,等.南海北部微微型光合浮游生物的丰度及环境调控[J].海洋学报,2003,25(3):83-97.
Ning Xiuren,Cai Yuming,Li Guowei,et al.Photosynthetic picoplankton in the northern South China Sea[J].Haiyang Xuebao,2003,25(3):83-97.
[37] Le F F,Ning X R,Liu CG,et al.Picoplankton abundanceand biomass in the East China Sea during autumn and winter[J].Oceanology,2012,52(1):48-59.
[38] Li W K W.Macroecological patterns of phytoplankton in the northwestern North Atlantic Ocean[J].Nature,2002,419(6903):154-157.
[39] Partensky F,Blanchot J,Lantoine F,et al.Vertical structure of picophytoplankton at different trophic sites of the tropical northeastern Atlantic Ocean[J].Deep-Sea Research PartⅠ:Oceanographic Research Papers,1996,43(8):1191-1213.
[40] Fukuda R,Ogawa H,Nagata T,et al.Direct determination of carbon and nitrogen contents of natural bacterial assemblages in marine environments[J].Applied and Environmental Microbiology,1998,64(9):3352-3358.
[41] Zubkov M V,Sleigh M A,Burkill P H,et al.Picoplankton community structure on the Atlantic Meridional Transect:a comparison between seasons[J].Progress in Oceanography,2000,45(3/4):369-386.
[42] Shalapyonok A,Olson R J,Shalapyonok L S.Arabian Sea phytoplankton during Southwest and Northeast Monsoons 1995:composition,size structure and biomass from individual cell properties measured by flow cytometry[J].Deep-Sea Research PartⅡ:Topical Studies in Oceanography,2001,48(6/7):1231-1261.
[43] Troncoso V A,Daneri G,Cuevas L A,et al.Bacterial carbon flow in the Humboldt Current System off Chile[J].Marine Ecology Progress Series,2003,250:1-12.
[44] Worden A Z,Nolan J K,Palenik B.Assessing the dynamics and ecology of marine picophytoplankton:the importance of the eukaryotic component[J].Limnology and Oceanography,2004,49(1):168-179.
[45] Pan L A,Zhang J,Zhang L H.Picophytoplankton,nanophytoplankton,heterotrohpic bacteria and viruses in the Changjiang Estuary and adjacentcoastal waters[J].Journal of Plankton Research,2007,29(2):187-197.
[46] Grob C,Ulloa O,Li W K W,et al.Picoplankton abundance and biomass across theeastern South Pacific Ocean along latitude 32.5°S[J].Marine Ecology Progress Series,2007,332:53-62.
[47] Liu H B,Dagg M,Campbell L,et al.Picophytoplankton and bacterioplankton in the Mississippi River plume and its adjacent waters[J].Estuaries,2004,27(1):147-156.
[48] Kaiser K,Benner R.Organic matter transformations in the upper mesopelagic zone of the North Pacific:chemical composition and linkages to microbial community structure[J].Journal of Geophysical Research,2012,117(C1),doi:10.1029/2011JC007141.
[49] 黄邦钦,柳欣.边缘海浮游生态系统对生物泵的调控作用[J].地球科学进展,2015,30(3):385-395.
Huang Bangqin,Liu Xin.Review on planktonic ecosystem and its control on biological pump in the marginal seas[J].Advances in Earth Science,2015,30(3):385-395.
[50] Richardson T L,Jackson G A.Small phytoplankton and carbon export from the surface Ocean[J].Science,2007,315(5813):838-840.
[51] Waite A M,Safi K A,Hall J A,et al.Mass sedimentation of picoplankton embedded in organic aggregates[J].Limnology and Oceanography,2000,45(1):87-97.
Seasonal variation of picoplankton abundance and biomass in the northern South China Sea in summer and winter 2009
Le Fengfeng1,3,Cai Yuming1,3,Sun Jun4,5,Hao Qiang1,2,3,Liu Chenggang1,2,3,Zhai Hongchang1,3,Chen Jianfang1,2,3
(1.Second Institute of Oceanography,State Oceanic Administration,Hangzhou 310012,China;2.State Key Lab of Satellite Ocean Environment Dynamics,Hangzhou 310012,China;3.Key Lab of Marine Ecosystems and Biogeochemistry,State Oceanic Administration,Hangzhou 310012,China;4.College of Marine and Environmental Sciences,Tianjin University of Science and Technology,Tianjin 300457,China;5.Tianjin Key Laboratory of Marine Resources and Chemistry,Tianjin University of Science and Technology,Tianjin 300457,China)
The abundance,carbon biomass and distribution of picoplankton were investigated during the summer(August)and winter(February)of 2009 extending from near-shore coastal waters to oligotrophic open waters in northern South China Sea(nSCS).The results showed that the average abundances ofSynechococcus(Syn)andProchlorococcus(Pro)were higher in summer than winter,while Picoeukaryotes(PEuk)and heterotrophic bacteria(HBac)were opposite to Syn and Pro.Syn,PEuk and HBac were most abundant in the eutrophic coast region and continental shelf,while Pro was dominant in the slope and open waters.In vertical profile,the high abundance of Syn mainly appeared above the thermocline and decreased sharply below it.The high Pro abundance in the water column mostly appeared at the bottom of euphotic depth,as well as PEuk.The distribution of HBac was similar to Syn.These different distribution patterns depend on environmental variation and the ecological and physiological adaptation of each group of picoplankton.The contribution of each group of photosynthetic picoplankton biomass varied with the season and sea area:in the summer coastal shelf area,Syn accounted for 41%of total photosynthetic picoplankton biomass;Pro was major contributor(50%)in the slope open waters;while PEuk biomass took 40%higher in winter(reached 68%in the coastal shelf area).And HBac biomass was higher than photosynthetic picoplankton biomass both in the winter and summer.
northern South China Sea;photosynthetic picoplankton;heterotrophic bacteria;abundance and carbon biomass;seasonal comparison
Q178.53
A
0253-4193(2015)12-0041-15
乐凤凤,蔡昱明,孙军,等.2009年冬、夏季南海北部超微型浮游生物的分布特征及其环境相关分析[J].海洋学报,2015,37(12):41—55,
10.3969/j.issn.0253-4193.2015.12.005
Le Fengfeng,Cai Yuming,Sun Jun,et al.Seasonal variation of picoplankton abundance and biomass in the northern South China Sea in summer and winter 2009[J].Haiyang Xuebao,2015,37(12):41—55,doi:10.3969/j.issn.0253-4193.2015.12.005
2015-06-22;
2015-11-02。
国家自然科学基金资助项目(91128212,90711006,41306162,41006101,40506032);国家海洋局第二海洋研究所基本科研业务费专项(JG1310);全球变化与海气相互作用专项(GASI-03-01-03-02)。
乐凤凤(1981—),女,浙江省舟山市人,主要从事海洋生态学研究。E-mail:le_ff@126.com
