乙酸乙酯皂化反应速率常数测定实验改进
2015-06-01刘振
刘 振
(西安文理学院化学与化学工程学院,西安 710065)
乙酸乙酯皂化反应速率常数测定实验改进
刘 振
(西安文理学院化学与化学工程学院,西安 710065)
以电导率法测定乙酸乙酯皂化反应速率常数是大学物理化学专业必修动力学实验之一,但在实际操作过程中,溶液反应的起始与终了浓度均难以精确测定.通过对该实验的改进,通过模拟电导滴定的方式准确测定皂化反应起始与终了浓度,较传统方法相比具有操作简便、测量结果准确的优点.
乙酸乙酯;皂化;速率常数
以电导法测定乙酸乙酯皂化反应速率常数是物理化学动力学部分的一个重要实验,属典型的二级反应,也是目前测量反应速率常数实验教学最常用的例证[1].其离子反应式如下:

目前,对此实验均采用乙酸乙酯和氢氧化钠初始浓度相等的条件下进行[2-4],此时二级反应速率方程式表示为:其中c为反应物的初始浓度,x为产物浓度.随着皂化反应的进行,溶液中导电能力强的OH-逐渐被导电能力弱的CH3COO-所取代,溶液导电能力逐渐降低.故而可采用电导率仪跟踪测量皂化反应进程中电导率随时间的变化,从而达到跟踪反应物浓度随时间变化的目的.

然而由于乙酸乙酯易挥发,难以做到二者浓度相等,再者无法直接测量反应完全时体系的电导率值,故而对G0及Gt测量产生偏差,造成对反应的速率常数k的计算误差较大.本文采用根据反应起始时氢氧化钠溶度调整乙酸乙酯浓度,通过配制系列溶液测定电导率并以作图方法求得反应终了浓度的方法,以使测量结果更加精确.
1 实验部分
1.1 仪器与试剂
DDS-11A型电导仪(上海雷磁仪器设备有限公司);HH-601超级恒温水浴(江苏金坛康华电子仪器制造厂);三管电导池(自制).
冰醋酸(分析纯,国药集团化学试剂公司);氢氧化钠(分析纯,国药集团化学试剂公司);乙酸乙酯(分析纯,国药集团化学试剂公司).
1.2 操作步骤
1.2.1 溶液配制
1)氢氧化钠及乙酸乙酯溶液配制:称取0.4 g氢氧化钠配制成0.02 mol·L-1的溶液,然后以邻苯二甲酸氢钾标定之,再根据氢氧化钠溶液的准确浓度以精确称量方式配制相同浓度的乙酸乙酯溶液.
2)0.06 mol·L-1醋酸配制:以容量瓶配制0.06 mol·L-1醋酸.
1.2.2 G0与G∞的测量
用0.06 mol·L-1醋酸与标定好的氢氧化钠进行混合,为了确定反应是否完全,采用测定混合溶液电导率值并通过作图方法确定G∞的值.在6个比色管(规格25 ml)中分别加入12.5 mL已标定的氢氧化钠溶液,然后依次向其中加入0、2、3、4、5、6 mL 0.06 mol·L-1醋酸溶液,再以蒸馏水稀释至刻度,盖上塞子,恒温15 min.依次测出6个比色管中溶液的电导率值,由此可得G0(加入0 mL醋酸比色管溶液),同时做图求得G∞的值.
1.2.3 Gt测量
1)将三管电导池安装在恒温水浴内,开启水浴搅拌;
2)分别移取氢氧化钠及醋酸注入三管电导池左右管中,恒温20 min;
3)开启搅拌,插入电极,用洗耳球将左管和右管溶液同时挤入中间管中,并测量其电导值;
4)每隔2 min读一次数据,直至电导值变化不是很大;
5)反应结束后,洗净电导池和电极.
2 结果与讨论
以实验温度为25℃,分别测得0.021 mol·L-1氢氧化钠与0、2、3、4、5、6 mL 0.06 mol·L-1醋酸溶液混合后电导率值,如表1所示.

表1 氢氧化钠醋酸溶液混合后电导率值
由测量得G0为2.25,通过作图得G∞=0.925(拐点处)(见图1).
表2是测得的Gt值.
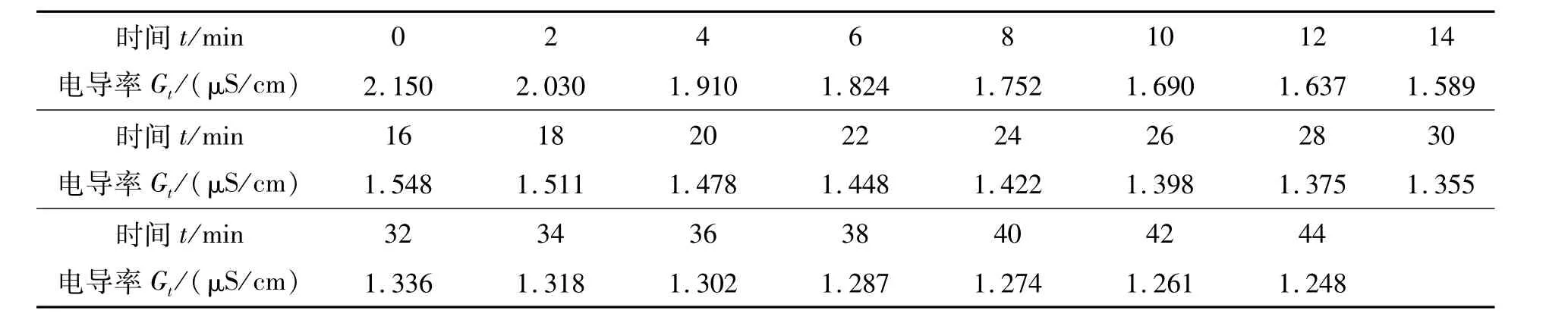
表2 溶液反应过程中电导率Gt测量结果
由表2求得(Gt-G0)/(Gt-G∞)值.
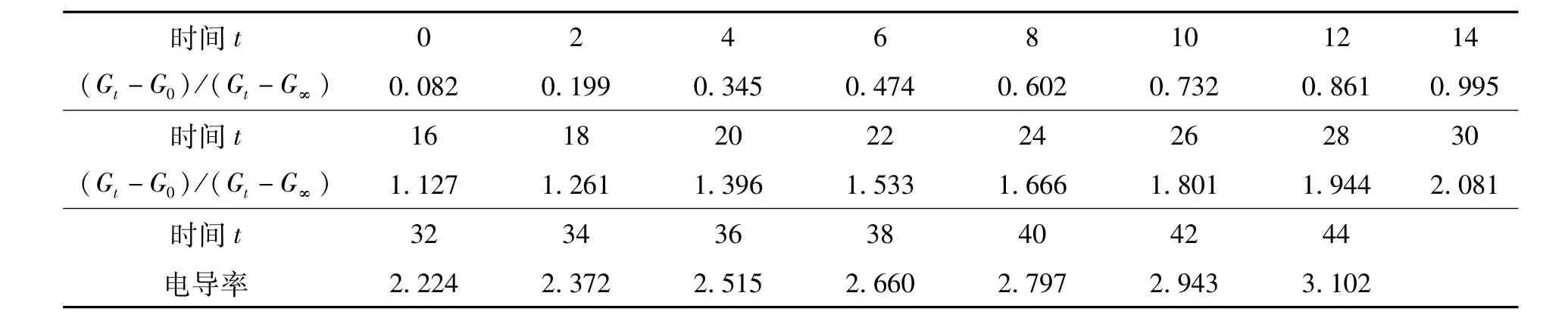
表3 (Gt-G0)/(Gt-G∞)值计算结果
利用(Gt-G0)/(Gt-G∞)对t作图应得一条直线,由斜率即可求得反应的速率常数k值.
由图2得出直线的斜率为0.068 38,求出速率常数k为6.512 min-1·mol-1·L-1.
从文献中查到此温度下反应速率常数为6.508 min-1·mol-1·L-1,测量结果与文献值接近.
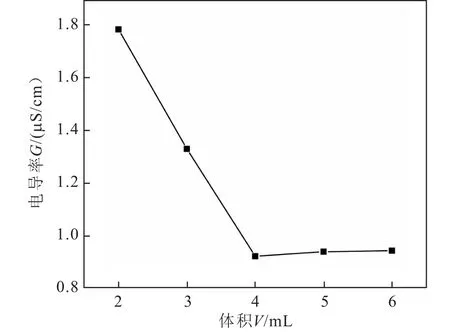
图1 氢氧化钠醋酸溶液混合后电导率值

图2 (Gt-G0)/(Gt-G∞)对t作图结果
3 结论
由以上实验测定数据可知,根据反应起始时氢氧化钠溶度调整乙酸乙酯浓度,通过配制系列溶液测定电导率并以作图方法求得反应终了时刻电导率测量反应速率常数,其实验数据处理、作图结果精确性均优于传统测量方式.
[1] 邵水源,刘向荣.pH值法测定乙酸乙酯皂化反应速率常数[J].西安科技学院学报,2004,24(2):196-199.
[2] 复旦大学.物理化学实验:第3版[M].北京:高等教育出版社,2004.
[3] 北京大学化学系物理化学教研室.物理化学实验:第3版[M].北京:北京大学出版社,1995.
[4] 罗澄源.物理化学实验[M].北京:高等教育出版社,1995.
[责任编辑马云彤]
Experiment Im provement of Reaction Rate Constant in Ethyl Acetate Saponification
LIU Zhen
(College of Chemistry and Chemical Engineering,Xi'an University,Xi'an 710065,China)
Determining of ethyl acetate saponification reaction rate constant by electric conductivitymethod is one of the compulsory dynamic experiments for the physics and chemistry major.In the application,the difficulty lies in determining the accuracy of the solution concentration both at the beginning and end of the reaction.The problem is solved by simulating conductometric titration.Compared with the traditionalmethod,the new one proves to be of easier operation.The outcome is alsomore accurate.
Ethyl acetate;Saponification;rate constant
O621.25+6.5
A
1008-5564(2015)02-0017-03
2014-11-17
刘 振(1982—),男,辽宁大连人,西安文理学院化学与化学工程学院助理实验师,硕士,主要从事物理化学实验教学与无机材料的研究.
