水通道蛋白-5与多药耐药因子在结肠癌组织中的表达及其关系
2015-06-01石晓明吴胜春杨永宾吕柏楠
石晓明,吴胜春,唐 雷,杨永宾,吕柏楠
(河北省人民医院普外二科,石家庄 050051)
论著·临床研究
水通道蛋白-5与多药耐药因子在结肠癌组织中的表达及其关系
石晓明,吴胜春,唐 雷,杨永宾,吕柏楠△
(河北省人民医院普外二科,石家庄 050051)
目的 检测不同分化程度结肠癌组织中水通道蛋白(AQP)-5与耐药因子的表达及相互关系。方法 对45例结肠癌组织、36例癌旁组织采用实时荧光定量PCR(RT-PCR)、蛋白免疫印迹法(Western blot)、免疫组织化学染色检测AQP-5及耐药因子P-糖蛋白(P-gp)、谷胱甘肽转移酶(GST-π)、拓扑异构酶(TopoⅡ)、胸苷酸的限速酶(TS)的表达情况。结果 免疫组织化学染色结果表明,AQP-5主要分布于细胞膜和细胞质;RT-PCR和Western blot检测结果显示,结肠癌组织中AQP-5的表达显著高于癌旁对照组(P<0.05),且表达量随分化程度降低而升高(P<0.05)。免疫组织化学染色发现,P-gp主要分布于细胞膜和细胞质,GST-π主要分布于细胞核和细胞质,TopoⅡ主要分布于细胞核,TS主要分布于细胞质。RT-PCR和Western blot检测结果显示,结肠癌组织中耐药因子表达量显著高于癌旁组织(P<0.05),其中P-gp、GST-π、TopoⅡ随着分化程度降低表达增加,TS在不同分化程度结肠癌组织中表达变化不明显(P>0.05)。AQP-5与P-gp、GST-π、TopoⅡ的表达呈正相关(P<0.05),与TS表达无相关性(P>0.05)。结论 AQP-5与耐药因子P-gp、GST-π、TopoⅡ、TS蛋白在结肠癌组织中高度表达,可能促进了结肠癌的转移和进展。
水通道蛋白质5;结肠肿瘤;耐药基因
水通道蛋白(aquaporin,AQP)是一类广泛存在于细胞膜上的、具有高选择性的、特异转运水分子的通道[1]。迄今为止,已经发现的AQP有14种,它们不仅在水分子的转运过程中至关重要,而且在细胞的生命活动过程中同样发挥极其重要的作用。AQP不仅在肾脏、中枢神经系统、眼睛、脂肪组织、外分泌腺等组织中发挥生理作用,还参与了肿瘤细胞的增殖、侵袭和转移等病理过程[2-3]。目前已发现,AQP家族成员在许多肿瘤中高表达,亦有研究证实AQP-5在结肠癌组织中表达上调[4],但有关AQP-5表达与结肠癌组织多药耐药的形成之间的关系未见报道。本研究通过检测AQP-5与多药耐药因子在结肠癌组织中的表达及其关系,为阐明AQP-5在结肠癌发病过程中的作用机制及为临床新的肿瘤治疗靶点确定提供实验依据。
1 资料与方法
1.1 一般资料 在知情同意的前提下,选择本院2009年8月至2011年12月手术切除并经病理确诊的结肠癌患者45例,其中男25例,女20例,年龄39~77岁,平均58岁,所有患者均无心脏病、糖尿病、高血压等其他基础疾病,术前均未接受过任何放化疗或者免疫治疗。组织病理学分类均为腺癌,其中低分化癌14例,中分化癌19例,高分化癌12例。其中36例标本取距癌组织超过5 cm作为癌旁组;男19例,女17例;入选对象年龄46~77岁,平均61岁。所有组织取出后迅速投入液氮中速冻,然后转入-80 ℃低温冰箱保存。RNA提取试剂购自美国Invitrogen公司;实时荧光定量PCR(RT-PCR)试剂盒购自美国Promega公司;P-糖蛋白(P-gp)、谷胱甘肽转移酶(GST-π)、拓扑异构酶(TopoⅡ)、胸苷酸的限速酶(TS)及GAPDH抗体购自美国Santa Cruz公司;PCR引物由上海生工生物工程有限公司合成。

表1 AQP-5及耐药因子在不同分化程度结肠癌组织中的阳性表达[n(%)]
1.2 方法
1.2.1 RT-PCR检测 组织匀浆后,按照Invitrogen公司Trizol试剂说明书的要求,采用一步法常规方法提取组织总RNA。用Nandrop仪器测定RNA的纯度和浓度,并用1%琼脂糖凝胶电泳鉴定RNA完整性。依照RT-PCR试剂盒说明书的要求,各组取RNA 1 μg,将其反转录为cDNA并建立PCR反应体系。建立20 μL PCR反应体系:1 μL逆转录产物作为RT-PCR反应的模板、10 μL的2×UltraSYBR Mixture、1 μL浓度为10 μmol/L的上下游引物、8 μL无DNase-RNase水。利用RT-PCR仪扩增,PCR反应参数为:95 ℃ 5 min预变性后,95 ℃变性30 s,60 ℃退火30 s,72 ℃延伸30 s,进行40个循环,于每个循环的延伸阶段采集荧光信号检测目标基因与内参照基因的荧光强度(以GAPDH为内参照基因)。扩增完毕后,进入结果分析界面,计算目的基因表达的相对定量值(RQ值)且以此为依据进行统计学分析。实验所用引物序列如下,AQP-5上游引物:5′-CGC CGC AAT CCT CTA TGG-3′;下游引物:5′-GCT GGA ATT ACC GCG GCT-3′。P-gp上游引物:5′-GTG GGG CAA GTC AGT TCA TT-3′;下游引物:5′-TCT TCA CCT CCA GGC TCA GT-3′。GST-π上游引物:5′-GGA GAC CTC ACC CTG TAC CA-3′;下游引物:5′-GGC TAG GAC CTC ATG GAT CA-3′。TopoⅡ上游引物:5′-CAG GTG GTC GTA ATG GTT ATG-3′;下游引物:5′-TTT GGA CAG ATC TGG TTG GA-3′。TS上游引物:5′-ACC AAC CCT GAC GAC AGA AG-3′;下游引物:5′-CAT GTC TCC CGA TCT CTG GT-3′。GAPDH上游引物:5′-TGA ACG GGA AGC TCA CTG G-3′;下游引物:5′-GCT TCA CCA CCT TCT TGA TGT C-3′。
1.2.2 蛋白免疫印迹法(Western blot)检测 临床组织样本匀浆后,加入组织裂解液,冰上裂解30 min,4 ℃,8 000 r/min离心10 min,将上清液(总蛋白)转移到新的EP管,用改良的Lowry法进行蛋白定量。各组分别取等量的蛋白样本上样,经聚丙烯酰胺凝胶电泳(PAGE)分离后,电转移至PVDF膜,5%脱脂奶粉室温封闭2 h,用相应稀释后的AQP-5、P-gp、GST-π、TopoⅡ、TS或内参照GAPDH一抗4 ℃孵育过夜,TBST漂洗3次后加入相应二抗室温孵育2 h,TBST漂洗3次,TBS漂洗1次,化学发光法进行显色,对条带进行吸光度(A)积分扫描。GAPDH作为内参照。用各蛋白A值/内参照A值的比值进行比较。
1.2.3 免疫组织化学染色检测 病理切片,经4%多聚甲醛固定24 h以上,乙醇梯度脱水,石蜡垂直定向包埋,4 μm厚度连续切片。采用SP三步法进行免疫组织化学染色。切片于微波炉20 min进行抗原修复。冷却后于切片上滴加3 % 过氧化氢(H2O2)室温孵育10 min以消除内源性过氧化物酶的影响,PBS冲洗后滴加10%山羊血清工作液,室温孵育30 min,倾去血清,加入AQP-5、P-gp、GST-π、TopoⅡ、TS一抗,4 ℃过夜。PBS室温漂洗后,滴加生物素标记的二抗,37 ℃孵育30 min。PBS室温漂洗后,滴加辣根过氧化物酶 (HRP)标记的链霉卵白素,37 ℃孵育15 min,PBS室温漂洗。3,3′-二氨基联苯胺(DAB)显色,苏木精复染,常规脱水,透明,封片。显微镜下观察各目标分子的表达变化。
1.3 统计学处理 采用SPSS 11.5统计软件进行分析,阳性率间比较采用χ2检验,相关性分析采用Spearman相关分析,以P<0.05为差异有统计学意义。
2 结果
2.1 AQP-5在不同分化程度结肠癌中的表达 RT-PCR检测结果显示,癌旁对照组织中AQP-5 mRNA表达很少,而结肠癌组织中AQP-5 mRNA的表达水平明显高于癌旁组(P<0.05),且AQP-5 mRNA的表达量随分化程度降低而升高,见图1。Western blot检测AQP-5蛋白的表达水平,结果与mRNA的表达一致,即结肠癌组织中AQP-5蛋白表达水平明显高于癌旁组(P<0.05),随分化程度降低而升高,见图2。免疫组织化学染色也发现,AQP-5主要分布于细胞膜和细胞质,结肠癌组织中阳性棕色颗粒较癌旁对照组织颜色深且数量多,而在癌旁组织几乎没有表达,在癌旁对照组织中表达水平明显低于结肠癌组织(P<0.05)。
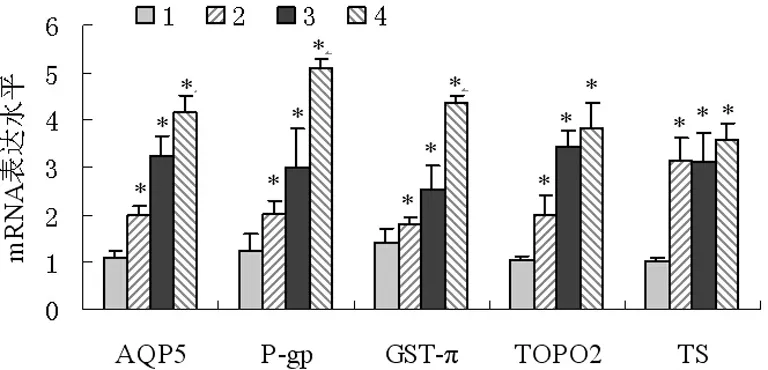
1:癌旁对照组;2:高分化癌组;3:中分化癌组;4:低分化癌组;*:P<0.05,与癌旁对照组比较。
图1 各组AQP-5及耐药因子mRNA的表达变化
2.2 耐药因子P-gp、GST-π、TopoⅡ、TS在不同分化程度结肠癌中的表达 RT-PCR和Western blot结果显示,癌旁对照组织中耐药因子P-gp、GST-π、TopoⅡ、TS的mRNA和蛋白的表达量很低,而结肠癌组织中几种耐药因子的表达与癌旁对照组相比显著升高(P<0.05),且P-gp、GST-π、TopoⅡ的表达量随分化程度降低而升高,TS的表达在不同分化程度结肠癌组织中的变化不明显,见图2~3。免疫组织化学染色发现,P-gp主要分布于细胞膜和细胞质,GST-π主要分布于细胞核和细胞质,TS主要分布于细胞质,TopoⅡ主要分布于细胞核,结肠癌组织中耐药因子阳性棕色颗粒较癌旁对照组织颜色深且数量多。
2.3 AQP-5与耐药因子P-gp、GST-π、TopoⅡ、TS表达的相关性 经Spearman等级相关性分析,AQP-5与P-gp、GST-π、TopoⅡ的表达呈正相关(P<0.05),与耐药因子TS表达无相关性(P>0.05),见表1。

1:癌旁对照组;2:高分化癌组;3:中分化癌组;4:低分化癌组;*:P<0.05,与癌旁对照组比较。
图2 各组AQP-5及耐药因子蛋白的表达变化
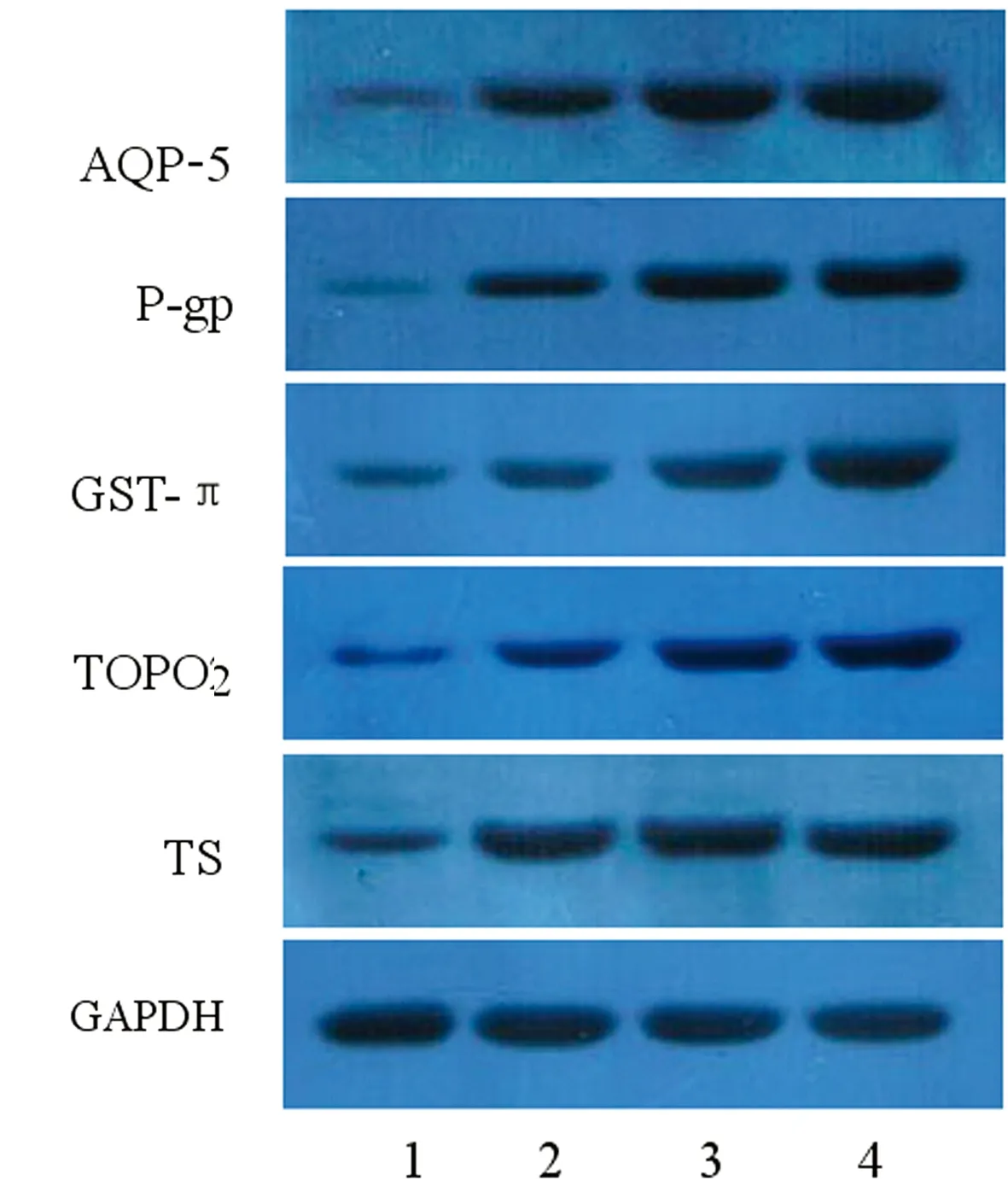
1:癌旁对照组;2:高分化癌组;3:中分化癌组;4:低分化癌组。
图3 各组AQP-5及耐药因子蛋白的表达
3 讨论
结肠癌是我国常见的消化道肿瘤,且发病率呈逐年上升的趋势。其恶性度高,严重威胁着民众的健康。化疗是目前结肠癌主要的辅助治疗方法,尤其在出现淋巴结转移灶的早期结肠癌和进展结肠期癌的治疗中,化疗占有极其重要的位置。然而,化疗效果受许多因素的影响,其中肿瘤对化疗药物不敏感可直接导致化疗失败。而肿瘤细胞对化疗药物不敏感的主要原因是肿瘤细胞产生了耐药,耐药包括原发性耐药和获得性耐药。原发性耐药是本身存在于肿瘤细胞内的耐药,而获得性是化疗后产生的耐药。肿瘤细胞在由一种化疗药物诱导耐药后,同时对其他结构和作用机制不同的药物也产生交叉耐药的现象,称为MDR。
AQP在参与体液分泌和吸收的多种细胞中广泛表达,主要生理功能是调控细胞水的进出。此外,部分AQP还参与甘油、尿素等其他小分子物质的转运[5]。近年来,随着研究的不断深入,科研人员发现AQP在高血压、脑水肿、肿瘤等一些疾病病理过程中表达异常。特别是在多种肿瘤中的高表达及对肿瘤细胞的作用及机制的研究已经成为目前的研究热点[6]。本文研究了AQP-5和耐药因子在肿瘤中的表达及相互关系。
近年来对肿瘤MDR机制的研究认为,MDR的产生机制非常复杂[7-9],可总体分为以下几类:(1)经典的耐药机制,即由膜糖蛋白介导的具有能量依赖性“药泵”的机制,与此途径相关的耐药蛋白包括P-gp、多药耐药相关蛋白、肺耐药相关蛋白(LRP)等;(2)由酶介导的耐药机制,与此途径相关的耐药蛋白包括TopoⅡ、GST-π、TS、蛋白激酶C(PKC)等;(3)由凋亡基因介导的耐药机制,与耐药相关的基因包括bcl-2家族、c-myc、p53等。当前,人们对AQP-5与MDR基因在结肠癌组织中的表达及其关系尚不明确。
本研究发现,癌旁对照组织中AQP-5几乎没有表达,而结肠癌组织中AQP-5的表达显著增加,且AQP-5的表达量随结肠癌的分化程度降低而升高,提示AQP-5在结肠癌的发生、发展过程中发挥重要作用。癌旁对照组织中耐药因子P-gp、GST-π、TopoⅡ、TS的mRNA和蛋白的表达量都很低,而结肠癌组织中几种耐药因子的表达与对照组相比显著升高,且P-gp、GST-π、TopoⅡ的表达量随分化程度降低而升高,TS的表达在不同分化程度结肠癌组织中的变化不明显。既然AQP-5和耐药因子表达P-gp、GST-π、TopoⅡ、TS在结肠癌组织中的表达均升高,那么AQP-5和耐药因子表达之间是否具有相关性。经分析证实,AQP-5的表达与耐药因子TS表达无相关性,与耐药因子P-gp、GST-π、TopoⅡ的表达相关呈正相关。
综上所述,在P-gp、GST-π、TopoⅡ介导的耐药途径中AQP-5可能发挥了一定作用,而AQP-5与TS之间未发现明显关系。但本研究尚处于初级阶段,AQP-5调控结肠癌多药耐药的具体机制还有待进一步研究。
[1]Maqni F,Sarto C,Ticozzi D,et al.Proteomic knowledge of humanaquaporins[J].Proteomics,2006,6(20):5637-5649.
[2]Agre P,Kozono D.Aquaporin water channels:molecular mechanisms for human diseases[J].FEBS Lett,2003,555(1):72-78.
[3]Verkman AS.More than just water channels:unexpected cellular roles of aquaporins[J].J Cell Sci,2005,118(15):3225-3232.
[4]Kang SK,Chae YK,Woo J,et al.Role of human aquaporin 5 in colorectal carcinogenesis[J].Am J Pathol,2008,173(2):518-525.
[5]Hara M,Verkman AS.Glycerol replacement corrects defective skin hydration,elasticity,and barrier function in aquaporin-3-deficient mice[J].Proc Natl Acad Sci U S A,2003,100(12):7360-7365.
[6]Jeyaseelan K,Sepramaniam S,Armugam A,et al.Aquaporins:a promising target for drug development[J].Expert Opin Ther Targets,2006,10(6):889-909.
[7]Schinkel AH,Jonker JW.Mammalian drug efflux transporters of the ATP binding cassette(ABC) family:an overview[J].Adv Drug Del Rev,2003,55(1):3-29.
[8]van Zanden JJ,Geraets L,Wortelboer HM,et al.Structural requirements for the flavonoid-mediated modulation of glutathione S-transferase P1-1 and GS-X pump activity in MCF7 breast cancer cells[J].Biochem Pharmacol,2004,67(8):1607-1617.
[9]Oloumi A,MacPhail SH,Johnston PJ,et al.Changes in subcellular distribution of topoisomerase IIalpha correlate with etoposide resistance in multicell spheroids and xenograft tumors[J].Cancer Res,2000,60(20):5747-5753.
Expression of aquaporin 5 and resistance gene in human colon cancer and their correlation
ShiXiaoming,WuShengchun,TangLei,YangYongbin,LvBonan△
(DepartmentofGeneralSurgery,HebeiPeople′sHospital,Shijiazhuang,Hebei050051,China)
Objective To investigate the expression patterns and significance of aquaporin 5 (AQP-5) and multidrug-resistance associated genes in human colon cancer with different differentiation degree and their correlation.Methods The expression of aquaporin 5 and resistance genes P-gp,GST-π,TopoⅡ,and TS in human 45 cases colon cancer tissues with different differentiation degree and 36 cases of adjacent mucosa tissues as well as 58 cases of normal colonic epithelium were detected by quantitative RT-PCR,Western blot and immunohistochemistry.Results Immunohistochemistry results showed that AQP-5 distributed mainly in the cell membrane and the cytoplasm.Fluorescence quantitative RT-PCR and Western blot showed that AQP-5 expression could not be detected in adjacent mucosa tissues and normal colonic epithelium tissues.The AQP-5 expression level was higher in colon cancer tissues compared with adjacent mucosa tissues and normal colonic epithelium tissues (P<0.05),and the expression intensity was correlated with the differentiation degree of colon cancer tissues (P<0.05).The results of immunohistochemistry indicated that P-gp distributed mainly in the cell membrane and the cytoplasm,GST-π mainly distributed in the nuclei and cytoplasm,Topo Ⅱ mainly distributed in the nucleus,and TS distributed mainly in the cytoplasm.Fluorescence quantitative RT-PCR and Western blot results showed that the expression levels of all resistance genes detected were higher in colon cancer tissues compared with adjacent mucosa tissues and normal colonic epithelium tissues(P<0.05).Furthermore,P-gp,GST-π,and Topo Ⅱ expression were negatively correlated with the differentiation degree of colon cancer tissues,the more poor differentiation level of tissue,the higher expression level of P-gp,GST-π,Topo Ⅱ.However,the expression level of TS did not change significantly in different differentiation degree colon cancer tissues (P>0.05).Positive correlation was found between the expression of AQP-5 and P-gp,GST-π,Topo Ⅱ (P<0.05).Negative correlation was found between the expression of AQP-5 and TS (P>0.05).Conclusion The AQP-5 and resistance gene expression were increased in colon cancer tissues.The AQP-5 expression level was higher in colon cancer compared with adjacent control or normal tissues,which may promote the transfer and progress of colon cancer.
aquaporin 5;colonic neoplasms;resistance gene
石晓明(1969-),副主任医师,主要从事普外科疾病基础与临床研究。△
,E-mail:shixiaoming1999@126.com。
10.3969/j.issn.1671-8348.2015.05.023
R735.3
A
1671-8348(2015)05-0644-03
2014-09-27
2014-11-10)
