伤科洁肤液的相关药理学实验研究
2015-06-01杨维建
杨维建,张 超,李 娟,邓 毅
1甘肃省中医院,甘肃 兰州 730050;2甘肃中医药大学;3甘肃省中药药理与毒理学重点实验室
伤科洁肤液的相关药理学实验研究
杨维建1,张 超2,李 娟2,邓 毅3△
1甘肃省中医院,甘肃 兰州 730050;2甘肃中医药大学;3甘肃省中药药理与毒理学重点实验室
目的:观察伤科洁肤液的急性毒性、安全性、抗炎抑菌作用并探讨其作用机理。方法:采用经典的急性毒性实验方法,研究伤科洁肤液的急性毒性,观察记录小鼠的毒副反应情况。用伤科洁肤液对小鼠进行皮肤刺激实验和皮肤过敏实验,研究伤科洁肤液的的安全性。以二甲苯致小鼠耳肿胀、小鼠耳毛细血管通透性实验及小鼠炎性气囊中N O的含量,观察伤科洁肤液的抗炎作用;以金黄色葡萄球菌和大肠杆菌的抑菌环、最小抑菌浓度(M IC)测定,观察伤科洁肤液的抑菌作用。结果:伤科洁肤液急性毒性实验未做出LD 50,最大给药量(M LD)为1 250倍,说明伤科洁肤液毒性很小,在临床规定使用量下使用安全可靠。伤科洁肤液外用未引起小鼠刺激性反应,也未引起小鼠的局部皮肤过敏反应,属安全制剂。伤科洁肤液各组均能抑制二甲苯引起的小鼠耳肿胀,中、大剂量组作用显著,与空白组比较差异有统计学意义;小、中、大剂量组均能抑制二甲苯所致的鼠耳毛细血管通透性增加;能降低小鼠气囊炎性模型气囊灌洗液中N O的含量,大、中剂量组作用显著,与生理盐组比较差异有统计学意义(P<0.01)。对金黄色葡萄球菌、肺炎球菌、链球菌有一定的抑制作用。结论:伤科洁肤液安全、无毒,具有较强的抗炎作用及一定的抑菌作用。
伤科洁肤液;急性毒性;安全性;抗炎;抑菌;组织损伤
伤科洁肤液为甘肃省中医院院内制剂,由苦参、当归、黄柏等组成,主要用于急、慢性软组织损伤的初期治疗及开放性伤口的外用清洗。曾用于甘肃岷县、舟曲泥石流等突发公共卫生事件的现场救治。本实验通过观察伤科洁肤液在急性毒性、药效安全性及抗炎抑菌的作用并探讨其作用机理,为临床用药提供客观依据。
1 动物、试药与仪器
1.1 实验动物 健康昆明种(SPF)小鼠220只,体质量(20±2)g,雌雄各半,甘肃中医药大学科研实验中心提供,动物合格证号SCXK(甘)2011-0001。
1.2 药品试剂 伤科洁肤液(甘肃省中医院药剂科制备,批号:20120032),8%硫化钠(广东西陇化工厂生产,批号:0410012),100%二甲苯(北京五二九五二化工厂生产,批号:20110828),金黄色葡萄球菌(甘肃中医学院病原微生物教研室提供,菌种号:CMCC54673)、肺炎球菌(甘肃中医药大学病原微生物教研室提供,菌种号:CMCC45270)、链球菌(甘肃中医药大学病原微生物教研室提供,菌种号:CMCC4432)、大肠杆菌(甘肃中医药大学病原微生物教研室提供,菌种号:CMCC44102),角叉菜胶(Sigma公司生产,批号:122k14444),0.9%NS(山东齐都药业有限公司生产,国药准字H37020765),伊文思蓝生理盐水溶液(上海新中化工厂生产,批号:20110402),冰醋酸(广州化学试剂厂生产,批号:201206.12),庆大霉素(广东邦民制药厂有限公司,国药准字H44024781),一氧化氮(NO)测试盒(南京建成生物工程研究所提供,批号:20120918),呋喃西林(甘肃中医药大学附属医院制剂室自制,批号:993867)、10%水合氯醛(国药集团化学试剂有限公司生产,批号:T20110403)。脱毛膏(上海威力药业有限公司生产,批号:201209790)。
1.3 主要仪器 Sartorius分析天平(德国赛多利斯公司北京分处提供),JP-350型电热恒温培养箱(武汉市武昌实验仪器厂提供),SW-CJ-1FD型净化工作台(苏净集团苏州安泰空气技术有限公司提供)。滤纸片(PAPER DISC forAntibiotic examination,SIZE8M/MDIA,TOYOSEISAKUSHOCO,LTD)。
2 方法与结果
参照经典的急性毒性实验方法,进行伤科洁肤液对小鼠的急性毒性实验研究[1]。
2.1 伤科洁肤液对小鼠的急性毒性预实验 取小鼠10只,随机分为伤科洁肤液组和生理盐水对照组,每组5只,小鼠背部脱毛膏脱毛,范围约2cm×2cm,给药组小鼠背部涂药1mL,即2.14g/mL(实验前将250 mL伤科洁肤液浓缩至14 mL,即最大可浓缩浓度为68.2%,故生药含药量为2.14 g/mL),对照组涂等剂量的生理盐水。根据小鼠死亡情况作适当调整,分别找出伤科洁肤液LD100值(100%死亡率)、LD0值(0%死亡率)和相应的剂量组间距r值,进行LD50值的测定[2-4]。预实验结果表明:观察小鼠1天,小鼠无1例死亡,难以测定出LD50值。故进行最大给药量(MLD)的正式实验。
2.2 小鼠急性毒性M LD正式实验 取上述小鼠30只,雌雄各半,体质量18~22 g,按体质量随机分为3组,每组10只,分别为伤科洁肤液组、呋喃西林组、生理盐水组,伤科洁肤液组按最大浓度68.2%,最大给药容量0.5 mL/20 g体质量经皮给药,呋喃西林和生理盐水同剂量,2次/d,连续观察7天,详细记录动物毒性反应情况[5]。实验结束后处死全部动物,解剖,肉眼观察主要脏器组织变化情况,计算小鼠最大给药量倍数。
2.3 小鼠急性毒性正式实验 各组小鼠给药后,每笼10只,正常饲养,每天观察1次,称取体质量,密切观察各组小鼠的动度进食、饮水情况及7天内可能出现的动度、异常肌肉运动、对外反应、瞳孔改变、异常分泌物、大小便异常、眼球凸出、眼睑下垂、呼吸异常、皮肤颜色改变等毒性反应和死亡情况。若有小鼠死亡,则将其解剖,肉眼观察心、肝、脾、肾、胃、小肠等脏器的改变。7天观察期结束后,将每组存活的小鼠处死进行解剖,按照上述方法对主要脏器大体病理变化进行肉眼观察[6-8]。
小鼠最大给药量倍数=每只小鼠最大给药量/小鼠平均体质量(g)×成人平均体质量(g)/成人每日用量。
2.4 小鼠局部皮肤刺激性实验 取小鼠20只,雌雄各半,按体质量随机分为2组,分为完整皮肤组和破损皮肤组,每组10只[9]。给药前24小时用脱毛剂将小鼠背部脊柱两侧区域脱毛,范围约2 cm×2 cm,检查脱毛皮肤是否因脱毛而受伤,受伤皮肤不用于本实验。10%水合氯醛腹腔麻醉小鼠后,破损组小鼠左右两侧脱毛区用细针头刮伤,以渗血为度,左侧破损程度与右侧一致,采用同体自身对比,左侧受损皮肤取1.5 cm2消毒滤纸片滴加1 mL伤科洁肤液敷于左侧背部,无刺激性胶布固定,右侧湿敷生理盐水对照,覆盖同左侧[10]。完整组给药方法同上。每日给药3次,间隔半小时,小鼠分笼饲养,连续给药3天,3天后温水去除残留受试药物,观察7天,肉眼观察并记录动物涂药部位有无红斑和水肿,有无色素沉着、出血点、皮肤粗糙等情况,按表1—2进行评分并判断结果。

表1 皮肤刺激、过敏反应评分标准

表2 皮肤刺激强度评价标准
2.5 伤科洁肤液皮肤过敏实验 取小鼠30只,雌雄各半,按体质量随机分为3组,每组10只,设伤科洁肤液组、呋喃西林组、生理盐水组(对照),给药前24小时用脱毛剂将小鼠背部脊柱两侧区域脱毛,范围约2 cm×2 cm,检查脱毛皮肤是否因脱毛而受伤,受伤皮肤不用于本实验。取伤科洁肤液0.5 mL、呋喃西林0.5 mL、生理盐水0.5 mL涂在各组小鼠脱毛区左侧,消毒薄纱布覆盖,脱敏胶布固定,每只小鼠分笼饲养,使药物持续接触6小时,1次/d,共3次[11]。于末次给药致敏后第7天,在各组小鼠脱毛右侧分别均匀涂抹伤科洁肤液0.5 mL、呋喃西林0.5 mL、生理盐水0.5 mL,给药部位薄纱布覆盖,脱敏胶布固定,6小时后去掉受试物,即刻观察,于24、48、72小时后再次观察皮肤过敏反应情况[12],按表1评分,计算致命率和反应平均值。致敏率:将出现皮肤红斑或水肿(不论体重)的小鼠例数/受试小鼠总数。反应平均值=(红斑形成总分+水肿形成总分)/合计小鼠数,按表3判断过敏评价标准[13-14]。

表3 皮肤致敏性评价标准
2.6 抗炎作用
2.6.1 伤科洁肤液对二甲苯致小鼠耳廓炎症的影响[15]取60只小鼠,雌雄各半,随机分为空白组、基质对照组(生理盐水0.1 g/耳,5 g/kg)、阳性对照药组(呋喃西林0.2 g/耳,12 g/kg)、伤科洁肤液小剂量组(0.12 g/耳,6 g/kg)、伤科洁肤液中剂量组(0.24 g/耳,12 g/kg)、伤科洁肤液大剂量组(0.36g/耳,18 g/kg)。于每只小鼠右耳廓滴100%二甲苯2滴致炎30分钟。除空白组外,其余各组分别于小鼠右耳炎症部位涂抹对应的生理盐水及药物。45分钟后颈椎脱臼处死小鼠,剪下左右耳廓并用蒸馏水冲去右耳廓残留的药物,以直径7 mm角膜环钻切下两耳相应部位耳片,求其两耳重量差值作为炎症肿胀程度指标。用分析天平称重,计算肿胀抑制率
肿胀抑制率=(对照组耳片差值-给药组耳片差值)/对照组耳片差值×100%。
2.6.2 小鼠耳毛细血管通透性实验 取小鼠50只,雌雄各半,随机分为5组,直肠给药,伤科洁肤液给药剂量,大、中、小剂量组分别为0.12g(1mL)/只、0.36 g(3 mL)/只、0.72(6 mL)g/只,空白组和模型组不给予任何处理,连续给药6天。于末次给药后1小时小鼠尾静脉推0.5%伊文思蓝生理盐水溶液0.1 mL/只,10分钟后腹腔注射0.6%冰醋酸生理盐水注射液0.1mL/只,20分钟后脱颈椎处死小鼠,蒸馏水5 mL充分洗涤腹腔,并轻揉腹部3分钟,然后从腹腔内收集冲洗液3 mL左右(若冲洗液如被血液污染,则弃去不用,1 000 r/min离心5分钟,用754分光光度计于590 nm波长处比色,测定光密度(OD)值[16]。
2.6.3 对小鼠气囊炎性模型气囊灌洗液中N O含量的影响[17]取60只小鼠,雌雄各半,分组同上。经皮给药,各组于给药前24小时用8%硫化钠溶液于小鼠背部脊柱两侧脱毛,面积为2 cm2,3天后重复脱毛1次,并于2次脱毛部位后局部给药,1次/d,连续7天。第1天给药前先于小鼠背部肩胛区皮下无菌注入空气5 mL形成气囊,第4天补充注射空气3 mL维持气囊膨胀。末次给药1小时后在气囊内注入0.25%角叉菜胶1 mL,遂即将鼠背向下,缓慢转动,致炎6小时后以生理盐水4 mL灌洗气囊,收集灌洗液并定量其体积,4 000 r/min离心15分钟,取上清液0.16 mL,按照NO试剂盒检测方法测定NO含量。
2.7 伤科洁肤液抑菌作用的观察
2.7.1 对金黄色葡萄球菌、大肠杆菌的抑菌作用[18]选用金黄色葡萄球菌、大肠杆菌、肺炎球菌、链球菌作为受试菌,对照组选用庆大霉素和生理盐水。金黄色葡萄球菌、大肠杆菌、肺炎球菌、链球菌每组3×6=18只培养皿,实验前在培养皿中接种好细菌。用黑色碳素笔在每个培养皿底部画出“人”字形区域,以区分伤科洁肤液、庆大霉素、生理盐水的不同区域。将伤科洁肤液的浓度稀释成6种不同倍数,即原液、100倍、101倍、102倍、103倍、104倍。庆大霉素稀释至原液的106倍。同理,大肠杆菌组分组及浓度同前,共计72只培养皿。在每个接种好细菌的培养皿中小心加入浸泡过不同浓度伤科洁肤液的滤纸片(滤纸片直径约2 mm),同样将浸泡过生理盐水和庆大霉素的滤纸片小心加入培养皿中的区域,以作为对照。然后将培养皿置35℃孵育箱24小时,测量抑菌环直径。
2.7.2 最小抑菌浓度(M IC)测定 采用2倍稀释法,将伤科洁肤液用灭菌蒸馏水倍比稀释成浓度为 500、250、125、62.5、31.3、15.7、7.9、3.95 g/L的不同提取液,每个浓度设5个平行管,分别和等量的双倍浓度的营养肉汤相混合,并分别设不含伤科洁肤液的肉汤培养基为对照管。然后将实验菌液(金黄色葡萄球菌、大肠埃希菌、肺炎球菌、链球菌,菌液浓度用比浊管比浊,并调整密度为105~106 CFU/mL,分别接种各试管中,置37℃培养箱培养24小时,观察有无细菌生长,肉汤清亮透明表示无细菌生长(-),肉汤浑浊表示有细菌生长(+),以能抑制细菌生长的提取物最高稀释度作为其最低抑菌浓度(MIC)。
2.8 统计学方法 所有结果采用SPSS 17.0软件进行分析,其中急性毒性实验、安全性实验数据以(±s)表示,组间比较采用t检验;抗炎抑菌实验数据以(±s)表示,组间采用单因素方差比较,检验水准为α=0.05。
3 结果
3.1 伤科洁肤液对小鼠急性毒性M LD值测定 小鼠急性毒性MLD值测定按25 mL/kg小鼠体质量经皮给药2次,呋喃西林和对照组给予同体积,伤科洁肤液组小鼠给药剂量,计算MLD为90.0g/(kg·d)。相当于临床每kg体质量日用剂量的1 250.0倍。结果给药后观察,小鼠的一般行为、精神反应、体毛肤色、呼吸步态、摄食饮水、排泄物及其他情况均无异常,未见明显毒性反应及死亡情况(见表4—6)。

表4 伤科洁肤液急性毒性实验小鼠死亡情况
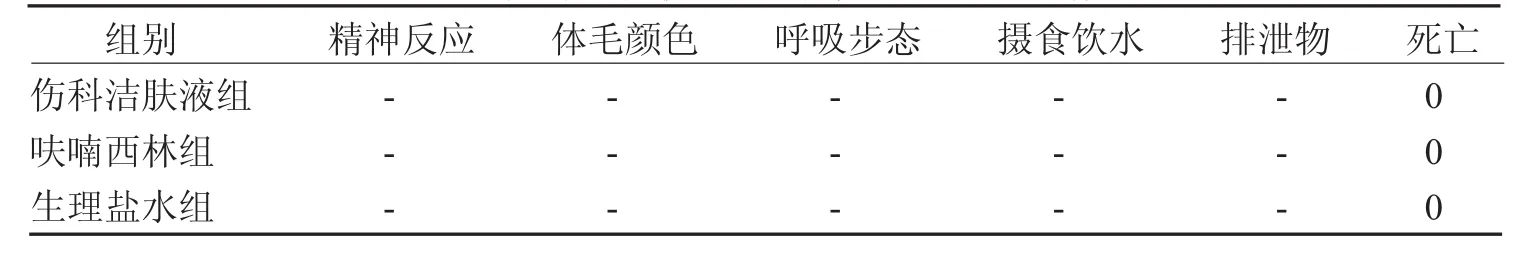
表5 伤科洁肤液急性毒性实验小鼠反应情况
表6 伤科洁肤液液急性毒性实验小鼠的体质量变化(±s)

表6 伤科洁肤液液急性毒性实验小鼠的体质量变化(±s)
注:与生理盐水组比较,*表示P<0.05,**表示P<0.01,***表示P<0.001。
组别 例数 给药前 给药后1天 给药后2天 给药后3天 给药后4天 给药后5天 给药后6天 给药后7天伤科洁肤液组 30 21.38±1.94 21.45±1.04***21.71±1.64***21.98±1.19 22.21±1.73*22.59±1.61*22.81±1.76 23.19±1.99呋喃西林组 30 21.11±1.69 21.23±1.18***21.62±1.21***21.88±1.18 22.19±1.76 22.35±1.41 22.75±2.62 22.91±2.60生理盐水组 30 21.35±1.88 21.43±1.24 21.67±1.04 21.87±1.73 22.17±1.61 22.32±1.43 22.67±1.62 22.89±1.74
3.2 对小鼠局部皮肤刺激性实验 各组小鼠给药24小时后,给药局部未出现红斑和水肿。连续给药7天,给药期间各组小鼠给药区域未出现明显红斑和水肿,未见其他异常改变。见表7。
3.3 伤科洁肤液皮肤过敏实验 伤科洁肤液组、呋喃西林组及生理盐水组在涂药24、48、72小时后涂药部位均未出现红斑和水肿,见表8。伤科洁肤液0.5 mL外用时,观察7天小鼠皮肤未出现过敏反应,24、48、72小时观察也未发现对小鼠皮肤有明显过敏反应,因此伤科洁肤液对小鼠完整皮肤无过敏性反应,见表9。
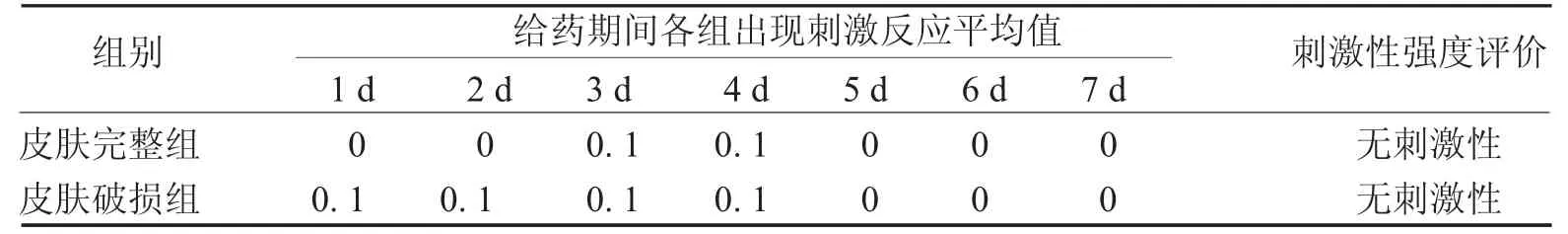
表7 伤科洁肤液对小鼠局部皮肤刺激性实验
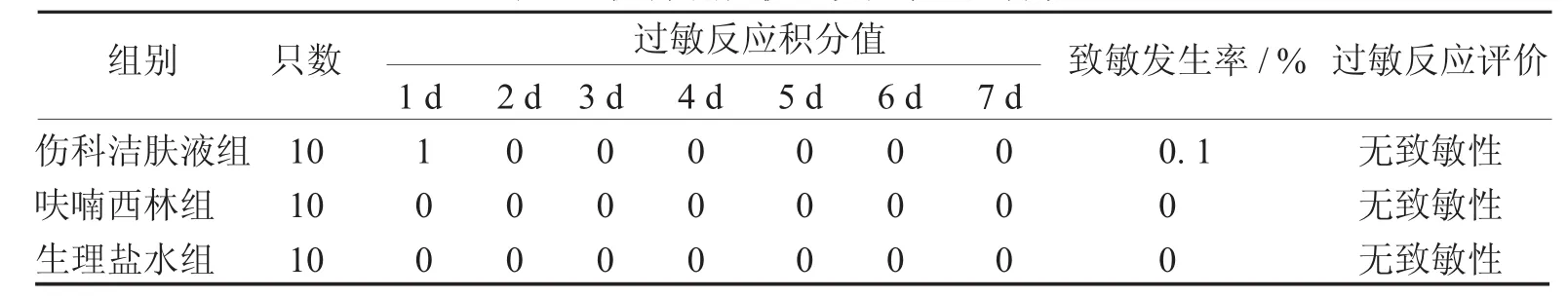
表8 伤科洁肤液连续观察7天分值
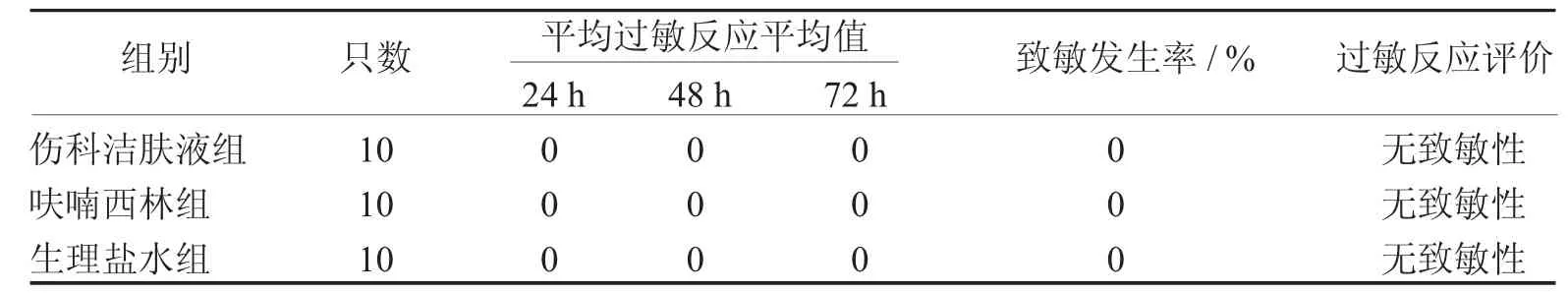
表9 伤科洁肤液皮肤过敏实验结果
3.4 二甲苯致小鼠耳肿胀的影响 与空白组比较,伤科洁肤液各组均能抑制二甲苯引起的小鼠耳肿胀,根据单因素方差分析,小剂量伤科洁肤液组与空白组、生理盐水组比较差异有统计学意义(P<0.05),而伤科洁肤液中、大剂量组与空白组、生理盐水组相比差异有统计学意义(P<0.05)。但小、中、大剂量伤科洁肤液组与呋喃西林组比较差异无统计学意义(P>0.05)。见表10。
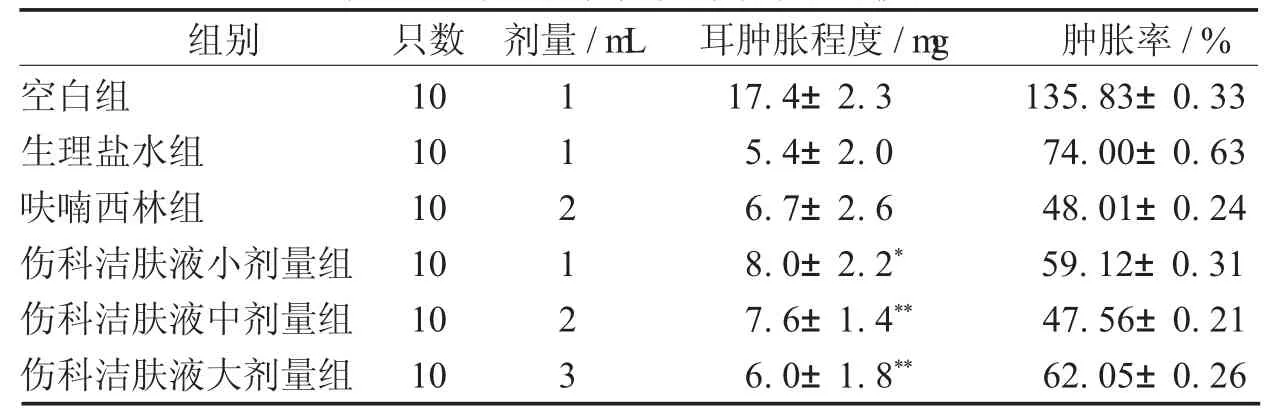
表10 对二甲苯致小鼠耳肿胀的影响
3.5 小鼠耳毛细血管通透性实验 伤科洁肤液小、中、大剂量组及呋喃西林均能显著抑制二甲苯所致的鼠耳毛细血管通透性增加(P<0.05)。见表11。
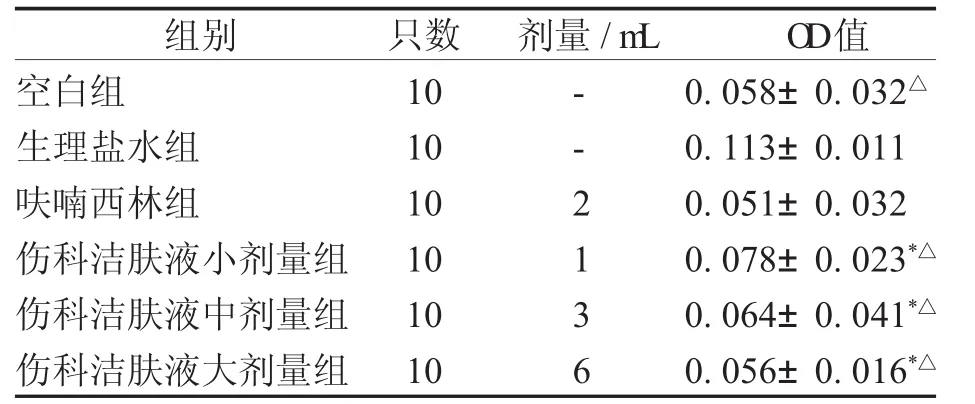
表11 伤科洁肤液对小鼠耳毛细血管通透性影响
3.6 对小鼠气囊炎性模型气囊灌洗液中N O含量的影响 伤科洁肤液能降低小鼠气囊炎性模型气囊灌洗液中NO的含量,大、中剂量组作用显著,与生理盐组比较差异有统计学意义(P<0.01)。小剂量组作用较弱(P<0.05)。见表12。
3.7 金黄色葡萄球菌、大肠杆菌的抑菌作用 经测量,伤科洁肤液原液对金黄色葡萄球菌的抑菌环为13 mm,对肺炎链球菌抑菌环为11 mm,对链球菌抑菌环为11 mm,其他浓度伤科洁肤液未见抑菌环;伤科洁肤液原液对大肠杆菌未见抑菌环;庆大霉素对4种细菌均有抑菌环。打孔法抑菌作用判断标准:观测抑菌圈的有无及直径大小判断敏感度及药物效果,以抑菌圈<6 mm为不敏感,6~7 mm为低敏感,7~15 mm为中敏,大于15 mm为高敏,无抑菌环为无效[19],说明伤科洁肤液对金葡菌、球菌有明显抑菌能力,见表13。
3.8 伤科洁肤液最低抑菌浓度实验 伤科洁肤液对金黄色葡萄球菌、肺炎球菌、链球菌、均有抑菌作用,其MIC分别为125,15.7,62.5 mg/kg,而对大肠杆菌无明显抑菌作用,与抑菌圈实验一致,见表14。
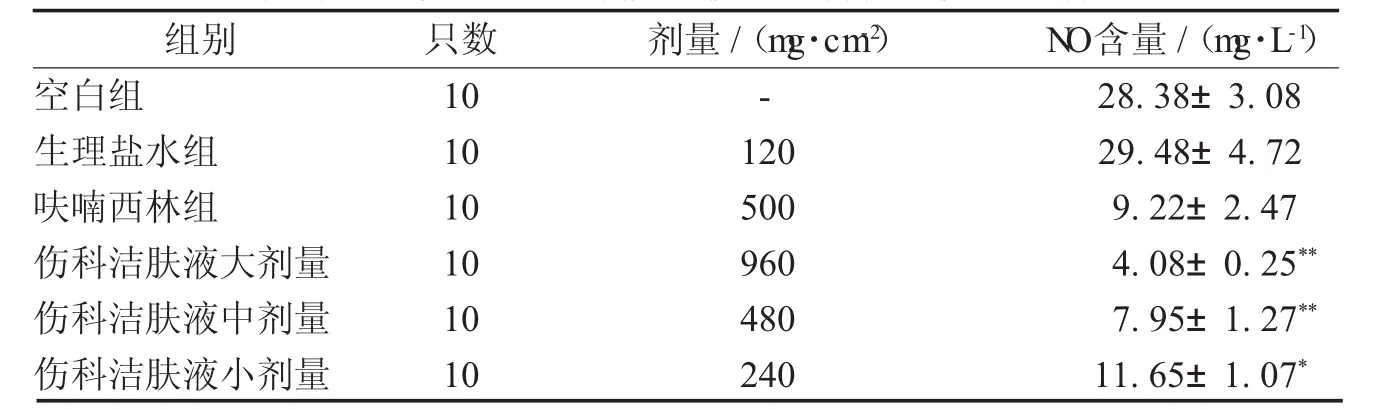
表12 伤科洁肤液对小鼠气囊炎性模型气囊灌洗液中N O含量的影响
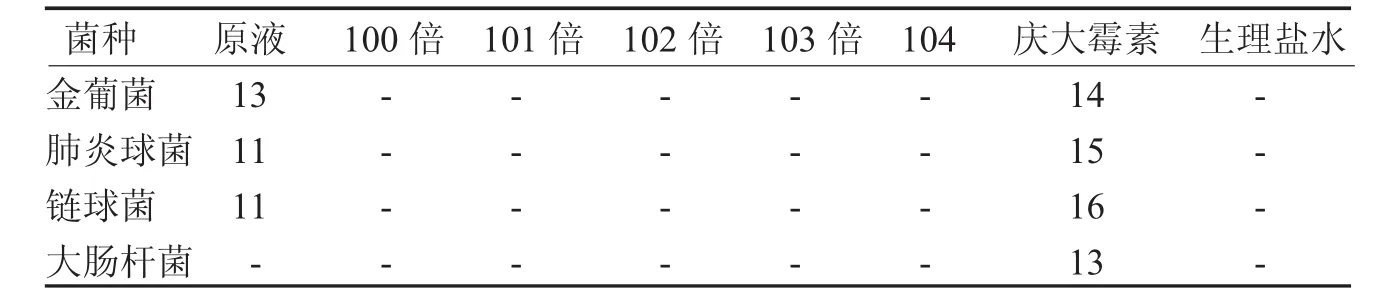
表13 对金黄色葡萄球菌、大肠杆菌的抑菌圈直径的影响 m m
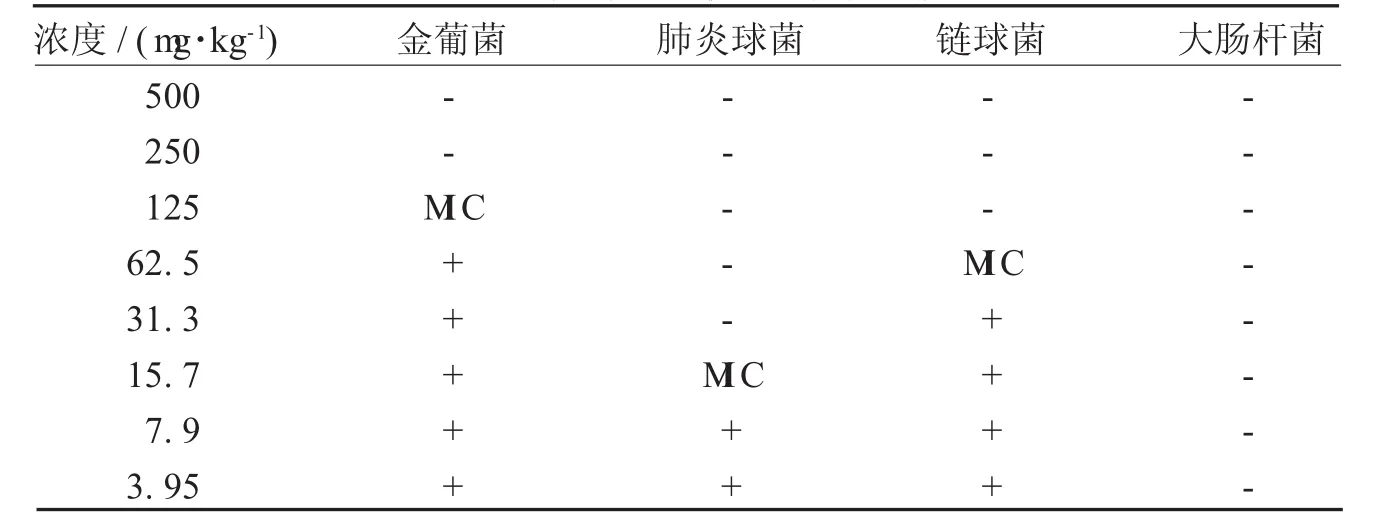
表14 伤科洁肤液最低抑菌浓度
4 讨论
中药外用洗剂用于治疗急性软组织损伤,可发挥中医药传统优势,疗效佳,便捷,安全,副作用少,避免抗生素大量应用所带来的弊端。将中药外用洗剂用于软组织损伤的初期治疗,突出中医药对软组织损伤治疗的便捷和洁肤生新的独特优势。中医药广泛应用于急性损伤中,已经引起国内外不少医学专家的重视。
伤科洁肤液是中医理论指导下研制的中成药,具有清热解毒、洁肤生新、祛瘀消肿的功效,用于治疗初期急性软组织损伤。本研究对伤科洁肤液小鼠急性毒性进行了观察和评价,实验观察发现,小鼠给药后在摄食、饮水、粪便、尿液及精神、四肢活动和体质量方面,给药组与对照组相比,没有差异,均表现为精神状态良好、活动灵活积极、正常饮食,无一死亡。据此,伤科洁肤液急性毒性很小,可供临床应用及实验研究,但其抗炎抑菌的药效学试验还有待进一步研究。
实验按照谢秀琼等[20]方法进行动物安全性实验。结果表明,药物浓度为10.7%的伤科洁肤液外用,在完整和破损皮肤的小鼠身上未引起皮肤过敏反应和刺激性反应,因而是该制剂临床使用安全高效的有力佐证,但这还远远不够,我们将更深入全面的研究下去,尽可能从药效学方面说明其作用机制。
伤科洁肤液由苦参、当归、黄柏等组成。方中苦参具有清热燥湿、杀虫、利尿的作用,对结核杆菌、痢疾杆菌、金黄色葡萄球菌、多种皮肤真菌均有抑制作用;研究表明苦参中生物碱类化合物具有明显的免疫抑制、抑菌抗炎的作用[21-22]。当归具有活血散瘀、消肿、养血生肌之功效;其主要成分正丁烯内酯及苯内酯可对抗组织胺-乙酰胆碱引起的炎症反应[23-24]。黄柏具有清热、泻火解毒、止血、疗疮之功效;其有效成分小檗碱对金黄色葡萄球菌、表皮球菌、化脓性链球菌等阳性球菌有较强的抑菌效果,对隐球菌和红色发癣菌具有较强的抑菌作用[25];水煎液对巴豆油所致小鼠耳廓肿胀及醋酸致小鼠腹腔毛细血管通透性有明显的抗炎作用,其作用机理可能与对细菌呼吸及RNA合成的强烈抑制有关[26-27]。因此,该制剂通过清热燥湿、解毒、消肿、补血生肌之作用,消除局部瘀肿、减少炎性渗液、降低或抑制NO的生成,并抑制多种细菌而达到抗炎抑菌作用的。本实验表明,伤科洁肤液是一种安全,无毒的外用洗剂具有较强的抗炎抑菌作用,可广泛推广用于临床及实验。
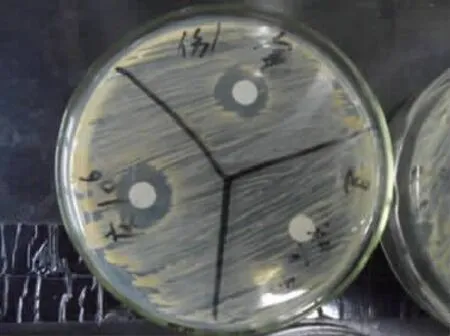
附图1 伤科洁肤液与庆大霉素对金黄色葡萄球菌的抑菌环比较
[1] 徐叔云.药理实验方法学[M].北京:人民卫生出版社,1992:201-206.
[2] 刘绍莉.养血生发胶囊致药物性肝炎1例[J].中国医院药学杂志,2006,26(12):1584-1585.
[3] 霍敏英,凌世华.首乌片、养血生发胶囊同服引起肝炎[J].药物不良反应杂志,2004,6(5):335.
[4] 杜俊蓉,白波,余彦.当归挥发油的毒性研究[J].中国中药杂志,2005,30(18):1400-1405.
[5] 金智生,何建成,贾育新,等.复方川芎滴鼻液毒性实验研究[J].甘肃中医学院学报,1999,16(1):13-14.
[6] 谢元璋,孙蓉.养血生发胶囊对小鼠急性毒性实验研究[J].中国药物警戒,2011,8(4):122-124.
[7] 黄多术,胡波,张玉菁.过量服食菟丝子致中毒反应1例[J].中华中医药杂,2005,20(5):301-302.
[8] 韩珍,贺弋.白芍总苷的药理作用及其毒性研究进展[J].宁夏医学院学报,2008,30(4):538-541.
[9] 赵惠民.软组织损伤及药理学治疗的现代概念[J].颈腰痛杂志,1996,17(4):254-256.
[10]国家药典委员会.中华人民共和国药典[M].2010版.北京:化学工业出版社,2005:946.
[11]李仪奎.中药药理实验方法学[M].上海:上海科学技术出版社,1991:528-540.
[12]李兴志.骨痛灵软膏安全性实验研究[J].吉林医学,2008,29(20):1803-1804.
[13]刘卫,邓淑凤.柳叶洗眼液对豚鼠皮肤过敏性实验研究[J].医学动物防制,2011,27(5):445-446.
[14]王海东,赵俊喜.嘛呢止痛搽剂的安全性研究[J],甘肃中医,2006,19(7):45-46.
[15]王锋,李文娜.蒙药消肿散涂膜剂皮肤刺激和皮肤过敏实验研究[J].遵义医学院学报,2008,31(3):243-244.
[16]郑桃晓,周贤刚.益气温阳膏治疗面瘫的安全性实验研究[J].山东中医杂志,2010,29(12):849-851.
[17]杨宜华,陈玉祥.注射用黄芪冻干粉的安全性试验和急性毒性试验[J].徐州医学院学报,2007,27(2):88-89.
[18]宋立人,洪洵,丁绪亮,等.现代中药学大辞典[M].北京:人民卫生出版社,2001:2308-2309.
[19]陈奇.中药药理研究方法学[M].2版.北京:人民卫生出版社,2006:109.
[20]谢秀琼.中药新制剂开发与应用[M].3版.北京:人民卫生出版社,2000:540.
[21]薛爱华,宋文静.苦参碱药理作用研究概况[J].天津药学,2010,22(5):62-63.
[22]孙宏博,于婧.苦参药理作用研究进展[J].黑龙江医药,2009,22(1):83-84.
[23]玄阳.当归的药理作用研究进展分析[J].医学信息,2011,25(5):1938-1939.
[24]高尚进,毛艳,周汉东,等.11种中草药对8种常见细菌的体外抑菌试验[J].川北医学院学报,2009,29(5):466-468.
[25]胡俊青,胡晓.黄柏化学成分和药理作用的现代研究[J].当代医学,2009,15(7):139-140.
[26]周娟,张梦军,郭嘉伟,等.小鼠耳肿胀模型及药理应用[J].国际检验医学杂志,2012,33(17):2102-2104.
[27]杨巧芳,孟庆刚.炎症动物模型探要[J].中华中医药学刊,2008,33(3):516-517.
Research on Pharmacological Experiments of ShangKe JieFuYe
YANG Weijian1,ZHANG Chao2,LI Juan2,DENG Yi3△
1 Gansu Provincial Hospital of Traditional Chinese Medicine,Lanzhou 730050,China;
2 Gansu University of Traditional Chinese Medicine;
3 KeyLaboratoryofPharmacologyandToxicologyforTraditionalChineseMedicinesofGansuProvince(nurturingstation)
Objective:To observe acute toxicity,the safety,anti-inflammatory effects and antibacterial activity of ShangKe JieFuYe,and to explore its mechanism.Methods:Acute toxicity of ShangKe JieFuYe to the mice was performed by adopting classical acute toxicity test,to observe and record toxic reactions of the mice.Dermal irritability test and allergic reaction of ShangKe JieFuYe were conducted in mice to study the safety of ShangKe JieFuYe in mice.Anti-inflammatory effects of ShangKe JieFuYe were observed by using dimethylbenzene-induced ear swelling of the mice,ear capillary permeability experiments of the mice and the contents of NO in inflammatory cells of the mice;antibacterial activity of ShangKe JieFuYe was observed by detecting the inhibition ring test of Staphylococcus aureus(SA)and Escherichia coli(E.coli),as well as minimal inhibitory concentration(MIC).Results:There was no result of LD50 in acute toxicity test of ShangKe JieFuYe,minimum lethal doses(MLD)were 1250 times,which demonstrated that the toxicity of ShangKe JieFuYe was low,and it's safe and reliable in clinical application under the specified usage.External application of ShangKe JieFuYe wouldn't cause irritability reaction and local allergic reaction of the mice,and it's of safe preparations.ShangKe JieFuYe could inhibit dimethylbenzene-induced ear swelling of the mice,especially moderate and high doses groups of ShangKe JieFuYe,the difference was significant compared with the blank group;different doses groups of ShangKe JieFuYe could inhibit mice ear capillary permeability increasing;it could decrease the contents of NO in irrigating solution of mice with inflammatory cells,especially moderate and high doses groups of ShangKe JieFuYe,the difference was notable compared with physiological saline group(P<0.01).It could inhibit SA,pneumococcus and streptococcus to a certain degree. Conclusion:ShangKe JieFuYe is safe and nontoxic;it shows stronger anti-inflammatory effects and antibacterial activity definitely.
ShangKe JieFuYe;acute toxicity;safety;anti-inflammation;antibacterial;tissue damage
R285.5
A
1004-6852(2015)10-0025-07
2014-12-27
杨维建(1964—),男,硕士研究生导师,主任医师。研究方向:胃肠道疾病的中西医结合治疗。
△通讯作者:邓毅(1964—),男,博士研究生导师,教授。研究方向:中药及复方临床应用基础研究。
