淋巴瘤患者脾脏18F-FDG PET/CT影像征象分析*
2015-06-01邱琳陈跃黄占文朱艳张莉丁浩源
邱琳,陈跃,黄占文,朱艳,张莉,丁浩源
淋巴瘤患者脾脏18F-FDG PET/CT影像征象分析*
邱琳,陈跃,黄占文,朱艳,张莉,丁浩源
(四川医科大学附属第一医院核医学科,四川泸州,646000)
目的:探讨18F-FDG PET/CT在淋巴瘤患者脾脏影像中的诊断价值。方法:回顾性分析纳入研究的136例淋巴瘤患者的18F-FDG PET/CT图像,按照有无脾脏浸润分为脾阳性组和脾阴性组,比较两组脾脏体积、SUVmax及伴脾以外结外浸润百分比。脾阳性组进一步按临床分期及脾脏病灶PET/CT影像特征分为Ⅰ-Ⅳ期及A-D组4组分类分析。结果:136例淋巴瘤患者中,脾阳性组52例,脾阴性组84例,脾脏最大层面平均分别为5.08±1.10和3.73±0.64个肋单位(t=9.053,P<0.001),脾脏上下径分别为(15.51±4.48)cm和(10.54±2.36)cm(t=8.458,P<0.001),SUVmax分别为7.35±5.97和2.37± 0.57(t=7.607,P<0.001),分别有82.7%和47.6%的患者伴有脾以外的结外病变(χ2=16.611,P<0.005)。脾阳性组根据临床分期分为Ⅰ-Ⅳ期4个期,脾脏病灶SUVmax分别为2.67±1.63、3.33±2.46、10.52±7.42及6.43±4.27。根据脾脏病变18F-FDG PET/CT影像特征分为A-D组4个组。D组脾脏结节/团块状糖代谢活性增高组SUVmax(12.02±6.24)较其他各组(A组2.00 ±0.30、B组5.9±4.58、C组7.26±4.32)SUVmax高,差异具有统计学意义(q=2.46~5.32,P<0.05)。结论:脾阳性组脾脏平均体积、SUVmax及伴脾以外的结外病变百分比高于脾阴性组。淋巴瘤脾脏浸润主要表现有脾大、脾脏弥漫代谢活性增高、脾大伴弥漫性代谢活性增高及脾脏结节/团块状糖代谢活性增高,其中脾脏结节/团块状糖代谢活性增高表现较为复杂且代谢活性明显高于其他各组。
淋巴瘤;脾脏浸润;最大标准化摄取值
淋巴瘤是淋巴造血系统最常见的恶性肿瘤之一,可分为霍奇金淋巴瘤(Hodgkin’s lymphoma,HL)和非霍奇金淋巴瘤(non-Hodgkin’s lymphoma,NHL)两大类。淋巴瘤常累及多种结外器官、组织,如肺、胃肠道、骨骼、肝脏及脾脏等。脾脏浸润是淋巴瘤患者常见的结外病变之一,HL和NHL脾脏浸润的发生率分别约为30%~40%及10%~40%[1]。超声、CT及MRI诊断脾脏病变的敏感性及特异性较低,存在一定的假阳性、假阴性。超声引导下脾穿刺活检是诊断淋巴瘤脾脏浸润的“金标准”,但此方法手术程序复杂且并发症发生率高,不适宜临床推广使用[1]。18FFDG PET/CT作为一项全身影像学检查方法,集葡萄糖代谢及解剖定位于一体,可以准确、全面地反映淋巴结及累及结外器官(包括脾脏)的情况。本研究就淋巴瘤脾脏浸润的18F-FDG PET/CT影像学表现进行探讨。
1 资料与方法
1.1 一般资料
收集2010年6月至2013年10月在我科行18F-FDG PET/CT检查诊断为淋巴瘤的患者。淋巴瘤患者入选标准:①病理学证实为淋巴瘤;②显像前患者未经任何治疗。淋巴瘤脾脏浸润患者入选标准:①病理学证实为淋巴瘤,脾脏术后标本、穿刺活检或化疗后影像学改变证实有淋巴瘤脾脏浸润;②CT以脾脏最大层面大于5个肋单元或脾脏上下径大于17 cm作为判断脾大的标准;③PET以脾脏局部或整体SUVmax与正常肝脏SUVmax的比值大于1作为18F-FDG摄取阳性。136例淋巴瘤患者入选,淋巴瘤伴脾脏浸润者(脾阳性组)52例,其中HL 5例,NHL 47例;不伴有脾脏浸润者(脾阴性组)84例。
1.218F-FDG PET/CT显像方法
18F-FDG由Siemens公司的回旋加速器及自动合成系统生产,合成效率>60%,放化纯>95%。检查前患者空腹4 h以上,血糖水平在正常范围,按照0.15~0.20 mCi/kg静脉注射18F-FDG显像剂,注药后平卧平静避光休息40~60 min,排尿后进行数据采集。采用Philips GEMINI TF PET/CT仪,先行CT定位扫描(电压120 kV,层厚0.5 mm);PET采集6~7个床位,每个床位采集3 min,层厚5 mm,利用CT数据对PET图像进行衰减校正,并进行图像重建和融合。
1.318F-FDG PET/CT图像分析
由两位分别具有10年以上放射诊断工作经验和核医学工作经验的高级职称医师共同阅片。脾阳性组按脾脏病灶PET/CT影像特征分为4组,分别为A组(单纯脾脏增大而无糖代谢活性异常)、B组(单纯脾脏弥漫性糖代谢活性增高)、C组(脾脏增大伴弥漫性糖代谢活性增高)、D组(脾脏结节/团块状糖代谢活性增高)。
1.4 统计学分析
采用Microsoft Excel和SPSS 13.0软件分析,计量资料以x±s表示,多组间均数比较采用单因素方差分析,两两比较采用q检验,脾阳性组和脾阴性组伴脾以外结外病变百分比的比较采用χ2检验,P<0.05为差异有统计学意义。
2 结果
2.1 脾阳性组和脾阴性组间的比较
136例淋巴瘤患者中,脾阳性组52例(38.2%),男35例,女17例,年龄15~93岁,平均年龄(54.23± 17.86)岁;脾阴性组84例(61.2%),男54例,女30例,年龄18~87岁,平均年龄(50.36±14.46)岁。脾阳性组和脾阴性组CT轴位上脾脏最大层面肋单位数、脾脏上下径、SUVmax、伴有脾以外的结外病变百分比结果见表1。两组间差异具有统计学意义(P<0.05)。

表1 脾阳性组和脾阴性组脾脏各参数比较
2.2 脾阳性组按分期分类各组间的比较
按常用Cotswold改良的Ann Arbor分期系统对脾阳性组淋巴瘤患者进行临床分期,52例脾阳性组Ⅰ期、Ⅱ期、Ⅲ期及Ⅳ期例数分别为3例(5.8%)、6例(11.6%)、19例(36.5%)及24例(46.2%),脾阳性组主要以Ⅲ-Ⅳ期多见;各期平均SUVmax分别为:Ⅰ期为2.67±1.63、Ⅱ期为3.33±2.46、Ⅲ期为10.52±7.42及Ⅳ期为6.43±4.27,Ⅲ-Ⅳ期淋巴瘤脾脏病变平均糖代谢活性倾向于高于Ⅰ-Ⅱ期。
2.3 脾阳性组按18F-FDG PET/CT影像特征分类各组脾脏影像学特征
52例脾阳性组中A组(图1)11例(21.2%),PET影像上脾脏糖代谢未见增高,SUVmax低于相应肝脏,该组11例患者平均SUVmax为2.00±0.30。CT影像上脾脏体积增大,该组11例患者轴位脾脏最大层面平均为5.36±0.92个肋单位,上下径为(15.55±4.07)cm。
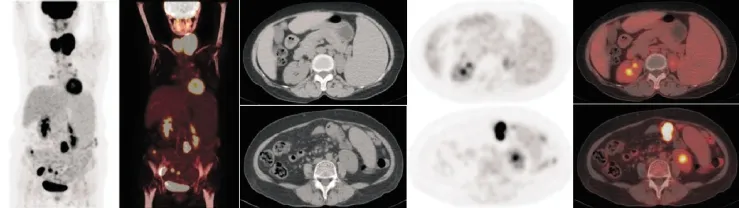
图1 单纯脾脏增大而无糖代谢活性异常典型18F-FDG PET/CT脾脏表现一例
B组(单纯脾脏弥漫性糖代谢活性增高组,见图2)7例(13.5%),PET影像上脾脏可见弥漫性糖代谢增高,SUVmax高于相应肝脏,该组7例患者平均SUVmax为5.9±4.58。CT影像上脾脏体积未见增大,该组7例患者轴位上脾脏最大层面平均为4.29 ±0.95个肋单位,脾脏上下径为(10.97±2.53)cm。

图2 单纯脾脏弥漫性糖代谢活性增高典型18F-FDG PET/CT脾脏表现一例
C组(脾脏增大伴弥漫性糖代谢活性增高典型组,见图3)16例(30.8%),PET影像上脾脏弥漫性糖代谢增高,SUVmax高于相应肝脏,该组16例患者平均SUVmax为7.26±4.32。CT影像上脾脏体积增大,该组16例患者轴位上脾脏最大层面平均为5.19 ±1.04个肋单位,脾脏上下径为(19.13±3.14)cm。
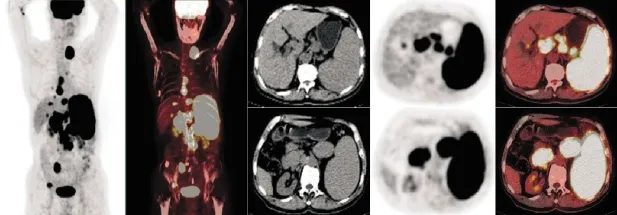
图3 脾脏增大伴弥漫性糖代谢活性增高典型18F-FDG PET/CT脾脏表现一例
D组(团块状糖代谢活性增高典型组,见图4)18例(34.6%),其中单结节状糖代谢增高2例,18例患者中有4例脾脏同机CT可见多发结节或团块状低密度影,有7例伴有脾脏增大,1例伴弥漫性糖代谢增高,3例伴弥漫性糖代谢增高及脾脏增大,5例伴结节或团块融合(图5)。18例患者脾脏病灶平均SUVmax为12.02±6.24,轴位上脾脏最大层面平均为4.92±0.89个肋单位,上下径为(14.13±3.64)cm。

图4 脾脏结节/团块状糖代谢活性增高典型18F-FDG PET/CT脾脏表现一例

图5 脾脏结节/团块状糖代谢活性增高伴结节或团块融合典型18F-FDG PET/CT脾脏表现一例
2.4 脾阳性组各组间影像特征比较
4类分组各组脾最大层面肋单位数、脾上下径及SUVmax见表2,可见A、C、D组脾脏体积倾向于大于B组;D组脾脏结节/团块状糖代谢活性增高组SUVmax(12.02±6.24)与其他各组SUVmax(A组2.00±0.30、B组5.9±4.58、C组7.26±4.32)比较的q值分别为5.32、2.46及2.57,P值均小于0.05。52例脾阳性患者中,仅通过CT标准判断淋巴瘤脾脏浸润37例,其中单纯脾脏增大33例,多发结节或团块状低密度影1例,脾脏增大伴多发结节或团块状低密度影3例,根据CT标准判断淋巴瘤脾脏浸润敏感性为71.2%(37/52)。
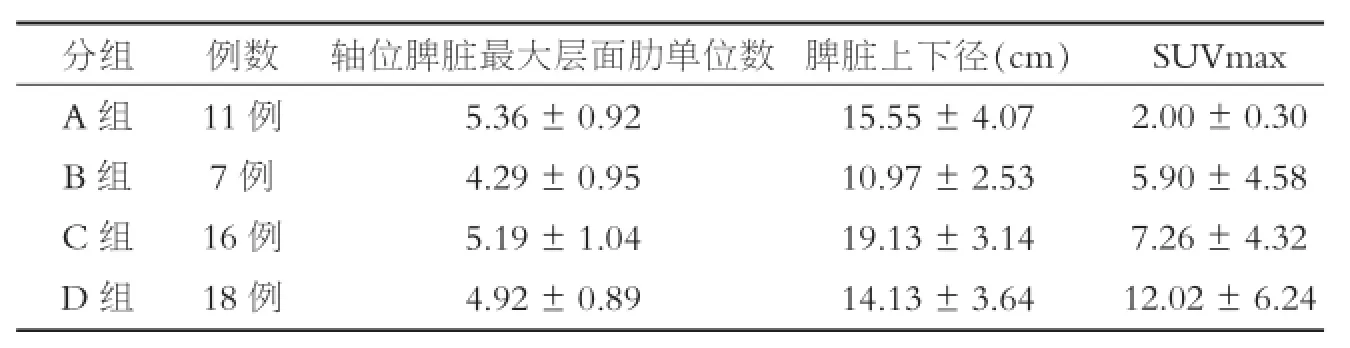
表2 脾阳性组按脾脏病变18F-FDG PET/CT影像特征分组各组间的比较
3 讨论
CT评价淋巴瘤脾脏浸润标准为脾大或脾内低密度结节/团块影,前者假阳性及假阴性率均较高,后者特异性高,但敏感性低[2]。报道的敏感性及特异性范围较宽泛,分别为33%~94%及0%~100%[3],本研究通过CT标准诊断淋巴瘤脾脏浸润37例,敏感性为71.2%。18F-FDG PET评估淋巴瘤脾脏浸润的一致性高于CT,报道的敏感性及特异性分别为80% ~100%及100%[2,4]。18F-FDG PET评价淋巴瘤脾脏浸润的标准为脾脏糖代谢弥漫性或(和)局限性增高,而没考虑脾脏形体学的改变。Pim A[1]报道CT、PET及PET/CT初次评价淋巴瘤脾脏浸润的敏感性分别为91%、75%及100%。因此,依靠能同时反映形态和代谢的18F-FDG PET/CT诊断淋巴瘤脾脏浸润信息更全面,敏感性及特异性更高。
Rini[2]的研究表明,淋巴瘤脾脏浸润患者脾/肝SUVmax比值为1.4~5.2,而脾脏未浸润患者其比值为0.8,脾脏浸润患者脾脏糖代谢明显高于未浸润脾脏。本研究中,脾阳性组和脾阴性组SUVmax分别为7.35±5.97和2.37±0.57,结果与Rini等的研究结果一致。另外,我们发现脾阳性组平均脾脏体积也大于脾阴性组。脾阳性组患者伴脾以外结外病变百分比(82.7%)亦明显高于脾阴性组(47.6%)。
脾阳性组按分期分类,Ⅰ~Ⅱ期9例(17.3%),Ⅲ~Ⅳ期43例(82.7%),可见脾阳性组分期往往以高级别分期(Ⅲ~Ⅳ期)为主,低级别分期(Ⅰ~Ⅱ期)少见。脾阳性组按分期分类,Ⅰ~Ⅳ期SUVmax分别为2.67±1.63、3.33±2.46、10.52±7.42及6.43±4.27。高级别分期脾脏病变平均糖代谢活性倾向于高于低级别分期者。本研究中,我们发现Ⅳ期脾脏病灶SUVmax低于Ⅲ期SUVmax,分期越高,脾脏浸润病灶活性应该越高,但影响淋巴瘤脾脏浸润病灶代谢活性的因素很多,除淋巴瘤分级分期情况外,淋巴瘤病理组织学特征、活性淋巴瘤细胞比例、瘤细胞增殖能力、肿瘤中心缺血坏死、局部血流灌注情况、有无缺氧都会影响代谢活性[4]。
脾阳性组按脾脏病变18F-FDG PET/CT影像特征分为4组。除淋巴瘤脾脏浸润外,临床上最常见的单纯脾脏增大的原因为肝硬化所致脾大,后者常为肝硬化、脾大、门静脉高压三联征,容易与淋巴瘤脾脏浸润A组PET/CT表现鉴别。很多累积脾脏的疾病或作用于脾脏的药物均可表现为弥漫性糖代谢活性增高,这些脾脏疾病均需与B组表现相鉴别,部分需与C组表现相鉴别。HIV感染所致脾脏弥漫性糖代谢活性增高主要发生于感染早期,Iyengar[5]及Brust[6]进行过相关报道。三分之一的结节病患者脾脏表现为脾大伴弥漫性糖代谢增高[7],疟疾脾脏浸润除代谢增高外也常伴有脾大[8],此时需与C组表现相鉴别。许多感染性疾病(如弓形体病、水痘)由于脾内白髓免疫系统的激活及造血性疾病(如髓外粒细胞生成、充血性脾大、传染性单核细胞增多症、骨髓纤维化、β-地中海贫血)由于脾内红髓的代偿性增生,当疾病进展到一定程度,均可表现为脾大伴弥漫性糖代谢活性增高[9-13]。粒细胞集落刺激因子用于骨髓抑制及干扰素用于黑色素瘤辅助化疗后都可出现治疗相关脾脏高摄取,治疗相关脾脏弥漫性糖代谢活性增高往往合并全身骨髓高摄取,再结合患者用药史,易与淋巴瘤脾脏浸润B组表现鉴别[14-15]。D组脾脏结节/团块状糖代谢活性增高需与转移瘤、血管肉瘤、恶性淋巴管瘤等恶性脾肿瘤相鉴别[16]。脾转移瘤相对少见,患者接受显像时多数可发现已有的原发肿瘤灶,发生脾脏转移最常见的肿瘤依次为肺癌、乳腺癌、卵巢癌、黑色素瘤等,而脾脏血管肉瘤少见,其体积较大,中心易坏死,周边糖代谢异常增高,常有肝转移。恶性淋巴管瘤更罕见,往往表现为脾内孤立性病灶,很少伴淋巴结病变。D组表现也需与一些脾脏非恶性病变相鉴别,如脾炎性肌纤维母细胞瘤、错构瘤、炎性假瘤及感染性脾梗死等。
淋巴瘤脾脏浸润18F-FDG PET/CT基本表现为:脾大,脾脏弥漫性糖代谢活性增高,脾大伴弥漫性糖代谢活性增高,脾多结节/团块状糖代谢活性增高。多结节/团块状糖代谢活性增高部分病灶同机CT表现为低密度影,且该组可合并脾大、脾脏弥漫性代谢活性增高及二者混合表现,表现较为复杂,例外,该组病灶糖代谢活性明显高于其他各组脾脏浸润病变。
1.De Jong PA,Van Ufford HM,Baarslag HJ,et al.CT and18F-FDG PET for noninvasive detection of splenic involvement in patients with malignant lymphoma[J].AJR Am JRoentgenol,2009,192:745-753.
2.Rini JN,Leonidas JC,Tomas MB,et al.18F-FDG PET versus CT for evaluating the spleen during initial staging of lymphoma[J].JNucl Med,2003,44:1072-1074.
3.Daskalogiannaki M,Prassopoulos P,Katrinakis G,et al. Splenic involvement in lymphomas:Evaluation on serial CT examinations[J].Acta Radiol,2001,42:326-332.
4.Paes FM,Kalkanis DG,Sideras PA,et al.FDG PET/CT of extranodal involvement in non-Hodgkin lymphoma and Hodgkin disease[J].Radiographics,2010,30:269~291.
5.Iyengar S,Chin B,Margolick JB,et al.Anatomical loci of HIV-associated immune activation and association with viraemia[J].Lancet,2003,362:945-950.
6.Brust D,Polis M,Davey R,et al.Fluorodeoxyglucose imaging in healthy subjects with HIV infection:impact of disease stage and therapy on pattern of nodal activation[J]. AIDS,2006,20:495-503.
7.Folz SJ,Johnson CD,Swensen SJ.Abdominal manifestationsofsarcoidosisin CT studies[J].JComputAssist Tomogr, 1995,19:573-579.
8.Kawai S,Ikeda E,Sugiyama M,et al.Enhancement of splenic glucose metabolism during acute malarial infection: correlation of findings of FDG-PET imaging with pathological changes in a primate model of severe human malaria[J].Am JTrop Med Hyg,2006,74:353-360.
9.Alnafisi N,Yun M,Alavi A.F-18 FDG uptake in congestive splenomegaly[J].Clin Nucl Med,2002,27:210.
10.Tomas MB,Tronco GG,Karayalcin G,et al.FDG Uptake in Infectious Mononucleosis[J].Clin Positron Imaging, 2000,3:176.
11.Sheehy N,Israel DA.Acute varicella infection mimics recurrent Hodgkin's disease on F-18 FDG PET/CT[J].Clin Nucl Med,2007,32:820-821.
12.Burrell SC,Fischman AJ.Myelofibrosis on F-18 FDG PET Imaging[J].Clin Nucl Med,2005,30:674.
13.Wong CL,Fulham MJ.Increased splenic FDGuptake on PET in beta-thalassemia[J].Clin NuclMed,2004,29:266-267.
14.Kazama T,Swanston N,Podoloff DA,et al.Effect of colony-stimulating factor and conventional-or high-dose chemotherapy on FDG uptake in bone marrow[J].Eur J Nucl Med Mol Imaging,2005,32:1406-1411.
15.Verma S,Quirt I,McCready D,et al.Systematic review of systemic adjuvant therapy for patients at high risk for recurrent melanoma[J].Cancer,2006,106:1431-1442.
16.Abe T,Sato M,Okumura T,etal.FDGPET/CT findingsof splenic angiosarcoma[J].Clin NuclMed,2009,34:82-83.
(2015-03-29收稿)
Feature analysis of18F-FDG PET/CT imaging of spleen in patients with lymphoma
Qiu Lin,Chen Yue,Huang Zhanwen,Zhu Yan,Zhang Li,Ding Haoyuan
Department of Nuclear Medicine,the First Affiliated Hospitalof Sichuan Medical University
Objective:To study the value of18F-FDG PET/CT in the diagnosis of splenic involvement of lymphoma.Methods:136 cases of18F-FDG PET/CT imaging of lymphoma patiants were divided into positive and negative splenic invedvement groups and the Spleen volume,SUVmax and the percentage of extranodal lesions of the two groups were compared.Patients in spleen positive group were further divided into stage I to IV and A-D groups for analysis.Results:In Spleen positive group(52 cases),the SUVmax of stage I to IV was 2.67 ±1.63,3.33±2.46,10.52±7.4 and 6.43±4.27,respectively.Spleen positive group patients were alse divided into 4 groups according to imaging features.The SUVmax of D group(splenic nodules/masses glucose metabolism activity increasing group)(SUVmax=12.02±6.24)was obviously higher than that of other 3 groups(SUVmax of group A,B,and C was 2.00±0.30,5.9±4.58,and 7.26±4.32,respectively)(q=2.46~5.32,P<0.05). Conclusion:The spleen average volume,SUVmax and the percentage of extranodal lesions besides spleen in spleen positive group are larger or higher than those of spleen negative group.The SUVmax of splenic nodules/ masses glucose metabolism activity increasing group is obviously higher than that of other groups.
Lymphoma;Splenic involvement;SUVmax
R733.1;R730.44
A
10.3969/j.issn.1000-2669.2015.04.006
*四川省科学技术厅与泸州市人民政府,泸州医学院联合科研专项资金计划(编号:14ZC0062)
邱琳(1986-),男,医师,硕士,E-mail:425420867@qq.com
