强氧化剂在初中化学教学中的妙用
2015-06-01毕桂洁
毕桂洁
强氧化剂在初中化学教学中的妙用
毕桂洁
介绍了利用高锰酸钾.浓硫酸.过氧化钠这三种实验室常见的强氧化剂完成的两个趣味实验.能够很好的解决一些疑难实验,充分调动学生学习化学的热情.
强氧化剂;高锰酸钾;浓硫酸;过氧化钠;点燃
氧化剂的概念在人教版化学教材中虽然并不是重点,但一些实验室中常见的强氧化剂却可以在演示实验中发挥意想不到的作用,能够很好的解决一些疑难实验,充分的调动起学生学习化学的热情。
以下我选取高锰酸钾、浓硫酸、过氧化钠这三种常见的强氧化剂完成两个趣味小实验:
一、奇幻点火
1.实验用品:
高锰酸钾、浓硫酸、药匙、玻璃片、玻璃棒、酒精灯
2.实验步骤:
用药匙取少量高锰酸钾粉末,集中放在玻璃片上。用玻棒先蘸取少量浓硫酸,再蘸一下高锰酸钾粉末,然后立即与酒精灯灯芯接触,随即灯芯就燃烧起来,一次可点燃二、三盏酒精灯。
3.原理分析:
高锰酸钾又名“灰锰氧”,是一种常见的强氧化剂,常温下为紫黑色暗紫色固体,受热见光易分解:分解的化学方程式为2KMnO□=K□MnO□+MnO□+O□↑,所以需要避光保存于阴凉处,严格禁止与其它易燃物同时存放。高锰酸钾在工业上有很广泛的应用,在工业上用作消毒粉、漂白粉等,在初中化学实验中,高锰酸钾常用于实验室制取氧气。高中化学利用高锰酸钾的强氧化性和水溶液鲜艳的颜色常用于物质的鉴别。
浓硫酸是指硫酸溶液里硫酸的溶质质量分数大于或等于70%的硫酸溶液。浓度很高的硫酸溶液具有很强的氧化性,这是高浓度硫酸和普通硫酸或一般浓度硫酸的最大区别。常用的浓硫酸中H□SO□的质量分数为98.3%,其密度为1.84g•cm-3,其物质的量浓度为18.4mol•L-1。硫酸是一种高沸点难挥发的强酸,易溶于水,能以任意比与水混溶。
浓硫酸和高锰酸钾反应生成七氧化二锰,七氧化二锰是棕色油状液体并且氧化性极强。它可与乙醇等易燃物剧烈反应并且放出大量热,在氧气充足的情况下,乙醇随即燃烧。
涉及到的化学方程式如下:
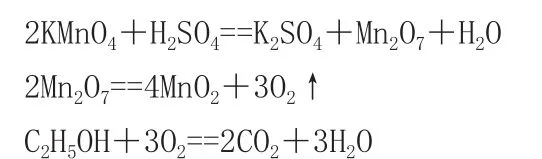
4.实验中的注意事项:
(1)高锰酸钾与浓硫酸要临时调混。因为七氧化二锰具有不稳定性,在常温下很快就能分解成二氧化锰和氧气。所以在玻棒蘸取浓硫酸和高锰酸钾后,要立即与酒精灯灯芯接触,点燃酒精灯。否则时间一长,七氧化二锰已经分解,热量已经散失,就点不着酒精灯了。
(2)酒精灯芯要松散,保持蓬松状态。
(3)实验完成后残留物要及时清理。绝对不能随意乱放,以免引起自燃事故。
5.引申的简易小实验:
在石棉网上放一小片脱脂棉花,用药匙的小端取少许研细的高锰酸钾粉末堆放在脱脂棉上,用胶头滴管往高锰酸钾粉末上滴加少量浓硫酸,可以观察到脱脂棉上先产生一种棕色油状液体,随即开始燃烧。此试验可以用来代替魔棒点火实验,且很容易成功,可作为初中化学第一节课的引入实验!
二、过氧化钠在碳还原氧化铜实验中的妙用
1.实验仪器和药品
三脚架.滤纸.泥三角.盛有水的烧杯.镊子.木条.火柴.酒精灯.过氧化钠粉末.木炭粉.氧化铜粉.
2.实验步骤:
(1)把滤纸叠成漏斗形状.将氧化铜,过氧化钠和活性炭按质量比约为10:2:1混合均匀.
(2)取混合物大约10g放在架在泥三角的纸漏斗内,并把泥三角担在盛有水的烧杯上,用燃着的木条和混合物接触。可以观察到混合物在纸漏斗内发生剧烈燃烧,纸漏斗烧破后有红色固体熔融落入下方盛有水的烧杯中。
(3)将红色固体取出后观察,呈现红色具有金属光泽的固体。该现象说明在高温条件下木炭与氧化铜反应产生红色的铜。
3.原理分析:
“木炭还原氧化铜”是九年级化学中的一个疑难实验。依照教科书上所说,仅用酒精灯和大试管完成这个实验的成功率是比较低的,主要原因是达不到所需温度。而我们在反应物中适量的加入过氧化钠,并将混合后的药品放于一纸漏斗中引燃,实验成功率就会提高。
过氧化钠是钠在氧气或空气中燃烧的产物之一,纯品过氧化钠为白色,但一般见到的过氧化钠呈淡黄色,原因是反应过程中生成了少量超氧化钠。过氧化钠易潮解、有腐蚀性,应密封保存。过氧化钠具有强氧化性,可以用来漂白纺织类物品、麦秆、羽毛等。
在木炭还原氧化铜的试验中加入一定的过氧化钠就是利用了过氧化钠的强氧化性,将加热方式由“外部获取能量”变成和“内部获取能量”。反应物中的过氧化钠,先与木炭剧烈反应,产生足够高的高温,在此温度下,氧化铜迅速被木炭还原为红色具有金属光泽的铜单质。这样做简化了实验操作,也使实验更容易成功。
4.实验中的注意事项:
(1)氧化铜.木炭粉.过氧化钠粉末,三者混合的质量比约为10:2:1,木炭粉稍过量。
(2)纸漏斗采用双层,药品的总量约为纸漏斗的一半。
(3)用燃着的木条去接触混合物粉末。反应一旦开始,便剧烈反应,放出大量的热,所以烧杯要尽量的大并且烧杯内必须盛有足够多的水,否则熔融物落下时容易炸裂烧杯。
(作者单位:新疆兵团第七师129团五五中学)
