尿嘧啶替加氟对Ⅱb~Ⅲ期宫颈癌维持化疗的临床研究
2015-06-01王浩渊
陈 晨 王浩渊
·论著·
尿嘧啶替加氟对Ⅱb~Ⅲ期宫颈癌维持化疗的临床研究
陈 晨 王浩渊
目的 探讨Ⅱb~Ⅲ期宫颈癌同期放化疗后口服尿嘧啶替加氟维持化疗的疗效及不良反应。方法 85例Ⅱb~Ⅲ期宫颈癌患者, 随机分为两组, 其中维持化疗组40例, 该组患者同期放化疗完成后给予口服尿嘧啶替加氟维持化疗至少1年, 对照组45例仅随访观察。比较两组患者近期疗效及不良反应。结果 维持化疗组无进展生存时间较对照组延长, 中位无进展生存时间分别为32个月与27个月, 差异有统计学意义(P=0.022<0.05)。两组骨髓抑制及胃肠道反应发生率比较, 差异无统计学意义(P>0.05)。结论 口服尿嘧啶替加氟维持化疗可改善Ⅱb~Ⅲ期宫颈癌生存质量, 且未明显增加毒性反应,有望在临床上推广使用。
尿嘧啶替加氟;宫颈癌;维持化疗
宫颈癌是妇科生殖系统最常见的恶性肿瘤, 在发展中国家居首位[1]。宫颈癌传统的治疗手段以手术和放疗为主, 但对中晚期宫颈癌, 上述治疗模式效果并不理想。对于Ⅱb~Ⅲ期的宫颈癌, 目前公认的治疗方式是同期放化疗, 但相当一部分患者治疗后仍有肿瘤残留, 总体生存欠佳[2]。因此, 对这部分患者寻求更好的治疗模式是目前临床研究的热点。本研究回顾性分析本院Ⅱb~Ⅲ期宫颈癌患者放化疗后采用尿嘧啶替加氟口服维持化疗的疗效及预后, 并与仅行同期放化疗的患者作一对比, 探讨该部分患者尿嘧啶替加氟口服维持化疗的安全性及有效性。现报告如下。
1 资料与方法
1.1 一般资料 收集2011年1月~2012年12月江门市中心医院肿瘤科收治的宫颈癌患者85例。病例入组标准:①在江门市中心医院初治并经病理确诊的病例。②国际妇产科联盟(international federation of gynecology and obstetrics, FIGO)分期为Ⅱb~Ⅲ期。③均接受了同期放化疗且未行手术治疗。④有详细的临床病理资料及随访资料。⑤无合并身体其他器官的肿瘤。年龄34~67岁, 中位年龄47.5岁。病理类型包括:鳞癌78例、腺癌7例。按FIGO分期标准, Ⅱb期72例, Ⅲ期13例。85例宫颈癌患者中, 维持化疗组40例患者在行同期放化疗后接受了口服尿嘧啶替加氟维持化疗至少1年, 对照组患者45例仅接受同期放化疗。两组患者年龄、KPS评分、病理分型、组织学分级、FIGO分期等比较, 差异均无统计学意义(P>0.05), 具有可比性。见表1。
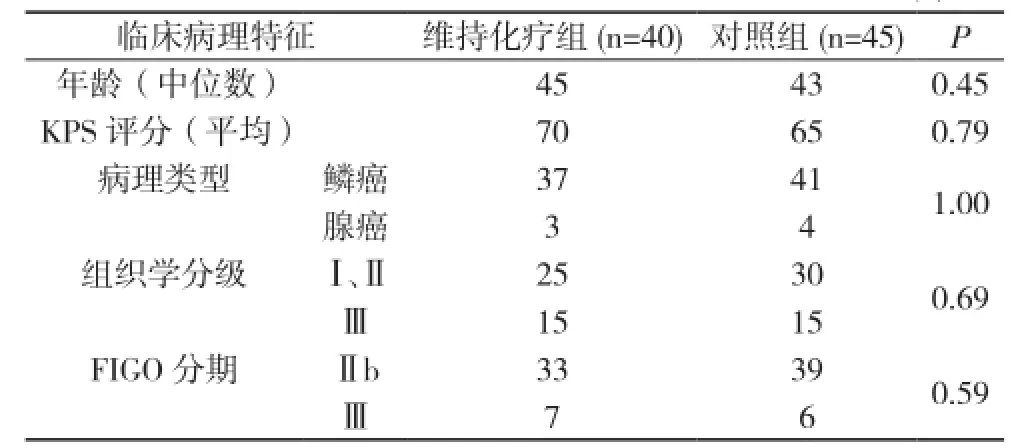
表1 维持化疗组与对照组患者临床病理情况比较(n)
1.2 治疗方法 所有患者均行同期放化疗, 放疗采用外照射+后装治疗, 外照射采用全盆腔四野盒式照射, 放疗剂量多数为45 Gy(40~50 Gy), 联合后装放疗后A点总等效剂量75~80 Gy, 放疗期间每周行顺铂(DDP) 30~40 mg/m2, 直至放疗结束。维持化疗组在同期放化疗完成后给予口服尿嘧啶替加氟化疗, 2~4片/次, 3次/d, 即300~600 mg/d, 若患者治疗期间出现严重放射性直肠炎则予停药。对照组患者完成同期放化疗后定期随访观察。分别计算分析两组患者不良反应发生率及无进展生存期。
1.3 随访情况 患者随访采用病历跟踪、电话随访及信件随访的方式, 随访截止日期为2014年12月31日。
1.4 统计学方法 采用IBMSPSS20.0软件进行统计分析。计数资料采用χ2检验及Fisher确切概率法;两组患者无进展生存期比较采用Kaplan-Meier法。P<0.05表示差异具有统计学意义。
2 结果
2.1 近期疗效 所有患者均顺利完成同期放化疗, 维持化疗组患者均完成尿嘧啶替加氟口服维持化疗1年以上。对照组随访观察。维持化疗组患者无进展生存期长于对照组患者,中位无进展生存时间分别为32个月与27个月, 差异有统计学意义(P=0.022<0.05)。两组患者的无进展生存曲线见图1。
2.2 不良反应 维持化疗组与对照组的主要不良反应均表现为骨髓抑制及胃肠道反应。本研究显示:两组患者骨髓抑制发生率比较, 差异无统计学意义(P>0.05)(15.0% VS 15.6%, P=0.943>0.05)。在维持化疗期间, 恶心呕吐少见, 但可观察到腹泻, 考虑为盆腔放疗引起放射性直肠炎, 但口服氟尿嘧啶类药物本身也可能引起肠道反应, 如腹泻、便血等, 有加重直肠炎反应可能。因此本研究中有2例患者因放射性直肠炎加重曾暂停维持化疗2个月, 直肠炎缓解后继续维持化疗。但统计学分析显示, 维持治疗组与对照组腹泻发生率及反应程度比较, 差异无统计学意义(P>0.05)(22.5% VS 17.8%, P=0.58>0.05)。见表2。
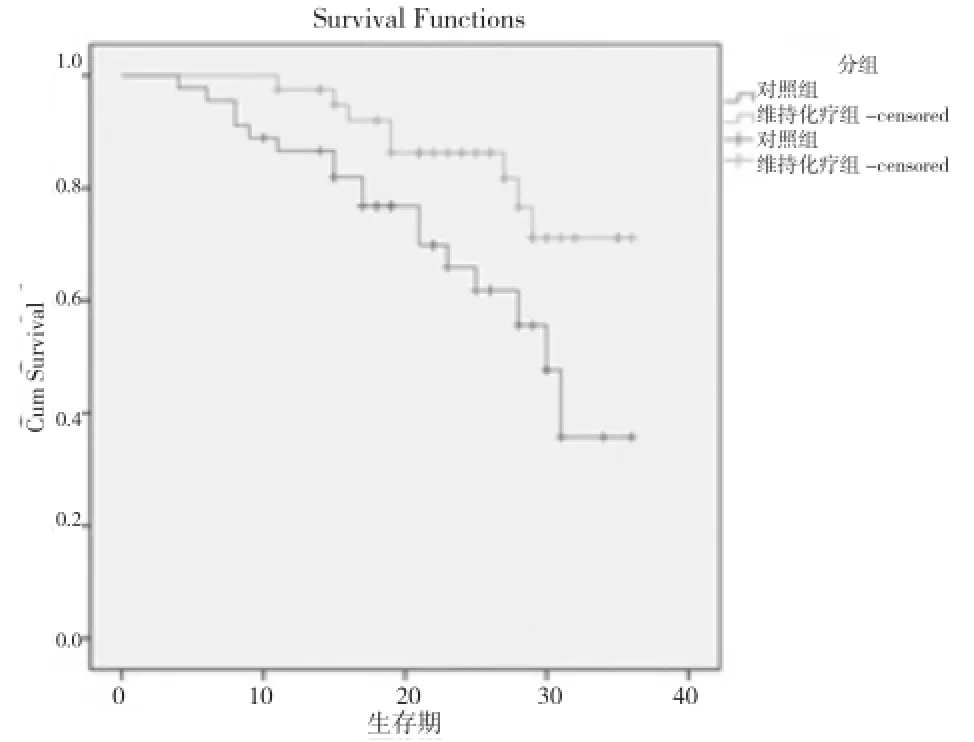
图1 维持化疗组与对照组生存曲线
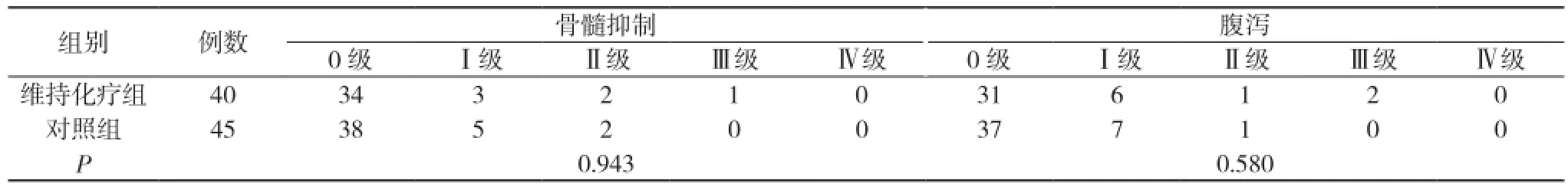
表2 维持化疗组与对照组患者不良反应比较(n)
3 讨论
世界上统计80%新诊断的宫颈癌病例都是在发展中国家, 由于经济方面的原因, 其中很多就诊时已是中晚期的患者。手术及放疗对早期宫颈癌可以取得良好效果, 但无法手术的中晚期宫颈癌效果不太理想。目前同期放化疗是Ⅱb~Ⅲ期宫颈癌的标准治疗方案, 但治疗后5年生存率仅25%~50%[3]。有相当一部分患者经过同期放化疗后仍有肿瘤残留或肿瘤未控, 因此对于同期放化疗后是否需后续治疗尚无统一的标准。
近年来, 由于维持治疗理论的发展, 认为患者接受一定疗程的治疗后达到最大控制效应后再接受药物治疗, 可以取得最大的肿瘤缓解程度及生存时间, 在没有严重不良反应的前提下, 维持治疗将一直进行到一定时间或疾病进展[4]。维持药物可以是诱导治疗时的药物或低毒的非交叉耐药的药物。尿嘧啶替加氟是一种口服的替加氟及尿嘧啶的混合制剂,两者以1∶4比例混合, 替加氟是5-氟尿嘧啶的前体, 在体内逐渐变为氟尿嘧啶而起作用。其作用与5-氟尿嘧啶相同,在体内能干扰、拮抗DNA、RNA及蛋白质的合成。动物实验表明其毒性只有氟尿嘧啶的1/7~1/4;化疗指数为氟尿嘧啶的2倍。慢性毒性实验中未见到严重的骨髓抑制, 对免疫的影响亦较轻微。口服后吸收良好, 给药后2 h对DNA、RNA和蛋白质合成的抑制作用达最高峰, 持续时间亦较长为12~20 h[5]。5-氟尿嘧啶作为宫颈癌患者有效的化疗药物已应用临床已久, 而使用口服尿嘧啶替加氟维持化疗具有低毒、有效、费用低廉的特点, 这正是作者选用该化疗药物进行维持治疗的原因。
近年来, 研究证实在肺癌、胃癌、宫颈癌患者中使用替加氟进行术后辅助化疗与单纯手术患者相比均能延长其生存时间[6-8]。然而关于宫颈癌维持治疗国内鲜有报道, 国外Sakaguchi等[9]对所有分期的宫颈癌使用高剂量的尿嘧啶替加氟(600 mg/d)维持治疗, 结果发现替加氟组总生存率显著优于对照组, 对于Ⅲ期患者、鳞癌以及同期或曾行放疗的患者生存改善更加明显。而作者的研究显示对于Ⅱb~Ⅲ期宫颈癌同期放化疗后采用尿嘧啶替加氟口服, 300~600 mg/d维持化疗1年以上可改善患者无进展生存期。因随访时间尚短,本研究中未分析其总生存期差异。而两组患者不良反应均在患者可耐受范围内, 发生严重不良反应罕见, 维持治疗组仅有2例患者因放射性直肠炎加重暂时停止尿嘧啶替加氟口服, 与对照组相比, 使用尿嘧啶替加氟维持化疗并未增加骨髓抑制及胃肠道反应的发生及严重程度, 提示该方案是安全可行的。
综上所述, Ⅱb~Ⅲ期宫颈癌同期放化疗后使用尿嘧啶替加氟维持化疗能显著改善患者生存期, 不良反应可以耐受,并且该药物价格低廉, 安全性好, 适合在我国推广, 今后可进行该方案多中心随机对照研究, 为改善我国Ⅱb~Ⅲ期宫颈癌患者的治疗效果提供更好的证据。
[1] Jemal A, Bray F, Center MM, et al.Global cancer statistics.CA Cancer J Clin, 2011, 61(2):69-90.
[2] 周晖, 彭永排, 俞进, 等.《2014年NCCN宫颈癌临床实践指南》解读.实用妇产科杂志, 2014, 30(6):422-425.
[3] 孙燕.临床肿瘤学高级教程(下册).北京:人民军医出版社, 2012:651.
[4] Goldie JH, Coldman AJ, Gudauskas GA.Rationale for the use of alternating non-cross-resistant chemotherapy.Cancer Treat Rep, 1982, 66(3):439-449.
[5] Tanaka F, Fukuse T, Wada H, et al.The history, mechanism and clinical use of oral 5-fluorouracil derivative chemotherapeutic agents.Curr Pharm Biotechnol, 2000, 1(2):137-164.
[6] Nakagawa K, Tada H, Akashi A, et al.Randomised study of adjuvant chemotherapy for completely resected p-stageⅠ-ⅡA non-small cell lung cancer.Br J Cancer, 2006, 95(7):817-821.
[7] Nakajima T, Kinoshita T, Nashimoto A, et al.Randomized controlled trial of adjuvant uracil-tegafur versus surgery alone for serosa-negative, locally advanced gastric cancer.Br J Surg, 2007, 94(12):1468-1476.
[8] Yamamoto K, Izumi R, Hasegawa K, et al.Adjuvant oral 5-fluorouracil for cervical cancer: Japanese Gynecologic Oncology Group report.Int J Oncol, 2004, 24(15):1175-1179.
[9] Sakaguchi I, Motohara T, Saito F, et al.High-dose oral tegafururacil maintenance therapy in patients with uterine cervical cancer.J Gynecol Oncol, 2015.
Clinical research of uracil-tegafur for maintenance chemotherapy of stageⅡb~Ⅲ cervical cancer
CHEN Chen, WANG Hao-yuan.Department of Oncology, Jiangmen City Central Hospital, Jiangmen 529030, China
Objective To investigate the curative effect by oral administration of uracil-tegafur for maintenance chemotherapy of stageⅡb~Ⅲ cervical cancer after concurrent chemoradiotherapy.Methods A total of 85 patients with stageⅡb~Ⅲ cervical cancer were randomly divided into two groups.Maintenance chemotherapy group with 40 cases received oral administration of uracil-tegafur for at least 1 year after concurrent chemoradiotherapy.Control group with 45 cases received follow-up alone.Short-term effects and adverse reactions of the two groups were compared.Results The maintenance chemotherapy group had longer progression free survival than the control group, and their median progression free survival were respectively 32 months and 27 months.Their difference had statistical significance (P=0.022<0.05).There were no statistically significant differences of myelosuppression and incidence of gastrointestinal reactions between the two groups (P>0.05).Conclusion Oral administration of uracil-tegafur can improve life quality in stage Ⅱb~Ⅲ cervical cancer, without any increased toxic reactions.This method is worthy of clinical promotion and application.
Uracil-tegafur; Cervical cancer; Maintenance chemotherapy
10.14163/j.cnki.11-5547/r.2015.16.001
2015-03-13]
529030 江门市中心医院肿瘤科, 中山大学附属江门医院肿瘤科(陈晨);江门市中心医院重症医学科(王浩渊)
