巨噬细胞金属弹力酶 缺氧诱导因子-1α及血管内皮生长因子在胃癌中的表达及其意义
2015-06-01张楠楠许建明胡乃中
石 海 卢 杰 程 芃 张楠楠 许建明 胡乃中
·基础医学·
巨噬细胞金属弹力酶 缺氧诱导因子-1α及血管内皮生长因子在胃癌中的表达及其意义
石 海 卢 杰 程 芃 张楠楠 许建明 胡乃中
目的探讨巨噬细胞金属弹力酶(HME)、缺氧诱导因子-1α(HIF-1α)及血管内皮生长因子(VEGF)在胃癌中的表达及临床意义。方法采用免疫组化SP法检测胃癌及癌旁组织各30个标本中HME、HIF-1α及VEGF的表达情况。结果①HME、HIF-1α和VEGF在胃癌组织中表达高于癌旁组织,差异有统计学意义(P<0.05)。②HME的表达与胃癌的血管浸润和分化程度有相关性, HIF-1α的表达与肿瘤的组织学类型、淋巴结转移及TNM分期有相关性,VEGF的表达与浸润深度、淋巴结转移及TNM分期有相关性。③VEGF分别与HME和HIF-1α在胃癌组织中的表达存在密切的相关性。结论胃癌中HME、HIF-1α及VEGF的高表达可能为肿瘤侵袭转移的机制之一,且这些指标的检测对于胃癌的早期判断、干预治疗及预测肿瘤的转移预后有重要的临床意义。
胃癌;人巨噬细胞金属弹力酶;缺氧诱导因子-1α;血管内皮生长因子
胃癌是世界上最常见的恶性肿瘤,在我国发病率高,病死率占恶性肿瘤的第一位,其早期的诊断、治疗、浸润和转移是影响预后的主要因素。肿瘤的快速生长必然造成营养成分和氧气供应不足导致肿瘤缺氧甚至无氧,故肿瘤细胞微环境缺氧是其共同特征,是肿瘤生长过程中存在的普遍现象。在缺氧微环境下肿瘤细胞高表达缺氧诱导因子-la[1](Hypoxia induced factor, HIF-1α)。在长期缺氧微环境刺激下,通过HIF-1α表达增高、调控血管新生(如VEGF,TGF等)及促进细胞发生上皮间质转化(如TWIST,E-cadherin等)等途径,适应缺氧微环境而促进肿瘤生长和转移[2]。其中血管内皮生长因子(vascular endothelial growth factor,VEGF)是特异性最高、作用最强的促血管生长因子[3],是诱导肿瘤血管生长最关键的因子之一;而巨噬细胞金属弹力酶(human macrophage metalloelastase, HME)是基质金属蛋白酶家族(MMPs)中的一员,又称为MMP-12,其过度表达可以分解纤溶酶原产生血管抑素从而抑制VEGF的作用。故本文通过对HME、HIF-1α及VEGF在胃癌中的表达及相互关系进行探讨,为临床的诊断、治疗及预后提供理论依据。
1 材料与方法
1.1 材料 兔抗人Anti-VEGF多克隆抗体、HIF-1α兔抗人多克隆抗体、MMP-12兔抗人多克隆抗体、柠檬酸盐、免疫组化试剂盒、PBS及DAB显色液均购自北京中杉金桥生物有限公司。
1.2 方法
1.2.1 标本采集 组织标本取自2007年6月至2008年1月安徽医科大学第一附属医院外科手术全切或者次全切除的胃癌组织及距胃癌组织切缘3 cm以外的正常胃黏膜组织各30个。胃癌组织和癌旁组织均再次由病理科医生经HE染色镜检确认诊断结果。
1.2.2 免疫组化染色 采用常规免疫组化SP法对石蜡包埋组织切片(厚5 μm )进行MMP-12、HIF-1α和VEGF染色。
1.2.3 结果判定 HIF-1α以细胞质和(或)细胞核内出现棕黄色颗粒为阳性;HME染色阳性位于细胞浆和(或)细胞膜中呈棕黄色,强染时呈棕褐色;VEGF染色阳性主要表达于胞质。采用半定量积分法判断阳性结果[4]:按染色强度评分:无染色为0分,浅黄色为1分,棕黄色为2分,棕褐色为3分;高倍镜(×400)下随机对每张切片取10个视野,每个视野计数100个细胞,计算阳性细胞占同类细胞的百分数,细胞阳性率无的为0分,<25%的为1分,25%~50%的为2分,>50%的3分。 二者积分乘积<2为阴性,>2为阳性。
1.3 统计学方法 采用χ2检验分析HME、HIF-1α及VEGF的表达,参数间的相关性分析采用2×2列联分析进行比较,所有统计分析采用SPSS 11.0统计软件完成,P<0.05为差异有统计学意义。
2 结果
2.1 HME、HIF-1α及VEGF在胃癌及癌旁组织中的表达 HIF-1α在胃癌组织中主要分布细胞质中,少量分布在细胞核中,在癌旁组织中表达大部分为阴性,少数为阳性,染色后呈棕黄色颗粒,强染呈棕褐色;HME和VEGF在胃癌组织中表达主要分布在细胞浆和(或)细胞膜中,在癌旁组织中少量表达,染色后呈棕黄色,强染时呈棕褐色。HME阳性率:在胃癌组织中为70.0%(21/30),在癌旁组织中为26.7%(8/30),差异有统计学意义(χ2=11.279,P<0.05);HIF-1α阳性率:在胃癌组织中为76.7%(23/30),在癌旁组织中为16.7%(5/30),差异有统计学意义(χ2=21.696,P<0.05);VEGF的阳性率:在胃癌组织中为73.3%(22/30),在癌旁组织中为30.0%(9/30),差异有统计学意义(χ2=11.279,P<0.05)。详见表1。
2.2 VEGF、HIF-1α及HME在胃癌中的表达与胃癌临床病理参数的关系 HME的表达与胃癌的血管浸润和分化程度存在相关性,与其他临床病理参数无明显相关;HIF-1α的表达与肿瘤的组织学类型、淋巴结转移及TNM分期存在相关性,与其他临床病理参数无明显相关;VEGF的表达与浸润深度、淋巴结转移及TNM分期有相关性,与其他临床病理参数无明显相关。详见表1。
2.3 VEGF与HME及HIF-1α在胃癌组织中表达的关联性分析 肿瘤新生血管的形成依赖VEGF的表达[5],本实验亦分析了胃癌标本中VEGF的表达与HME、HIF-1α的关系,在VEGF和HME的联合检测中发现两者均为阳性的为63.3%(19/30),均为阴性的为20.0%(6/30);在VEGF阳性表达的例数中HME也表达为阳性的为86.4%(19/22),在HME阳性表达的例数中VEGF也表达为阳性的为90.5%(19/21)。VEGF和HME在胃癌组织中表达存在关联 (列联分析r=0.510,P<0.05)。在VEGF和HIF-1α的检测中发现两者均为阳性的为70.0%(21/30),均为阴性的为20.0%(6/30);在VEGF阳性表达的例数中HIF-1α也表达为阳性的为95.5%(21/22),在HIF-1α阳性表达的例数中VEGF也表达为阳性的为91.3%(21/23);VEGF和HIF-1α在胃癌组织中表达存在关联(列联分析r=0.593,P<0.05)。详见表2。
3 讨论
胃癌的发生发展是胃黏膜细胞一系列基因的结构或表达水平改变所积累起来的多因素、多步骤的复杂过程[6]。恶性肿瘤的浸润和转移是其重要特征,是导致患者预后不良的主要原因,而血管的生成是恶性肿瘤浸润、转移和发展过程中极为重要的步骤。VEGF是目前发现的作用最强,特异性最高的促血管生长因子,在血管生成中处于核心地位。VEGF是内皮细胞特异性的血管生成因子,具有经典的信号序列[7], VEGF通过直接刺激内皮细胞增殖和迁移发挥重要作用。本组实验在胃癌和癌旁组织标本各30个中,胃癌组织中的表达明显高于癌旁组织,说明VEGF与胃癌的发生、发展、浸润、转移有密切的关系。通过对HME、VEGF和HIF-1α的联合检测进行关联性分析发现HME的表达与VEGF呈负相关,HIF-1α的表达与VEGF呈正相关,结合患者完整的临床资料提示:VEGF的表达与浸润深度、淋巴结转移及TNM分期有相关性,与其他的临床参数无明显的相关性。
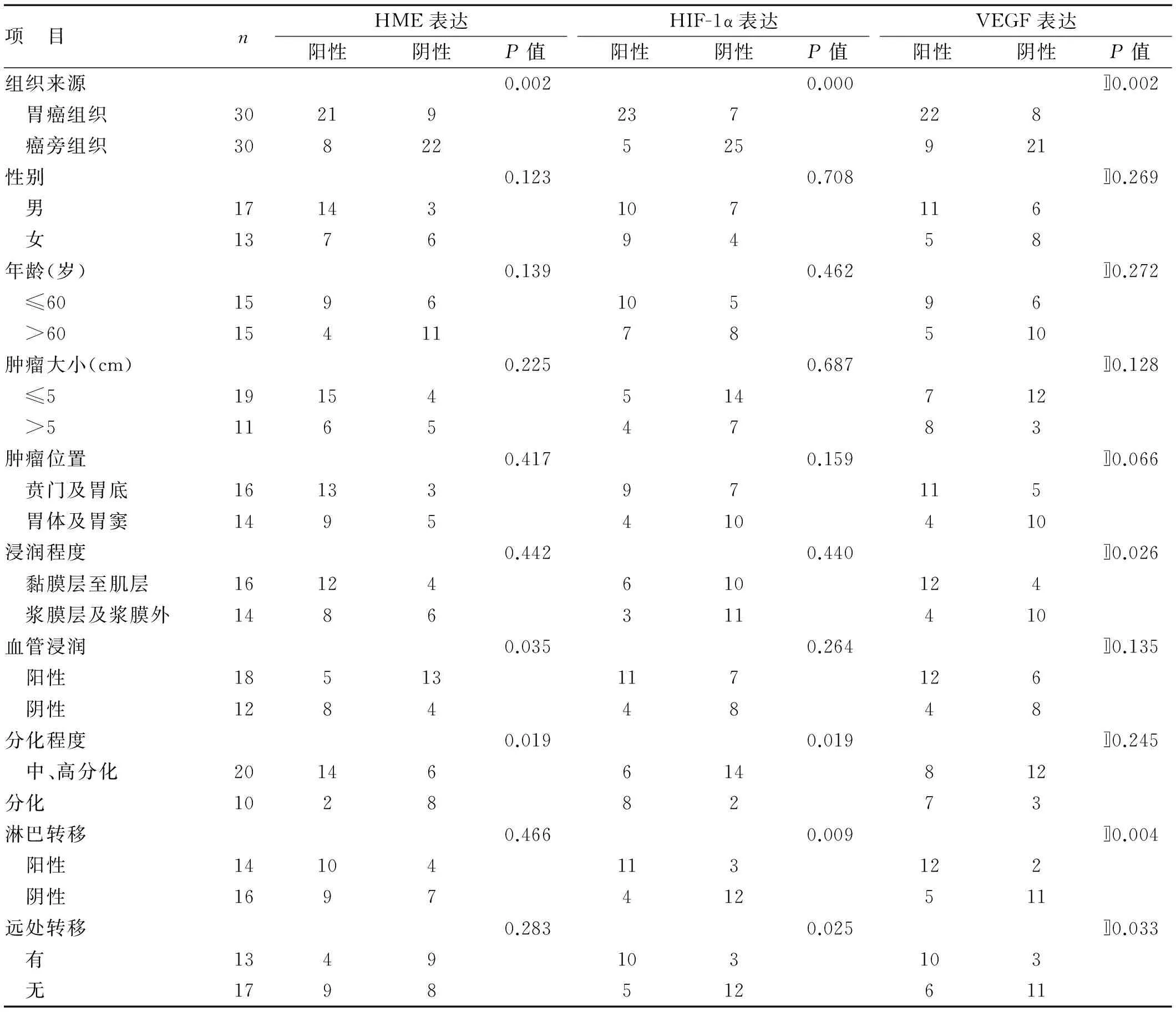
表1 HME、HIF-1α及VEGF在胃癌及癌旁组织中的表达及临床意义(例)
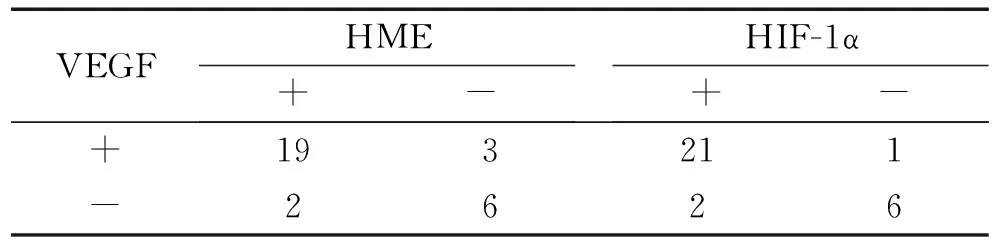
表2 HME、HIF-1α及VEGF在胃癌组织中表达的关联性分析(例)
肿瘤生长迅速,随着肿瘤的不断生长,体积不断增大,细胞耗氧量也不断增加,因此缺氧是恶性肿瘤生长过程中普遍存在的现象,是肿瘤微环境的显著特征[8]。而在缺氧的微环境中,HIF-1α是关键的氧调节因子,是肿瘤生长的启动子。 HIF-1α的活性在肿瘤的发生、发展、转移中起着非常重要的作用[9]。HIF-1α的过表达可调控下游的靶基因如VEGF、糖酵解酶、EPO等产生红细胞、新生血管等病理生理反应,从而提高肿瘤细胞对缺氧的耐受性,保证有足够的能量使其增殖,浸润和转移。有研究[10]表明,胃黏膜上皮细胞中HIF-1α表达与VEGF表达密切相关。本实验中,胃癌组织中的表达明显高于癌旁组织,说明HIF-1α与肿瘤的发生、发展、浸润和转移有关。通过对VEGF和HIF-1α的联合检测进行关联性分析发现两者在胃癌组织中的表达存在正相关,HIF-1α表达的增加可以促进VEGF的生成,从而促进新生血管的生成。结合患者完整的临床资料提示:HIF-1α的表达与肿瘤的组织学类型、淋巴结转移及TNM分期有关,与其他的临床参数无明显的相关性。
肿瘤的发生、发展、浸润和转移是多重因素作用所致,而机体自身免疫监控失调是肿瘤形成的基本因素之一,其中巨噬细胞是机体免疫防御体系的主要组成部分。巨噬细胞金属弹性酶(HME)是由活化的巨噬细胞分泌,它能降解多种细胞外和非细胞外成分[11], 是巨噬细胞穿透基底膜和浸润肿瘤组织必不可少的一种活性物质,部分瘤细胞也具有分泌巨噬细胞金属弹力酶的作用。在肝细胞癌组织中,HME表达与癌组织的血供呈负相关,是一个新的影响肝癌患者术后生存时间的独立预后因素。HMEmRNA过表达,结直肠癌患者的血管浸润及淋巴结浸润的发生率均较低,预后较好。重组MME具有显著的抑制小鼠原位种植结肠癌生长和微血管生成的作用[12-15]。上述结果均提示HME起着重要的抑制肿瘤进展的作用。国外研究[16]发现,HME可以分解纤溶酶原产生血管抑素,从而具有抑制微血管内皮细胞增殖的作用。血管抑素主要通过抑制VEGF而抑制新生血管的生成,从而抑制肿瘤的浸润及转移。本实验中,HME在胃癌中的表达明显高于癌旁组织,说明HME的过度表达与肿瘤的浸润及转移有关,通过对VEGF和HME的联合检测进行关联性分析发现两者在胃癌组织中的表达存在负相关,HME的过表达的抑制VEGF的生成,从而抑制新生血管的生成。结合患者完整的临床资料提示:HME的表达与肿瘤的血管浸润和分化程度有相关性,与其他的临床参数无明显的相关性。
综上所述,胃癌早期检出率低,高转移高侵袭性是其致死率高的主要原因。本实验发现,HME、HIF-1α及VEGF在胃癌组织中的表达明显高于癌旁组织,并且HME的表达与VEGF呈负相关,HIF-1α与VEGF呈正相关,提示HME、HIF-1α及VEGF在胃癌发展的进程中均发挥着一定的作用,为进一步探讨胃癌的浸润、转移及发病机制奠定基础,可作为评价胃癌的早期诊断、浸润、转移及预后的指标并为分子靶向治疗等提供线索。
[1] Arjumand W, Suitana S. Roie of VHL gene mutation in human renal cell carcinoma[J]. Tumour Bioi, 2012,33(1):9-16.
[2] Noman MZ, Messai Y, Carr T,et al. Microenvironmental hypoxia orchestrating the cell stroma cross talk, tumor progression and antitumor response [J] .Crit Rev Immunol, 2011,31 ( 5):357-377.
[3] Kosem M, Tuncer I, Kotan C, et al. Significance of VEGF and microvascular density in gastric carcinoma[J]. Hepatogastroenterology,2009,56(93):1236-1240.
[4] Kawasaki H, Altieri DC, Lu CD, et al. Inhibition of apoptosis by surviving predicts shorter survival rates in colorectal cancer[J]. Cancer Res,1998,58(22):5071-5074.
[5] Ribatti D. Cancer stem cells and tumor angiogenesis[J].Cancer Lett,2012,321(1):13-17.
[6] Miyamoto N, Yamamoto H, Taniguchi H, et al. Differential expression of angiogenesis-related genes in human gastric cancers with and those without high-frequency microsatellite instability[J]. Cancer Lett,2007,254(1):42-53.
[7] Backer MV, Backer JM. Imaging key biomarkers of tumor angiogenesis[J]. Theranostics,2012,2(5):502-515.
[8] Stoeltzing O,McCarty MF,Wey JS,et al.Role of hypoxia-inducible factor 1alpha in gastric cancer cell growth angiogenesis and vessel maturation[J].J Natl Cancer Inst,2004,96(12):946-956.
[9] Smith TG,Robbim PA,Ratcliffe PJ.The human side of hypoxia—inducible factor[J],Br J Haematol,2008,141(3):325-334.
[10]Liu L, Ning X, Han S, et al. Hypoxia induced HIF-1 accumulation and VEGF expression in gastric epithelial mucosa cell: involvement of ERK1/2 and PI3K/Akt[J].Mol Biol (Mosk),2008,42(3):459-469.
[11]Chakraborti S, Mandal M, Das S, et al. Regulation of matrix metalloproteinases:an overview[J].Mol Cell Biochem,2003,253(1/2):269-285.
[12]Shi H, Xu JM, Hu NZ,et al. Transfection of mouse macrophage metalloelastase gene into murine CT-26 colon cancer cells suppresses orthotopic tumor growth, angiogenesis and vascular endothelial growth factor expression[J]. Cancer Lett, 2006,233(1): 139-150.
[13]Gorrin-Rivas MJ, Arii S, Mori A, et al. Implications of human macrophage metalloelastase and vascular endothelial growth factor gene expression in angiogenesis of hepatocellular carcinoma[J]. Ann Surg, 2000,231(1):67-73.
[14]Gorrin-Rivas MJ, Arii S, Furutani M,et al. Expression of human macrophage metalloelastase gene in hepatocellular carcinoma: correlation with angiostatin generation and its clinical significance[J]. Hepatology, 1998,28(4):986-993.
[15]Yang W, Arii S, Gorrin-Rivas MJ,et al. Human macrophage metalloelastase gene expression in colorectal carcinoma and its clinicopathologic significance[J]. Cancer, 2001,91(7):1277-1283.
[16]Dong Z, Kumar R, Yang X,et al. Macrophage-derived metalloelastase is responsible for the generation of angiostatin in Lewis lung carcinoma[J]. Cell, 1997,88(6): 801-810.
(2015-03-21收稿 2015-05-01修回)
Expressions and clinical significance of human macrophage metalloelastase, hypoxia induced factor-la and vascular endothelial growth factor in gastric cancer
ShiHai,LuJie,ChengPeng,etal
DepartmentofGastroenterology,theFirstAffiliatedHospitalofAnhuiMedicalUniversity,Hefei230032,China
Objective To investigate the expression and clinical significance of human macrophage metalloelastase (HME), hypoxia induced factor-la (HIF-1α) and vascular endothelial growth factor (VEGF) in gastric cancer. Methods The expression of HME, HIF-1α and VEGF proteins in 30 specimens of gastric carcinoma and corresponding normal tissues were detected by immunohistochemical SP method, and the correlation of HME, HIF-1α and VEGF and its relationship with clinical pathology were analyzed. Results ①The expression of HME, HIF-1α and VEGF in gastric carcinoma was significantly higher than that of normal gastric tissues, and the difference had statistical significance. ②The expression of HME was significantly associated with blood vessel invasion and the degree of differentiation, nothing to do with other clinic pathological parameters. The expression of HIF-1α was significantly associated with the degree of differentiation, lymph node metastasis and tumor stage. The expression of VEGF was significantly associated with the depth of invasion, lymph node metastasis and tumor stage. ③The expression of VEGF was correlated to that of HME and HIF-1α in gastric carcinoma. Conclusion The expressions of HME, HIF-1α and VEGF show a positive expression in gastric carcinoma. Their expressions are closely related with the angiogenesis, infiltration and transfer, and involved in the occurrence and development of gastric cancer, which may help to explore the mechanism of gastric cancer.
Gastric carcinoma;Human macrophage metalloelastase;Hypoxia induced factor;Vascular endothelial growth factor
上海市卫生局科研课题基金资助项目(20124271)
230032 合肥 安徽医科大学第一附属医院消化科(石海,卢杰,张楠楠,许建明,胡乃中) 201900 上海 上海交通大学医学院附属第三人民医院消化科(程芃)
程芃,shmdah@163.com
10.3969/j.issn.1000-0399.2015.07.033
