香蕉MaPIP2—2基因的克隆、亚细胞定位及表达分析
2015-05-30侯晓婉胡伟颜彦徐碧玉金志强
侯晓婉 胡伟 颜彦 徐碧玉 金志强


摘 要 水通道蛋白(AQPs)是细胞间和细胞内水分运输的主要通道, 对于植物细胞的水分稳态和胁迫响应具有重要作用。本研究从香蕉中克隆了一个水通道蛋白基因MaPIP2-2。序列分析结果表明,该基因的开放阅读框(ORF)为846 bp,编码281个氨基酸。多序列比对和进化树分析结果表明,该基因编码的蛋白与其它植物中水通道蛋白具有较高的一致性,并且与拟南芥AtPIP2-2和AtPIP2-3的亲缘关系最近。亚细胞定位表明该基因定位在细胞膜上。实时荧光定量PCR分析结果表明,该基因能够在转录水平响应甘露醇、低温、NaCl胁迫和ABA信号。这些结果表明MaPIP2-2可能参与了非生物逆境胁迫应答,为进一步研究MaPIP2-2基因的功能鉴定了基础。
关键词 水通道蛋白;PIP;香蕉;克隆;亚细胞定位;荧光定量PCR
中国分类号 Q344.13 文献标识码 A
Abstract Water channel protein,(Aquaporins, AQPs), which was the main water transport corridor, plays a major role in maintaining water steady state and the stress response. In the present study, a AQP gene designated MaPIP2-2 from banana was isolated. MaPIP2-2 ORF was 846 bp, encoding 281 amino acids. Comparison of amino acid sequences and phylogenetic analysis indicated that MaPIP2-2 was closely related with AtPIP2-2 and AtPIP2-3. Subcellular localization assays showed that the MaPIP2-2 protein was present in the plasma membrane. Real-time quantitative polymerase chain reaction(QPCR)assay revealed that MaPIP2-2 participated in the response of abiotic stresses at transcriptional level. These results indicated that MaPIP2-2 might be involved in abiotic stress responses. The study would lay a foundation for further investigating the function of MaPIP2-2.
Key words Aquaporins; PIP; Banana; Cloning; Subcellular localization; Quantitative RT-PCR
doi 10.3969/j.issn.1000-2561.2015.07.014
水是生物体的主要组成部分,对生命至关重要。植物体的生长很大程度上取决于植物对水分的吸收和运输,然而高盐、干旱、低温等环境胁迫导致植物体内水分的缺失,严重影响植物的生长发育[1]。香蕉作为世界第四大粮食作物,因其特有的浅根和需要大量水份维持的永久性绿色树冠,对任何条件引起的水份缺失异常敏感[2],因此研究香蕉如何响应非生物胁迫显得尤为重要。
水分在植物体不同组织之间的运输主要是通过质外体和共质体途径[3]。水通道蛋白AQPs(Aquaporin, AQP)参与了水分共质体途径的运输,负责水分的快速跨膜转运,扮演着“细胞的水管工”,介导植物种子萌发、细胞伸长、气孔运动、韧皮部的装卸及逆境应答等多个生理过程[4-5]。AQP通过快速改变植物膜的通透性以应对外界环境的变化,在植物对逆境胁迫的应答中发挥着重要作用[6-7]。已有的报道表明,来自于水稻、小麦、拟南芥等多个物种的AQP家族基因能够在转录水平响应非生物胁迫及相关信号分子,但香蕉中AQP家族基因功能的研究还非常有限。
水通道蛋白(AQP)属于膜内嵌蛋白MIP(a class of major intrinsic proteins,MIP)的一个大的亚家族,是由四聚体组成的沙漏状结构。由5个短环(A-E 环)连接的6个跨膜a-螺旋组成,其中B、D 环各有一段高度保守的天冬酰胺-脯氨酸-丙氨酸(Asn-Pro-Ala,NPA)元件,它们与其他跨膜区域共同形成通道[3,8-9]。根据结构和定位,AQP被分为4类,分别为质膜内嵌蛋白(the plasma membrane intrinsic proteins,PIPs)、液泡膜内嵌蛋白(the tonoplast intrinsic proteins,TIPs)、小分子碱性膜内嵌蛋白(the recently characterized small basic intrinsic proteins,SIPs)和类NOD 26膜内嵌蛋白(the NOD-26-like intrinsic proteins,NIPs)[10-13]。
本研究从香蕉中克隆了一个MaPIP2-2基因,并对其在逆境胁迫以及ABA处理下的表达模式进行了研究。研究结果表明,克隆得到的MaPIP2-2基因编码的蛋白具有AQP家族蛋白的基本特征;MaPIP2-2基因的表达能够响应非生物逆境胁迫及ABA信号。本研究的结果为进一步研究MaPIP2-2基因的功能奠定了基础。
1 材料与方法
1.1 材料
1.1.1 植物材料 生长正常的五叶一心巴西蕉(Musa AAA Cavendish cv. Brazilian)幼苗取自中国热带农业科学院儋州组培中心。
1.1.2 主要试剂 PEG6000、NaCl、ABA、AS、MES等生化试剂购自上海生工生物工程有限公司;氯仿、异戊醇等各种分析纯试剂购自广州化学试剂公司;限制性内切酶、反转录试剂盒、实时荧光定量PCR试剂盒购自TaKaRa公司;T4连接酶购自BioLab试剂公司,胶回收试剂盒、质粒提取试剂盒购自OMEGA试剂生物公司,PCR试剂购自康为试剂生物公司。
1.2 方法
1.2.1 目的基因的获得 从香蕉A基因组测序数据库中得到一个AQP家族基因,根据ORF序列设计一对引物(5'- CATGCCATGGCGATGTCGAAGGA
GGTCAGTGA-3';5'-GGACTAGTGTTGGTGGGGTT
GCTCCG-3')扩增MaPIP2-2 cDNA全长序列。PCR扩增程序为:变性,94 ℃,40 s;退火,55 ℃,40 s;延伸,72 ℃,1 min 30 s;共35个循环。扩增体系为20 μL体系:Mix,10 μL;Primer F,1 μL;Primer R,1 μL;cDNA,1 μL;ddH2O,7 μL。PCR扩增产物回收、连接、转化后,挑取单克隆在LB液体培养基中培养并进行PCR鉴定。对已鉴定的阳性克隆进行测序分析。
1.2.2 生物信息学分析 在NCBI中利用BLASTX进行序列同源性分析,从中选取相似性较高的同源序列用DNAMAN软件进行氨基酸序列的多重比对。另外,为了确认与其他物种中同源基因的亲缘关系,利用MEGA软件对拟南芥AQP基因家族和克隆出的MaPIP2-2基因一起构建系统发育树。
1.2.3 MaPIP2-2亚细胞定位分析 (1)瞬时表达载体构建。根据目的基因MaPIP2-2序列设计带有酶切位点NcoⅡ/SpeⅠ和不含终止子的载体引物:5'-CATGCCATGGCGATGTCGAAGGAGGTCAGTGA-3';5'-GGACTAGTGTTGGTGGGGTTGCTCCG-3'。扩增产物回收后连接到克隆载体pMD18-T上,获得重组质粒,阳性克隆测序正确后,用NcoⅡ/SpeⅠ进行双酶切并回收目的片段。同时,利用NcoⅡ/SpeⅠ双酶切并回收的pCAMBIA1302载体大片段。利用T4连接酶将目的片段和载体片段进行连接,将连接产物转化大肠杆菌DH5α后,挑取单克隆扩大培养,经PCR和质粒双酶切验证后,进行测序分析,从而成功构建植物表达载体pCAMBIA1302-MaPIP2-2-GFP。将测序正确的阳性克隆的质粒以及pCAMBIA1302空载体质粒分别转入农杆菌LBA4404中。
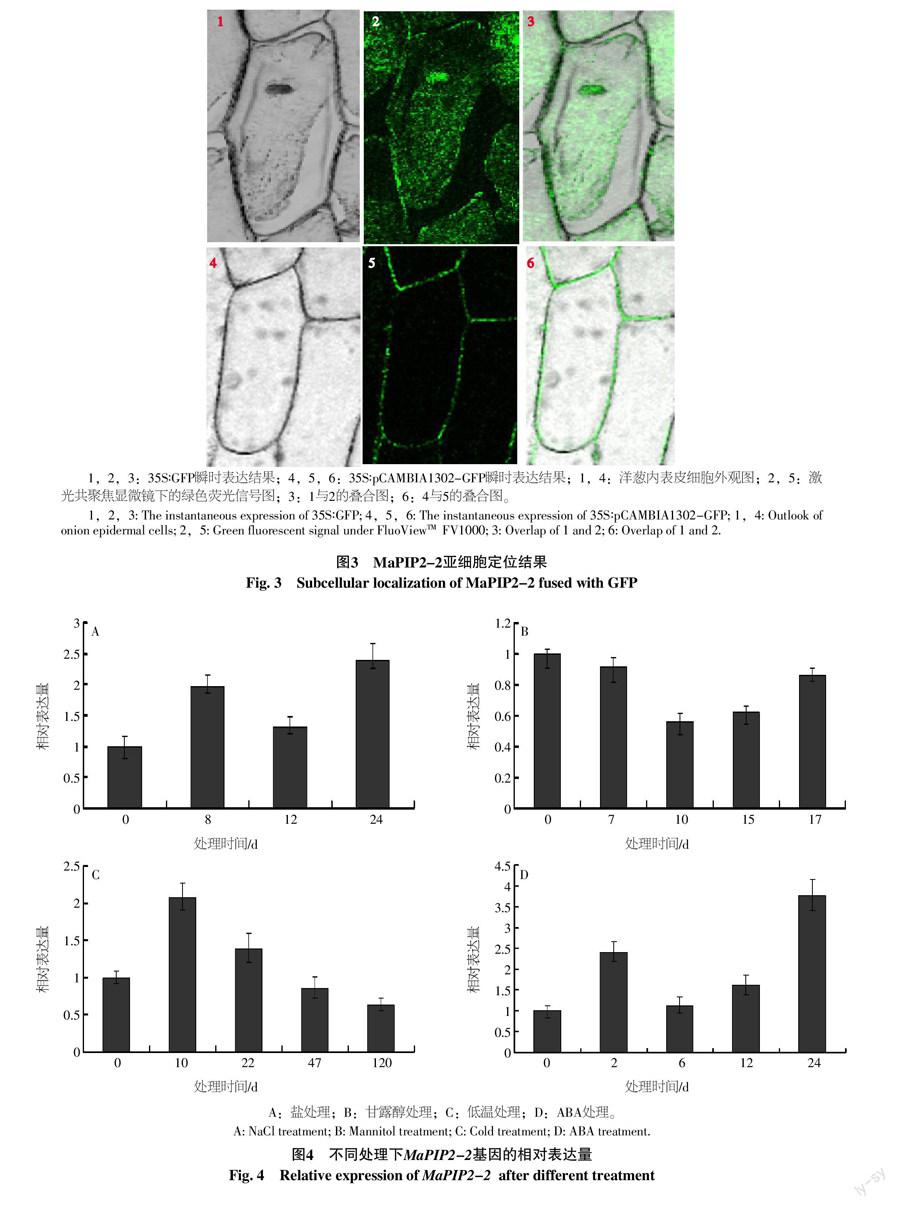
(2)农杆菌法介导的亚细胞定位。利用农杆菌介导的瞬时转化法将pCAMBIA1302-MaPIP2-2-GFP和空载体(pCAMBIA1302-GFP)导入洋葱表皮细胞中[14]。随后将洋葱表皮放在铺有滤纸的MS固体培养基上,25 ℃暗培养16~24 h,然后制作装片,通过FluoViewTM FV1000激光扫描共聚焦显微镜观察荧光信号。
1.2.4 基因表达分析 将生长一致的五叶一心巴西蕉分成4组,将第1组用300 mmol甘露醇(Mannitol)处理7、10、15、17 d;第2组用300 mmol NaCl处理8、12、24、32 d;第3组在8 ℃冷害下培养10、22、47 h,之后将处理47 h的幼苗置于人工气候培养箱中恢复一周;第4组用100 μmol的ABA处理2、6、12、24 h。参照淦国英[15]改良的CTAB法提取每个处理时间点的香蕉叶片RNA,用自带DNA消化酶的cDNA反转录试剂盒反转成cDNA。以反转录的cDNA第一链为模板,用TaRaKa公司的实时荧光定量PCR试剂盒中的SYBR Green、ROX染料进行实时荧光定量PCR扩增,反应在吉泰生物科技有限公司Mx3005P荧光定量PCR仪上进行。以香蕉RPS2基因为内参。定量方法为2-△△CT法:ΔΔCT=(CT, Target-CT, Actin)Timex-(CT, Target-CT, Actin)Time0[16]。设计引物参考TaKaRa实时荧光定量标准说明书。为了保证引物的特异性,引物设计在非翻译区,PCR产物的长度维持在300 bp以内,并进行了测序分析。设计引物完成后(MaPIP2-2-3F:5'-TCGGCTTTGCTGTGTTCA-3';MaPIP2-6-3R:5'-TCAGTTGGTGGGGTTGCT-3';MuRPS2F:5'-TAGGGATTCCGACGATTTGTTT-3';MuRPS2 R:5'-TAGCGTCATCATTGGCTGGGA-3'),送上海生工生物工程有限公司合成。荧光定量PCR的反应程序如下:95 ℃预变性3 min;95 ℃变性10 s,50 ℃退火15 s,72 ℃延伸30 s,循环40次。
2 结果与分析
2.1 MaPIP2-2基因的克隆及生物信息学分析
根据香蕉A基因组测序数据库中的信息,从香蕉栽培品种巴西蕉中克隆到一个AQP家族基因,其ORF为846 bp,编码281个氨基酸。从GenBank中选择拟南芥的全部35个AQP家族成员及笔者所克隆的香蕉AQP基因的氨基酸序列,利用MEGA5.0软件构建系统发育树(图1),结果表明本研究克隆得到的AQP基因所编码的氨基酸序列与AtPIP2-2和AtPIP2-3具有较近的亲缘关系,蛋白序列比对表明它们之间的相似度分别为74.39%和73.68%,故将该基因命名为MaPIP2-2。BLASTX分析表明,MaPIP2-2编码的氨基酸序列与姜花的HcPIP2(AEF32110.1)、海枣PdPIP2-6(XP_008809438.1)、桑树MnPIP2-7(XP010107654.1)、可可TcPIP2-8(XP007041804.1)的氨基酸序列具有较高的一致性,分别为93%、89%、88%和88%(图2)。多序列比对分析表明,MaPIP2-2具有PIP亚家族蛋白的基本特征,其氨基酸序列有6个保守的跨膜螺旋,5个短环,1个高度保守的氨基酸序列‘HINPAVTFG和2个‘NPA元件。这些结果表明本研究克隆的MaPIP2-2为香蕉PIP亚家族的成员(图2)。
2.2 MaPIP2-2蛋白的亚细胞定位分析
以构建的MaPIP2-2基因的植物表达载体pCAMBIA1302-MaPIP2-2-GFP,利用农杆菌介导的瞬时转化法将其和空载体(pCAMBIA1302-GFP)导入洋葱表皮细胞中,对MaPIP2-2蛋白在植物亚细胞结构中的分布进行研究。激光共聚焦显微镜下观察绿色荧光蛋白信号在细胞内的分布,结果显示35S∶GFP绿色荧光蛋白在洋葱表皮细胞的细胞质、细胞核和细胞膜上均有表达,35S∶MaPIP2-2-GFP在洋葱表皮细胞的细胞膜上表达(图3)。这一结果表明MaPIP2-2蛋白定位在细胞膜上。
2.3 MaPIP2-2基因在非生物逆境胁迫及ABA处理下的表达分析
利用实时荧光定量PCR对MaPIP2-2基因在NaCl、甘露醇(Mannitol)、低温、ABA处理下的表达模式分析的结果表明,在NaCl处理下,与对照相比较,MaPIP2-2基因的表达在处理8~24 d显著被诱导了1.3~2.3倍(图4-A)。在甘露醇处理下,与对照相比较,MaPIP2-2基因的表达在处理7~17 d被抑制(图4-B)。在低温处理下,与对照相比较,MaPIP2-2基因的表达在处理10 h被显著诱导了2倍,达到最大值2.076 68,随后逐渐下降(图4-C)。在ABA处理下,MaPIP2-2基因的表达在处理2 h时被显著诱导,随后在处理6 h时却又下降到1.127 14,而在处理6~24 h时逐渐升高并达到最大值3.759 61,与对照相比较,ABA处理下,MaPIP2-2基因整体呈显著诱导趋势(图4-D)。
3 讨论与结论
近年来水通道蛋白(AQP)家族基因的功能已经广泛被报道,但是关于香蕉中水通道蛋白(AQP)家族基因的研究非常有限。本研究从香蕉中克隆了一个AQP基因(MaPIP2-2),该基因编码的氨基酸序列具有AQP家族蛋白的基本特征,与其它物种中AQP家族成员具有较高的一致性,与拟南芥AtPIP2-2和AtPIP2-3具有较近的进化关系。亚细胞定位分析表明,MaPIP2-2定位于细胞膜上,与MaPIP1;1和TaAQP7等AQP基因的细胞定位结果一致[1,18],进一步说明了MaPIP2-2具有PIP蛋白的特征。因此,可以推测本研究所克隆的基因是AQP家族中PIP亚类中的一个成员。
大量的研究表明AQP家族基因能够调节植物体内水分的平衡,保持植物细胞水分稳态,并且能够快速响应环境胁迫,在植物对逆境胁迫的应答中发挥着重要作用。因此,本研究运用实时荧光定量PCR的方法研究了香蕉MaPIP2-2基因在转录水平对甘露醇、低温、高盐和ABA信号的应答。结果表明,在高盐和ABA处理下,MaPIP2-2基因的表达趋势基本一致,均被显著诱导。这一结果与在高盐处理下香蕉MaPIP1;1、小麦TaNIP和TaAQP8基因的表达趋势一致,同时小麦TaNIP、TaAQP8被证实能够增强转基因植株对干旱、高盐和低温胁迫的耐受性[1,18-19];而在ABA处理下的表达趋势与水稻OsPIP1-1、OsPIP1-2、OsPIP2-1、OsPIP2-3、OsPIP2-4和OsPIP2-5的一致,同时水稻OsPIP1-1被证明能够显著提高植物对高盐和干旱的耐受性[20]。这些结果表明一些水通道蛋白家族成员在高盐和ABA处理下发挥着正向调控作用。因此,MaPIP2-2基因可能在植物响应高盐胁迫和ABA信号过程中起着重要作用。
在甘露醇处理下,MaPIP2-2基因的表达被显著抑制。这一结果与Guo等[20]报道的PEG6000处理下水稻叶片中OsPIP2-4和根系中OsPIP1-2,OsPIP1-3,OsPIP2-2的表达趋势一致。在低温处理下,MaPIP2-2基因的表达被早期诱导,表明巴西蕉对低温胁迫的响应较为敏感,在处理初期就能达到最大值。这一结果与Huang等[21]研究的TaAQP7在低温胁迫下的研究结果一致,而TaAQP7在烟草中过表达增强了转基因植株对干旱、高盐和低温胁迫的耐受性[17]。因此,MaPIP2-2基因可能参与了植物对低温和甘露醇的耐受过程。
综上所述,MaPIP2-2基因编码的蛋白具备PIP亚家族蛋白的基本结构特征,是AQP家族中PIP亚类的一个成员。MaPIP2-2基因能够在转录水平响应甘露醇、低温、NaCl和ABA信号,这些结果表明MaPIP2-2能够参与非生物逆境胁迫应答,并在其中发挥重要作用。为进一步研究MaPIP2-2基因的功能奠定了基础。
参考文献
[1] Xu Y, Hu W, Liu J H, et al. A banana aquaporin gene, MaPIP1;1, is involved in tolerance to drought and salt stresses[J]. BMC Plant Biology, 2014, 14(1): 59.
[2] Van Asten P, Fermont A, Taulya G. Drought is a major yield loss factor for rainfed East African highland banana[J]. Agric Water Manage, 2011, 98(4): 541-552.
[3] Sreedharan S, Upendra K S S, Ganpathi T. Transgenic banana plants overexpressing a native plasma membrane aquaporin MusaPIP1;2 display high tolerance levels to different abiotic stresses[J]. Plant Biotechnology Journal, 2013, 11(3): 948.
[4] 刘迪秋, 王继磊, 葛 锋, 等. 植物水通道蛋白生理功能的研究进展[J]. 生物学杂志, 2009, 26(5): 63-66.
[5] 朱美君, 康 蕴, 陈 珈, 等. 植物水通道蛋白及其活性调节[J]. 植物学通报, 1999, 16(1): 44-50.
[6] Vera-Estrella R, Barkla B, Bohnert H J, et al. Novel regulation of aquaporins during osmotic stress[J]. Plant Physiol, 2004, 135(4): 2 318-2 329.
[7] Maurel C, Verdoucq L, Luu D.-T, et al. Plant aquaporins: membrane channels with multiple integrated functions[J]. Annu Rev Plant Biol, 2008(59): 595-624.
[8] 李 军, 乙 引 植物水通道蛋白的运输和调节[J]. 植物生理学通讯, 2010, 46(5): 493-498.
[9] Chaumont F, Barrieu F, Wojcik E, et al. Aquaporins constitute a large and highly divergent protein family in maize[J]. Plant Physiology, 2001(12): 1 206-1 215.
[10] Johansson U, Karlsson M, Johansson I, et al. The complete set of genes encoding major intrinsic proteins in Arabidopsis provides a framework for a new nomenclature for major intrinsic proteins in plants[J]. Plant Physiology, 2001, 126(4): 1 358-1 369.
[11] Johansson U, Karlsson M, Johansson I, et al. The role of aquaporins in cellular and whole plant water balance[J]. BBA-Biomembranes, 2000, 1 465(1-2): 324-342.
[12] Maurel C. Aquaporins and water permeability of plant membranes[J]. Annual Review of Plant Physiology and Plant Molecular Biology, 1997(48): 399-429.
[13] Rivers R L, Dean R M, Chandy G, et al. Functional analysis of nodulin 26, an aquaporin in soybean root nodule symbiosomes[J]. Journal of Biological Chemistry, 1997, 272(26): 16 256-16 261.
[14] 邢文婷. 香蕉MaMYB基因克隆及抗旱功能研究[D]. 海口: 海南大学, 2014.
[15] 淦国英, 漆艳香, 蒲金基, 等. 改良CTAB 法提取高质量香蕉叶片总RNA[J]. 广东农业科学, 2009(7): 192-195.
[16] Liva K J, Schmittgen T D. Analysis of relative gene expression data using real-time quantitative PCR and the 2-ΔΔCt method[J]. Method, 2001, 25(4): 402-408.
[17] Zhou S Y, Hu W, Deng X M, et al. Overexpression of the wheat aquaporin gene, TaAQP7, enhances drought tolerance in transgenic tobacco[J]. Plos One, 2012(7): 1-14.
[18] Gao Z X, He X L, Zhao B C, et al. Overexpressing a putative aquaporin gene from wheat, TaNIP, enhances salt tolerance in transgenic Arabidopsis[J]. Plant Cell Physiol, 2010, 51(5): 767-775.
[19] Hu W, Yuan Q Q, Wang Y, et al. Overexpression of a wheat aquaporin gene, TaAQP8, enhances salt stress tolerance in transgenic tobacco[J]. Plant Cell Physiol, 2012, 53(12): 2 127-2 141.
[20] Guo L, Wang Z Y, Lin H, et al. Expression and functional analysis of the rice plasma-membrane intrinsic protein gene family[J]. Cell Research, 2006, 16(3): 277-286.
[21] Huang C, Zhou S, Hu W, et al The wheat aquaporin gene TaAQP7 confers tolerance to cold stress in transgenic tobacco[J]. Zeitschrift Für Naturforschung Section C-A Journal of Biosciences, 2014, 69(3-4): 142-148.
