枇杷细胞悬浮培养生产熊果酸的调控
2015-05-30李惠华刘小英常强王伟姚德恒苏明华
李惠华 刘小英 常强 王伟 姚德恒 苏明华

摘 要 以枇杷悬浮培养细胞的生长量及熊果酸(UA)的含量为考察指标,从蔗糖浓度、装液量、pH值、接种量、温度、光照强度、摇床转速、激素等开展培养参数的筛选。结果表明:接种量8 g/100 mL,pH6.0,蔗糖30 g/L,25 ℃,白炽灯400 lx,转速130 r/min,装液量130 mL/250 mL,MS+NAA 0.5 mg/L,15 d收获,细胞鲜重是起始的3.577倍,UA含量为34.993 mg/g DW,是自然界枇杷叶的约3.5倍。
关键词 枇杷;熊果酸;细胞悬浮培养
中图分类号 S667.3 文献标识码 A
Abstract Ursolic acid(UA)is an activate component found in loquat and it has high economic value. The traditional UA extraction methods has limitations. A novel approach of producing UA using loquat cell suspension culture technique would have a significant benefit theoretically and practically. Different culture conditions on cell growth and UA accumulation in loquat cells, including sucrose concentration, plant growth regulators, pH, media volume, inoculums quantity, temperature, light intensity and shaking speed were investigated. The results showed that the weight of fresh cell were 3.577 times under optimal protocol after harvesting for 20 days when compared with the initial inoculums, and the UA content obtained reached 34.993 mg/g DW(Dry weight). The optimal protocol was executed by transferring 8 g/100 mL of initial inoculums to a 130 mL liquid medium containing 30 g/L of carbon source, 0.5 mg/L plant hormone 1-Naphthaleneacetic acid(NAA)with pH6.0. Then loquat cell suspension was kept in a 25 ℃ shaker with 400 lx light intensity and shaking at 130 r/min for 15 days. The reulsts would provide foundations for future industrialized extracting UA from loquats in a large scale.
Key words Eriobotrya japonica L.; Ursolic acid; Cell suspension culture
doi 10.3969/j.issn.1000-2561.2015.07.011
枇杷(Eriobotrya japonica L.)为蔷薇科(Rosaceae)枇杷属植物,叶、花、果等都是传统中药,枇杷叶中富含有三萜酸等生物活性物质,其中以熊果酸(Ursolic acid,简称UA)为主要药用成分,被证明具有广泛的生物活性:抗癌[1],抗氧化[2],抗抑郁[3],保护神经[4],治疗糖尿病[5],是高价值的天然药物和化妆品原料。
天然植物中UA的含量低(每克干重植物中含有:枇杷叶9.987 mg,车前3.164 mg,女贞3.401 mg)[6],生产上多以成熟枇杷叶,用有机溶剂提取,存在费时、费力、成本高等局限性[7-9]。因此,开辟新的UA提取途径十分必要。植物细胞悬浮培养途径生产次生代谢产物是目前中药生产中重要的技术路线[5,10-11],悬浮培养的细胞一般不含或少含色素、脂质等,在提取分离方面具有更便捷经济的优势。此外,良好的植物细胞悬浮细胞系也被广泛用于植物生物转化、原生质体融合、细胞代谢、细胞信号转导等研究[10-11]。Ho等[12]通过植物细胞悬浮培养技术调控其总三萜含量,并经过体外小鼠试验表明细胞培养物对糖尿病、高血脂有抑制作用[13]。但UA作为生产上枇杷叶提取加工中最重要的目标产物,以枇杷UA为目标产物进行细胞悬浮培养,有针对性地研究枇杷细胞悬浮培养参数与UA产量的关系少见报道。本研究拟在已有枇杷适合悬浮培养愈伤组织的基础上[14],开展细胞培养生产枇杷UA的研究。对蔗糖浓度、装液量、pH值、接种量、温度、光照强度、摇床转速、激素等培养参数进行筛选,尽可能提高UA的含量,为今后枇杷细胞悬浮培养提取UA规模化生产奠定基础,同时也为枇杷UA的调控机理研究提供参考。
1 材料与方法
1.1 材料
适合枇杷细胞悬浮培养的愈伤组织建立自早钟6号幼胚,具体方法参见文献[14]。将上述愈伤组织转入液体培养,于100 mL培养液/250 mL容量的三角锥瓶中,以MS培养液附加2,4-D(2,4-Dichlorophenoxyacetic acid,2,4-二氯苯氧乙酸)1 mg/L,KT(6-Furfurylamino-purine,6-糠基氨基嘌呤)0.5 mg/L,蔗糖2%,pH5.8,转速110 r/min,黑暗培养,长期继代保存,作为试验材料。
1.2 方法
1.2.1 试验起始材料的制备 每次试验的起始材料,在适合的灭菌容器中充分混匀,用移液器吸取适量体积的混合材料加入到培养液中。
1.2.2 培养条件的筛选 为了确定最佳的培养条件及参数,以1.1中培养液及培养条件为初始,顺序进行了蔗糖浓度、装液量、pH值、接种量、培养温度、光照强度、摇床转速、激素(生长素、分裂素、生长素与分裂素的组合)的不同梯度试验,前一个因子的梯度试验确定的最佳参数应用到后一个因子的梯度试验中。浓度范围通过预试验得以确定。①蔗糖的浓度梯度为10、15、20、25、30、35 g/L,对照为20 g/L。②装液量:250 mL的三角锥瓶分别装入40、70、100、130、160、190 mL的培养液(新培养液与起始接入的培养材料的比例为1 ∶ 1,即确保试验处理的细胞浓度是均一的),对照为100 mL。③pH值:4.0、4.5、5.0、5.5、6.0、6.5,对照为5.8。④接种量:每100 mL中分别为2、4、6、8、10、12 g。⑤温度:15、20、25、30、35、40 ℃,对照为25 ℃。⑥白炽灯光强设为0、400、1 000、2 000、4 000 lx,对照为0 lx。⑦往复式摇床转速:50、70、90、110、130、150、170 r/min,对照为110 r/min。⑧生长素2,4-D、NAA(1-naphthlcetic acid,a-萘乙酸)、IBA(Indole-3-Butytric acid,3-吲哚丁酸)设为0.5、1.0、2.0、4.0、6.0 mg/L,分裂素6-BA(6-Benzylaminopurine,6-苄氨基腺嘌呤)、KT设为0、0.25、0.5、1.0、2.0、4.0 mg/L,对照为不添加激素。⑨在⑧中筛选到的生长素NAA和分裂素KT,梯度组合:NAA 0.5、1.0、2.0 mg/L与KT 2.0 、4.0、6.0 mg/L分别组合,共9个组合,对照为不添加激素。
1.2.3 项目测定 细胞生长的测定:培养材料过滤收集,并用滤纸吸干水份,测定鲜重。考察指标:鲜重生长倍数=收获时100 mL细胞鲜重/起始100 mL材料的鲜重。
UA的提取及测定:测量完鲜重的细胞于50 ℃烘箱干燥至恒重,超声波提取,高效液相色谱测定,标样购自中国食品药品检定研究院,批号110742-201220。
收获UA总量测定:(细胞鲜重/10)g×UA的含量mg/g DW,10为细胞鲜重与干重的折算系数,由预试验确定。
1.3 数据处理与分析
每个试验3次生物学重复。数据采用SPSS18.0软件进行生统分析。试验数据用Duncan法进行多重比较,表示为3次重复的平均值±SE。
2 结果与分析
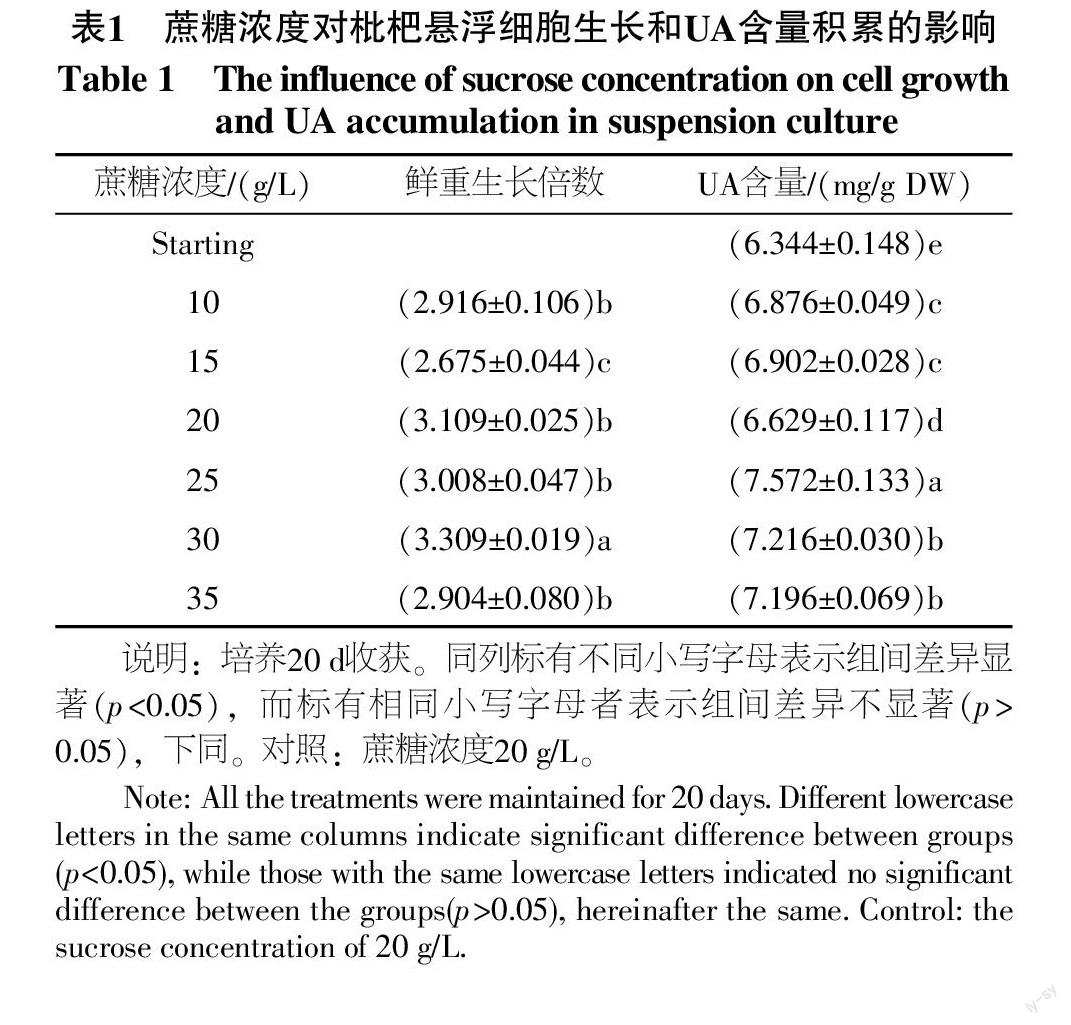
2.1 蔗糖浓度对悬浮培养中细胞生长量及UA累积的影响
蔗糖属于碳源的一种。在固体培养的枇杷愈伤组织偏好蔗糖[15-18],在此基础上,本试验着重确定适合枇杷细胞悬浮培养的蔗糖浓度,结果见表1。培养3 d,10 g/L的处理首先发生褐变,培养5 d,15 g/L的处理发生褐变,可见较低浓度的蔗糖浓度不能满足细胞快速分裂生长的需求。30 g/L的处理鲜重是起始的3.309倍,显著高于其他处理,最适宜枇杷悬浮细胞的分裂增殖。同时,25 g/L时UA含量最高,是初始材料的1.194倍,是对照的1.142倍,与其他处理UA含量的差异显著。其次为35、30 g/L,此两者之间无显著性差异。综上,以收获的UA总量及培养液蔗糖成本考虑,30 g/L为最佳蔗糖浓度。
2.2 装液量对悬浮培养中细胞生长量及UA累积的影响
装液量对悬浮培养中细胞生长量及UA累积的影响见表2,100 mL处理,鲜重生长倍数最大,为最初鲜重的4.091倍,最适宜枇杷悬浮细胞的增殖。液体量太少(40 mL),细胞生长空间有限,液体量太多(160、190 mL),培养液无法保持一定的振幅,影响细胞养分的传导及溶氧,均不适宜枇杷悬浮细胞的增殖。UA含量,装液量100 mL是最低的,装液量40、130 mL时为较佳。以总收获UA总量为衡量指标,130 mL/250 mL为最佳的装液量体积。
2.3 pH值对悬浮培养中细胞生长量及UA累积的影响
pH值对悬浮培养中细胞生长量及UA累积的影响见表3,鲜重的生长倍数在pH6.0达到最大值,是起始材料的3.617倍,与对照pH5.8(液体继代培养的pH)没有显著性差异,与其他处理有显著性差异。而在pH4.0、4.5及6.5时,细胞生长较差,可知弱酸性培养液较适宜枇杷细胞的生长。UA的累积,在pH4.0~6.5区间均呈现了下降-上升-下降的趋势,pH6.0时,UA含量为最高值,也最适合细胞生长。pH4.0时,UA的含量也较高,UA在植物中主要是以游离态或糖苷键的形式存在[19],可能在一定的酸性条件下有利于糖苷键的分解。综上,pH6.0为最适的pH值,此时细胞增殖快,UA含量最高。
2.4 接种量对悬浮培养中细胞生长量及UA累积的影响
接种量对悬浮培养中细胞生长量及UA累积的影响见表4,在考察接种量的影响时,当接种量太小的时候(2 g),悬浮细胞活力较低,生长缓慢。接种量过大时(12 g),细胞由于生长空间有限、营养物质供给不足,72 h出现褐化现象,在悬浮培养后期大量死亡。接种量为4、6、8 g时,鲜重生长倍数较高,这3个处理之间不存在显著差异,与其他处理均存在显著性差异;接种量为8、12 g时,UA含量为试验中较佳,这2个处理之间无显著差异,与其他处理均存在显著性差异。细胞的生长与UA的累积并不一致,接种量为12 g的处理,72 h褐变明显,在收获期细胞大量死亡,但UA的累积却是最高的。综上,试验结果表明8 g/100 mL的接种量最适宜枇杷细胞悬浮培养,细胞增殖最快,UA含量最高。
2.5 培养温度对悬浮培养中细胞生长量及UA累积的影响
培养温度对悬浮培养中细胞生长量及UA累积的影响见表5,温度40 ℃时,枇杷悬浮细胞受到严重的热胁迫,48 h内,枇杷悬浮细胞由嫩黄色转为褐色且死亡,在温度15 ℃到温度35 ℃区间内,枇杷悬浮细胞较起始对照均有增长,25 ℃时达到最大的生长量,为起始材料的6.081倍,与其他处理有显著的差异;20、30 ℃细胞的生长情况次之,两者之间没有显著性差异。UA含量在35、15 ℃出现较高值,分别为对照的1.710倍和1.629倍,20~30 ℃之间,UA含量均高于对照,20、25 ℃两处理间,UA的含量没有显著差异。以总收获的UA质量为衡量标准,枇杷细胞悬浮培养最适宜的温度为25 ℃。
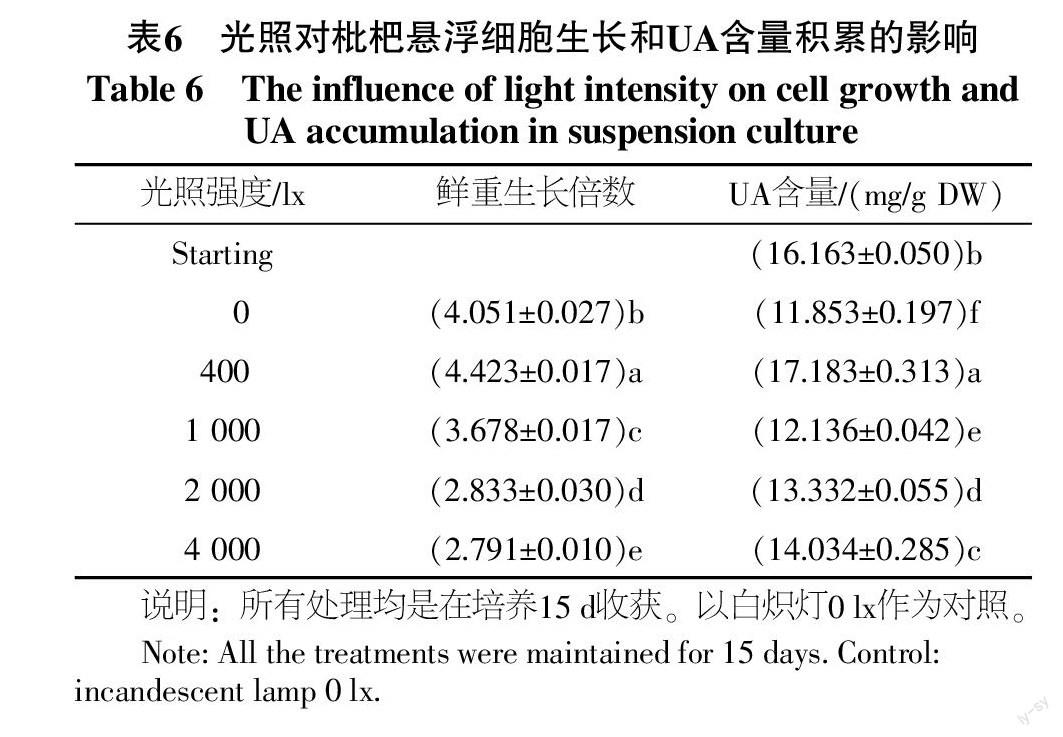
2.6 光照强度对悬浮培养中细胞生长量及UA累积的影响
光照强度对悬浮培养中细胞生长量及UA累积的影响,以白炽灯光照强度作为考察因子,光照强度对鲜重生长倍数的影响呈现先上升后下降的趋势(见表6)。光照4 000 lx时最不适宜细胞的增殖及UA的积累。光照强度为400 lx时,枇杷悬浮细胞的鲜重生长倍数、UA含量最高,分别为起始的4.423倍、1.063倍,与其他处理差异显著。因而白炽灯光照强度400 lx最适宜枇杷细胞悬浮培养UA的积累。
2.7 摇床转速对悬浮培养中细胞生长量及UA累积的影响
摇床转速对悬浮培养中细胞生长量及UA累积的影响见表7,鲜重生长倍数及UA含量在130 r/min时均达到了最大值,此时细胞增殖速度最快,为起始细胞的6.180倍,UA含量为对照的1.138倍。50、70 r/min不适宜枇杷悬浮细胞的生长,转速过低,细胞内通气状态差导致细胞贴壁现象严重,部分细胞死亡,细胞鲜重生长情况不及对照。150、170 r/min时,细胞受强大的剪切力作用,细胞部分破碎,也不利于细胞的增殖。转速50 r/min时,细胞生长状态最差,UA含量的积累却仅次于最佳转速时期(130 r/min)。综上,枇杷细胞悬浮培养应以转速130 r/min最适宜。
2.8 激素对悬浮培养中细胞生长量及UA累积的影响
2.8.1 生长素对悬浮培养中细胞生长量及UA累积的影响 考察生长素对悬浮培养中细胞生长量及UA累积的影响见表8,与起始材料相比,处理后细胞生长倍数及UA含量生长倍数分别为(Naphthaleneacetic acid,NAA 3.742倍,4.014倍;2,4-D 2.332倍,1.486倍;IBA 1.427倍,1.196倍),与对照相比,(NAA 3.994倍,3.304倍;2,4-D 2.332倍,1.218倍;IBA 1.534倍,0.982倍)。生长素的处理使起始材料有一定的增长及UA的累积,生长素种类的效果NAA>2,4-D>IBA。
随NAA浓度的增加,枇杷悬浮细胞的生长呈现先上升后下降的趋势,收获时细胞的生长均达到起始材料的3.5倍以上,NAA1.0,NAA2.0,NAA4.0枇杷细胞增殖速度较快,3个处理间没有显著性差异,NAA6.0时细胞生长速度次之,NAA0.5再次之,但总体差距不大。而NAA浓度对UA含量的影响较大,随着NAA浓度的增加,基本呈现出下降的趋势,以NAA0.5最适宜UA的积累,是对照的3.964倍,与其他处理存在显著差异。
随着2,4-D添加浓度的增加,枇杷悬浮细胞的鲜重生长倍数逐渐降低,可见低浓度的2,4-D较适宜枇杷悬浮细胞的培养。UA含量的积累,在2,4-D0.5-4.0时,UA含量逐渐下降,2,4-D4.0 UA含量低于对照,但在2,4-D6.0时,UA含量又出现一定幅度增长。
IBA不适宜枇杷细胞悬浮培养,培养液整体较灰暗。从表8可知,随着IBA浓度的增加,细胞生长倍数也相应增加,IBA6.0的细胞生长倍数最大,为初始的1.678倍,但效果不如2,4-D及NAA,远小于NAA2.0(3.809倍),IBA1.0的UA含量最高,仅是初始的1.245倍,远小于NAA0.5的4.829倍。因而,IBA是试验中最不适宜枇杷细胞悬浮培养的生长素。
综上,3种生长素对枇杷细胞悬浮培养鲜重生长影响和UA含量的影响并不一致,从获得UA总量角度考虑,NAA0.5为最适宜的枇杷细胞悬浮培养所需的生长素浓度。
2.8.2 分裂素对悬浮培养中细胞生长量及UA累积的影响 分裂素对悬浮培养中细胞生长量及UA累积的影响见表9,与起始材料相比,处理后细胞生长倍数及UA含量生长倍数分别为(BA 1.158倍,1.932倍;KT 1.557倍,3.123倍),与对照相比为(BA 1.227倍,2.374倍;KT 1.649倍,3.838倍),分裂素的处理使起始材料有一定的生长和UA的累积,分裂素种类效果为KT>BA。
枇杷细胞鲜重生长倍数随着KT浓度的增大而增加,各处理显著高于对照,KT4.0时,枇杷细胞悬浮增殖最快,是对照的1.936倍。UA的含量,随KT浓度变化,含量先小幅下降而后逐渐增大,各处理均显著高于对照及起始材料。KT4.0时,达到最大值,即分别为初始材料及对照的3.526倍、4.333倍。因而,高浓度的分裂素KT较适用于枇杷细胞悬浮培养。是否超出试验范围的更高的KT浓度更适合,本试验中有进一步的激素组合及激素横向比较分析。
枇杷悬浮细胞的生长随着BA浓度的增大而增加,在BA浓度为0.25~0.5 mg/L较低范围,细胞的鲜重较起始材料有所下降,与对照相比没有显著性差异。在浓度1.0 mg/L以上时,细胞开始增殖,在本试验范围内,以BA4.0的增殖速度最快,为处理前的1.565倍,是对照的1.605倍。UA含量以BA1.0为较佳,在此浓度下,UA含量分别为处理前的2.083倍,为对照的2.177倍,与BA其他浓度处理差异显著。
2.8.3 生长素与分裂素组合对悬浮培养中细胞生长量及UA累积的影响 在激素单因子试验中筛选到的生长素NAA最适浓度0.5,分裂素KT最适浓度4.0,在此基础上进行组合试验,试验组合及结果见表10。各处理的细胞鲜重生长倍数和UA含量均显著高于对照,但UA含量仅有处理NAA0.5/KT2.0显著高于起始材料。当NAA浓度为0.5、2.0 mg/L时,枇杷鲜重生长倍数无较大差异;NAA浓度为1.0时, 2.0 mg/L的处理细胞鲜重明显高于4.0、6.0 mg/L。在NAA浓度一定时(即NAA0.5、NAA1.0、NAA2.0),UA的含量随着KT浓度的增加而下降。综上, NAA1.0/KT2.0为最适宜枇杷细胞悬浮培养及UA累积。
以收获的UA总量为衡量标准,横向比较激素对细胞生长及UA累积的影响的表8~10发现,NAA0.5>2,4-D0.5>NAA1.0/KT2.0。因而,激素单独作用效果明显优于激素组合。
3 讨论与结论
3.1 悬浮胁迫培养与次生代谢物含量
在本研究中,胁迫产生后一般出现细胞鲜重生长倍数降低即细胞生长减缓,UA含量增加现象。如考察接种量与UA含量联系时,接种量12 g时,72 h褐变明显,在收获期细胞大量死亡,但UA含量却是最高;考察装液量与UA含量联系时,装液量40 mL较佳,但此处理的细胞生长情况仅中等水平;自然状态下,枇杷植株的最适合生长温度为25 ℃,年均温度15 ℃以上能生长,35 ℃以上容易产生日灼伤害,考察温度与UA含量联系时,UA含量在35、15 ℃出现较高值;在考察转速时,转速50 r/min的处理细胞生长状态最差,UA含量的积累却仅次于最佳转速时期(130 r/min)。可能由于生长空间有限、营养物质供给不足,细胞处于类似胁迫状态,此时的次生代谢途径大量开启,UA增加累积以更好地适应环境。
在其他研究中也有类似报道。如:在非最适生长温度下,玉米向光面的叶片中积累花青素,以避免光抑制造成的伤害[20]。渗透胁迫下多种植物在体内积累渗透调节物质甜菜碱[21]。茉莉酸甲酯和水杨酸诱导的氧胁迫增加了人参根细胞悬浮液中酚的含量[22]。
今后,可在本研究的基础上,于枇杷细胞的对数生长期的中期或后期(当细胞增长到一定的程度),适时设计适度的胁迫促进目标产物UA的累积,如低温15 ℃或高温35 ℃;低转速50 r/min;高浓度的CO2等。同时UA属于五环三萜化合物,此类化合物在生物体内的代谢途径也已有一定的研究,进行胁迫与UA研究时可以同时关注代谢途径中的关键性的酶,进行相关机理的探索。
3.2 培养因子与次生代谢物含量
本研究顺序考察了蔗糖浓度、装液量、pH值、接种量、培养温度、光照强度、摇床转速、激素对枇杷悬浮细胞生长及UA含量的影响,在确定前一个因子的最佳水平后应用到后一因子的试验中,由此逐步获得各个影响因子的最佳值,经调控UA含量逐渐升高,最终平均值为23.609 mg/g DW(所有激素处理样品的平均值),为所有因子中最高,但不加激素的对照UA的含量仅为8.181 mg/g DW。由此可以看出,激素是所涉及试验因子中最重要的因子,且激素单独使用的效果好于激素组合。
激素对植物细胞的生长和代谢产物的形成具有特殊的调节作用[23-25]。Villarreal等[26]发现多裂水茄细胞在含有2 mg/L 2,4-D和2 mg/L KT 的培养基中培养20 d后,皂角苷含量达到14 mg/g,是自然植株的50倍。本研究中激素的调控效果最好,但单独使用时,NAA 0.5> 2,4-D 0.5>激素组合NAA1.0/KT2.0。考虑到植物激素之间存在拮抗作用[27],在设计试验时不要忽略单激素使用效果可能优于激素组合。
3.3 培养因子调控的效果及意义
枇杷叶UA含量相对其他植物较高[6],因此生产中也是采用枇杷叶片提取UA。通过本试验枇杷细胞的悬浮培养,其最佳调控为:接种量8 g/100 mL,pH6.0,碳源浓度30 g/L,温度25 ℃,白炽灯400 lx,转速130 r/min,装液量130 mL/250 mL,MS培养液中添加NAA 0.5 mg/L。15 d收获时,细胞的鲜重生长倍数达到起始材料的3.577倍,每克干重UA的含量为34.993 mg,是自然生长的枇杷叶的约3.5倍。
Ho等[12]在枇杷细胞悬浮培养调控三萜类化合物的研究中表明:在MS培养基中添加2.5 mg/L 6-BA,1 mg/L NAA和30 g/L蔗糖,(25±2)℃黑暗培养30 d,总三萜含量为(151.54±12.58)mg/g DW,其中UA的含量是15.56 mg/g DW。本研究侧重于其中一种三萜类化合物——UA,培养参数与Ho等[12]在光照强度,调控激素的种类上有较大的区别:弱光更适合UA的累积,单激素低剂量的调控优于激素的组合,同时UA的含量是Ho等[12]UA含量的2.25倍。鉴于研究目的是收集次生代谢产物,在优先考虑细胞生长佳及次生产物收获量大基础上,本着对产物安全性的考虑,本研究在激素的选择上以单个激素更小剂量更具优势。同时为今后通过枇杷细胞悬浮培养规模化生产UA提供参考,为UA调控机制的研究奠定基础。
参考文献
[1] YU Y X, GU Z L, YIN J L, et al. Ursolic acid induces human hepatoma cell line SMMC-7721 apoptosis via p53-dependent pathway[J]. Chin Med J, 2010, 123: 1 915-1 923.
[2] Shih-Jei Tsai, M-C Yin. Antioxidative and anti-inflammatory protection of oleanolic acid and ursolic acid in PC12 cells[J]. J Food Sci, 2008, 73(7): 174-178.
[3] Machado D G, Neis V B, Balen G O, et al. Antidepressant-like effect of ursolic acid isolated from Rosmarinus officinalis L. in mice: evidence for the involvement of the dopaminergic system[J]. Pharmacol Biochem Behav, 2012, 103(2): 204-211.
[4] Lu J, Zheng Y L, Wu D M, et al. Ursolic acid ameliorates cognition deficits and attenuates oxidative damage in the brain of senescent mice induced by D-galactose[J]. Biochem Pharmacol, 2007, 74(7): 1 078-1 090.
[5] Jang S M, Yee S T, Choi J, et al. Ursolic acid enhances the cellular immune system and pancreatic beta-cell function in streptozotocin-induced diabetic mice fed a high-fat diet[J]. Intimmuno Pharma Col, 2009, 9(1): 113-119.
[6] 相延英, 杨 光. 常用中药中齐墩果酸和熊果酸的含量测定[J]. 中国医院药学杂志, 2004, 24(5): 316-318.
[7] 吴 梨, 赵 伟, 杨瑞金. 从枇杷叶中分离提取熊果酸的研究进展[J]. 北京工商大学学报(自然科学版), 2011, 29(6): 50-53.
[8] 付红军, 彭湘莲. 枇杷叶中熊果酸的索氏提取工艺优化[J]. 食品与机械, 2011, 27(2): 59-61.
[9] 张 静, 刘 艺, 殷 飞,等.枇杷叶中熊果酸的提取工艺研究[J]. 食品工业, 2007(3): 22-24.
[10] Georgiev M I, Weber J, Maciuk A. Bioprocessing of plant cell cultures for mass production of targeted compounds[J]. Appl Microbiol Biotechnol, 2009, 83: 809-823.
[11] Mustafa N R, Winter W, Iren F, et al. Initiation, growth and cryopreservation of plant cell suspension cultures[J]. Nature Protocols, 2011, 6(6): 715-742.
[12] Ho H Y, Liang K Y, Lin W C, et al. Regulation and improvement of triterpene formation in plant cultured cells of Eriobotrya japonica Lindl[J]. Journal of Bioscience and Bioengineering, 2010, 110(5): 588-592.
[13] Shih C C, Ciou J L, Lin C H, et al. Cell suspension culture of Eriobotrya japonica regulates the diabetic and hyperlipidemic sign of high-fat-fed mice[J]. Molecules, 2013, 18: 2 726-2 753.
[14] 李惠华, 刘小英, 王 伟, 等. 适合于悬浮培养的枇杷愈伤组织的诱导及状态调控[J]. 亚热带植物科学, 2013, 42(4): 309-313.
[15] 王家福, 刘月学. 枇杷胚性愈伤组织的诱导和保存[J]. 福建农业大学学报, 2000, 29(3): 305-310.
[16] 彭晓军, 王永清. 枇杷胚乳愈伤组织诱导和不定芽发生的研究[J]. 四川农业大学学报, 2002, 20(3): 228-231.
[17] 王 芳, 吕洪飞, 徐红霞, 等. 枇杷幼叶组织培养与植株再生研究[J]. 生物技术通讯, 2011, 22(1): 53-56.
[18] Li J, Wang Y, Lin L, et al. Embryogenesis and plant regeneration from anther culture in loquat(Eriobotrya japonica L.)[J]. Scientia Horticulturae, 2008, 115: 329-336.
[19] 陈 武, 熊筱娟, 李开泉, 等. 乌索酸的化学、 药理及临床研究[J]. 宜春医专学报, 2001, 13(2): 123-126.
[20] Pietrini F, Iannelli M A, Massacci A. Anthocyan in accumulation in the illuminated surface of maize leaves enhances protection from photo-inhibitory risk s at low temperature, without further limitation to photosynthesis[J]. Plant Cell and Environment, 2002, 25: 1 251-1 259.
[21] Reda E A Moghaieb, Hirofumi Saneoka, Kounosuke Fujita. Effect of salinity on osmotic adjustment, glycinebetaine accumulation and the betaine aldehyde dehydrogenase gene expression in two halophytic plants, Salicornia europaea and Suaeda maritima[J]. Plant Science, 2004, 166(5): 1 345-1 349.
[22] Ali M B, Hahn E J, Paek K Y. Methyl jasmonate and salicylic acid induced oxidative stress and accumulation of phenolics in Panax ginseng bioreactor root suspension cultures[J]. Molecules, 2007, 12(3): 607-621.
[23] Maheshwari P, Songara B, Kumar S, et al. Alkaloid production in Vernonia cinerea: Callus, cell suspension and root cultures[J]. Biotechnol J, 2007, 2(8): 1 026-1 032.
[24] Zlenko V A, Kotikov I K, Troshin L P. Efficient GA3-assisted plant regeneration from cell suspensions of three grape genotypes via somatic embryogenesis. Plant Cell[J]. Tissue and Organ Culture, 2002, 70: 295-299.
[25] Vanildo Silveira, Eny Iochevet Segal Floh, Walter H, et al. Effect of plant growth regulators on the cellular growth and levels of intracellular protein, starch and polyamines in embryogenic suspension cultures of Pinus taeda[J]. Plant Cell, Tissue and Organ Culture, 2004, 76(1): 53-60.
[26] Villarreal M L, Arias C, Feria-Velasco A, et al. Cell suspension culture of Solanum chrysotrichum(Schldl.)-A Plant producing an Antifungal Spirostanol Sapon[J]. Plant Cell Tissueand Organ Culture, 1997, 50: 39-44.
[27] Steber C M, McCourt P. A Role for brassinosteroids in germination in Arabidopsis[J]. American Society of Plant Physiologists, 2001, 125: 763-769.
