秦皮提取物中香豆素类成分含量测定方法研究
2015-05-30叶迎等
叶迎等

摘要:目的 分别建立秦皮提取物总香豆素和4种主要香豆素成分紫外分光光度法(UV)和高效液相色谱法(HPLC)含量测定方法。方法 采用UV,以秦皮甲素为对照品,在334 nm测定秦皮提取物总香豆素的含量;采用HPLC,用Agilent ZORBAX SB-C18色谱柱(4.6 mm×250 mm,5 μm),以乙腈-0.01%磷酸溶液为流动相梯度洗脱,在334 nm测定秦皮提取物中秦皮甲素、秦皮苷、秦皮乙素、秦皮素4种主要香豆素成分的含量。结果 秦皮甲素的质量浓度在5.76~23.04 μg/mL范围内线性关系良好(r=0.999 9),平均回收率为100.6%(RSD=1.8%);4种香豆素成分秦皮甲素、秦皮苷、秦皮乙素、秦皮素的质量分别在0.055 0~3.850 0 μg(r=0.999 7)、0.053 9~3.773 0 μg(r=0.999 8)、0.060 0~0.660 0 μg(r=0.999 9)、0.056 2~0.618 2 μg(r=0.999 9)范围内线性关系良好,平均回收率分别为96.97%(RSD=1.26%)、100.80%(RSD=2.22%)、99.04%(RSD=2.47%)、98.77% (RSD=1.94%)。结论 2种含量测定方法简便、准确、可靠,可用于秦皮提取物总香豆素和主要香豆素成分的质量控制。
关键词:秦皮提取物;香豆素;紫外分光光度法;高效液相色谱法;含量测定
DOI:10.3969/j.issn.1005-5304.2015.08.023
中图分类号:R284.1 文献标识码:A 文章编号:1005-5304(2015)08-0083-05
Study on Content Determination of Coumarin in Fraxini Cortex Extract YE Ying1, BAI Dong1, BAO Qiang2, WANG Rui-hai1, LIU Li-mei1 (1.Institute of Basic Theory Research of TCM, China Academy of Chinese Medical Sciences, Beijing 100700, China;2.Gansu Province Hospital of TCM, Lanzhou 730050, China)
Abstract:Objective To establish a UV spectrophotometry method and an HPLC method respectively for the determination of the total content of coumarin and contents of four main constituents of coumarin in Fraxini Cortex extract. Methods UV spectrophotometry was used for the determination of the content of total coumarin in Fraxini Cortex extract. The reference substance was Aesculin, and the maximum ultraviolet absorption wavelength was 334 nm. The HPLC method was used to determine the contents of Aesculin, Fraxin, Aesculetin and Fraxetin in Fraxini Cortex extract, using gradient elution with acetonitrile-phosphate solution (0.01%) as mobile phase on Agilent ZORBAX SB-C18 chromatographic column (4.6 mm × 250 mm, 5 μm) at room temperature. Results For the UV method, the linear range of the mass concentration of Aesculin was 5.76-23.04 μg/mL (r=0.999 9), and the average recovery was 100.6% (RSD=1.8%). For the HPLC method, the linear ranges of the mass of Aesculin, Fraxin, Aesculetin and Fraxetin were 0.055 0-3.850 0 μg (r=0.9997), 0.053 9-3.773 0 μg (r=0.999 8), 0.060 0-0.660 0 μg (r=0.999 9), and 0.056 2-0.618 2 μg (r=0.999 9), respectively, and the average recoveries were 96.97% (RSD=1.26%), 100.80% (RSD=2.22%), 99.04% (RSD=2.47%), and 98.77% (RSD=1.94%), respectively. Conclusion Both of the two methods are simple, accurate and reliable, and can be used for the quality control of total coumarin and the main constituents of coumarin in Fraxini Cortex extract.
Key words:Fraxini Cortex extract;coumarin;UV spectrophotometry;HPLC;content determination
基金项目:中国中医科学院基本科研业务费自主选题项目(YZ-1411)
通讯作者:刘丽梅,E-mail:liulimeihrb@sina.com
秦皮,《神农本草经》将其列为上品。2010年版《中华人民共和国药典》规定秦皮为木犀科植物苦枥白蜡树Fraxinus rhynchophylla Hance、白蜡树F.chinensis Roxb.、尖叶白蜡树F.szaboana Lingelsh.或宿柱白蜡树F.stylosa Lingelsh.的干燥枝皮或干皮。研究表明,秦皮的主要有效成分为香豆素类化合物[1]。药理研究发现,秦皮提取物能够保护小鼠急性肝损伤[2],对辐射所致脂质过氧化反应有明显的抑制作用[3],对大鼠实验性脂肪肝有一定治疗作用[4]。目前对于秦皮药材中香豆素类成分的含量测定方法已有报道[5-6],而秦皮提取物中总香豆素和主要香豆素成分含量测定方法未见报道。本实验室从秦皮药材中提取分离出6种香豆素类成分[7-9],其中秦皮甲素、秦皮苷、秦皮乙素、秦皮素含量较高[10]。为此,本研究分别采用紫外分光光度法(UV)和高效液相色谱法(HPLC),以秦皮总香豆素和4种主要香豆素成分为质量控制指标,建立秦皮提取物含量测定方法,为秦皮的深入研究开发奠定基础。
1 仪器与试药
Agilent 1100高效液相色谱仪(美国安捷伦), Agilent ZORBAX SB-C18色谱柱(4.6 mm×250 mm,5 ?m,美国安捷伦),8453紫外-可见分光光度计(美国安捷伦),CX-250超声波清洗机(天海双龙医疗设备有限公司),CP2202S电子天平(瑞士梅特勒-托利多)。
秦皮提取物为中国中医科学院中医基础理论研究所中药分析实验室自制,分别为苦枥白蜡树枝皮采用75%乙醇提取的醇提取物,以及水煎煮提取的水提取物。秦皮甲素、秦皮乙素对照品购自中国食品药品检定研究院,批号分别为110741-200506、110740- 200104;秦皮苷(HPLC纯度>98%)、秦皮素(HPLC纯度>98%)为中国中医科学院中医基础理论研究所中药分析实验室自制。乙腈为色谱纯(Fisher公司),其他试剂为分析纯,水为纯净水。
2 方法与结果
2.1 总香豆素含量测定
2.1.1 对照品溶液的制备 精密称取秦皮甲素对照品1.44 mg,置于5 mL量瓶中,加甲醇溶解并稀释至刻度,摇匀,即得浓度为288 μg/mL的对照品溶液。
2.1.2 供试品溶液的制备 取秦皮醇提取物10 mg,精密称定,置锥形瓶中,精密加甲醇10 mL,密塞,称定质量,超声处理(功率250 W,频率200 Hz)30 min,放冷,再称定质量,用甲醇补足减失的质量,摇匀,过滤,精密量取续滤液1.0 mL,置于10 mL量瓶中,加甲醇溶解并稀释至刻度,摇匀,即得。
2.1.3 测定波长的选择 取秦皮甲素对照品溶液和“2.1.2”项下供试品溶液,以甲醇为空白,按2010年版《中华人民共和国药典》(一部)分光光度法,在200~500 nm进行扫描,光谱图见图1。由图可见,对照品溶液和供试品溶液在334 nm处均有最大吸收,故选择334 nm作为测定波长。
A
B
注:A.对照品;B.供试品
图1 秦皮提取物及秦皮甲素光谱图
2.1.4 标准曲线的制备 精密量取“2.1.1”项下秦皮甲素对照品溶液0.20、0.35、0.50、0.65、0.80 mL,分别置于10 mL量瓶中,加甲醇溶解并稀释至刻度,摇匀,以甲醇为空白,按2010年版《中华人民共和国药典》(一部)分光光度法,在334 nm波长处测定吸光度,结果分别为0.211、0.365、0.531、0.686、0.857。以吸光度为纵坐标,秦皮甲素浓度(μg/mL)为横坐标,绘制标准曲线,得回归方程A=0.037 3C-0.007 7, r=0.999 9(n=5),表明秦皮甲素在5.76~23.04 μg/mL范围内线性关系良好。
2.1.5 精密度考察 精密量取“2.1.4”项下对照品溶液(14.40 μg/mL),以甲醇为空白,按2010年版《中华人民共和国药典》(一部)分光光度法,在334 nm波长处测定吸光度,连续测定6次,结果分别为0.548、0.535、0.522、0.535、0.539、0.532。对照品溶液在334 nm处吸光度平均值为0.535,RSD=1.6%(n=6),说明仪器精密度良好。
2.1.6 稳定性考察 精密称定秦皮醇提物10.01 mg,按“2.1.2”项下方法制备供试品溶液。以甲醇为空白,按2010年版《中华人民共和国药典》(一部)分光光度法,分别于0、2、4、6、8 h在334 nm波长处测定吸收度,结果分别为0.398、0.405、0.392、0.394、0.406。供试品溶液在334 nm处吸光度平均值为0.399, RSD=1.6%,说明供试品溶液8 h内稳定性良好。
2.1.7 重复性考察 取同一批次的秦皮醇提取物样品约10 mg,共6份,精密称定,按“2.1.2”项下方法制备供试品溶液,以甲醇为空白,按2010年版《中华人民共和国药典》(一部)分光光度法,在334 nm波长下测定吸光度,结果分别为0.421、0.409、0.412、0.394、0.399、0.413,RSD=1.5%(n=6),说明本方法重复性良好。代入标准曲线,计算样品中总香豆素的平均含量为21.7%。
2.1.8 加样回收率试验 精密称取同一批号已知含量样品6份(总香豆素含量为21.7%)各5.0 mg,置量瓶中,分别加入1.036 8 mg秦皮甲素(0.288 mg/mL秦皮甲素对照品溶液3.6 mL),按“2.1.2”项下方法制备供试品溶液,按2010年版《中华人民共和国药典》(一部)分光光度法,在334 nm波长处测定吸光度,代入标准曲线计算样品中总香豆素的含量,计算总香豆素回收率,结果见表1。平均回收率为100.6%,RSD=1.8%(n=6),说明本方法准确性良好。
2.1.9 样品测定 取秦皮醇提取物、水提取物样品各3份,约10 mg,精密称定,按“2.1.2”项下方法制备供试品溶液,按2010年版《中华人民共和国药典》(一部)分光光度法,在334 nm波长处测定吸光度,代入标准曲线,计算样品中总香豆素的含量,结果见表2。
2.2 4种主要香豆素成分含量测定
2.2.1 色谱条件 采用Agilent ZORBAX SB-C18色谱柱(4.6 mm×250 mm,5 ?m),以乙腈(A)-0.01%磷酸(B)为流动相梯度洗脱(0~21 min,8%~15%A;21.0~21.1 min,15%~80%A;21.1~25 min,80%A);柱温25 ℃,流速1.0 mL/min,检测波长334 nm。
2.2.2 对照品溶液的制备 精密称取秦皮甲素、秦皮苷、秦皮乙素、秦皮素对照品适量,分别置于10 mL量瓶中,以甲醇溶解,定容,得浓度分别为0.550 0、0.539 0、0.060 0、0.056 2 mg/mL的4种成分对照品溶液;另精密称取上述4种对照品适量,加甲醇配制成含秦皮甲素0.197 9 mg/mL、秦皮苷0.186 6 mg/mL、秦皮乙素0.010 8 mg/mL、秦皮素0.049 mg/mL的溶液,作为混合对照品溶液。
2.2.3 供试品溶液的制备 取秦皮提取物适量,粉碎,过80目筛,精密称取10 mg,加甲醇10 mL,称定质量,超声40 min(功率250 W,频率200 Hz),放冷,用甲醇补足减失的质量,摇匀,滤过,取续滤液作为供试品溶液。
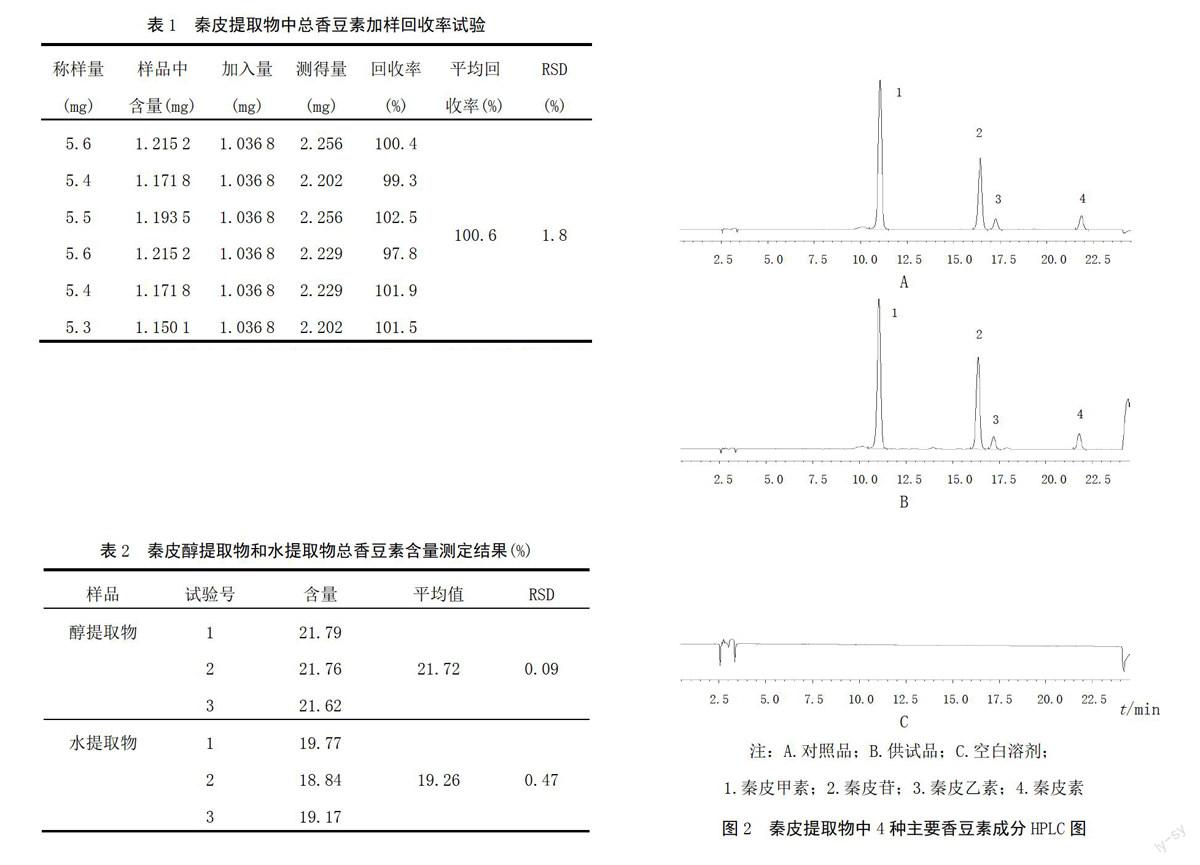
2.2.4 专属性考察 精密吸取混合对照品溶液和供试品溶液各8 μL进样分析,色谱图见图2。可见,在该色谱条件下,空白溶剂没有影响,可以将秦皮中4种香豆素成分检测出来,专属性良好。
A
B
C
注:A.对照品;B.供试品;C.空白溶剂;
1.秦皮甲素;2.秦皮苷;3.秦皮乙素;4.秦皮素
图2 秦皮提取物中4种主要香豆素成分HPLC图
2.2.5 线性关系考察 精密吸取秦皮甲素对照品溶液(0.550 0 mg/mL)0.1、0.5、1.5、3、5、7 ?L,秦皮苷对照品溶液(0.539 0 mg/mL)0.1、0.5、1.5、3、5、7 ?L,秦皮乙素对照品溶液(0.060 0 mg/mL)1、3、5、7、9、11 ?L,秦皮素对照品溶液(0.056 2 mg/mL)1、3、5、7、9、11 ?L,按上述色谱条件测定峰面积。以峰面积为纵坐标,进样量为横坐标,绘制标准曲线,计算回归方程。Y秦皮甲素=2111.7X+71.454,r=0.9997,表明秦皮甲素在0.055 0~3.850 0 ?g范围内与峰面积呈良好的线性关系;Y秦皮苷=1563.5X-4.7342,r=0.9998,表明秦皮苷在0.053 9~3.773 0 ?g范围内与峰面积呈良好的线性关系;Y秦皮乙素=3313X+7.608, r=0.999 9,表明秦皮乙素在0.060 0~0.660 0 ?g范围内与峰面积呈良好线性关系;Y秦皮素=3122.7X+13.715,r=0.999 9,表明秦皮素在0.056 2~0.618 2 ?g范围内与峰面积呈良好的线性关系。
2.2.6 精密度试验 精密吸取混合对照品溶液(含秦皮甲素0.197 9 mg/mL、秦皮苷0.186 6 mg/mL、秦皮乙素0.010 8 mg/mL、秦皮素0.014 9 mg/mL)8 μL,在所确定的色谱条件下,重复进样6次,计算秦皮甲素、秦皮苷、秦皮乙素、秦皮素峰面积RSD分别为0.12%、0.19%、0.74%、0.25%,说明本法精密度良好。
2.2.7 稳定性试验 精密吸取同一供试品溶液8 μL,分别于0、2、4、6、8、12 h依次进样,计算各成分含量及其RSD。结果秦皮甲素、秦皮苷、秦皮乙素、秦皮素平均含量分别为18.667 7%(RSD=0.780 7%)、16.814 5%(RSD=1.478 5%)、1.027 8%(RSD=1.779 9%)、1.406%(RSD=1.549 4%),说明供试品溶液在12 h内稳定。
2.2.8 重复性试验 精密称取同一批样品按供试品制备6份供试品溶液,分别精密吸取8 μL进样分析,计算各成分含量及其RSD。结果秦皮甲素、秦皮苷、秦皮乙素、秦皮素平均含量分别为19.250 9%(RSD=1.574 9%)、17.138 7%(RSD=1.433 2%)、1.054 0% (RSD=1.185 7%),1.462 4%(RSD=1.742 3%),说明本法重复性良好。
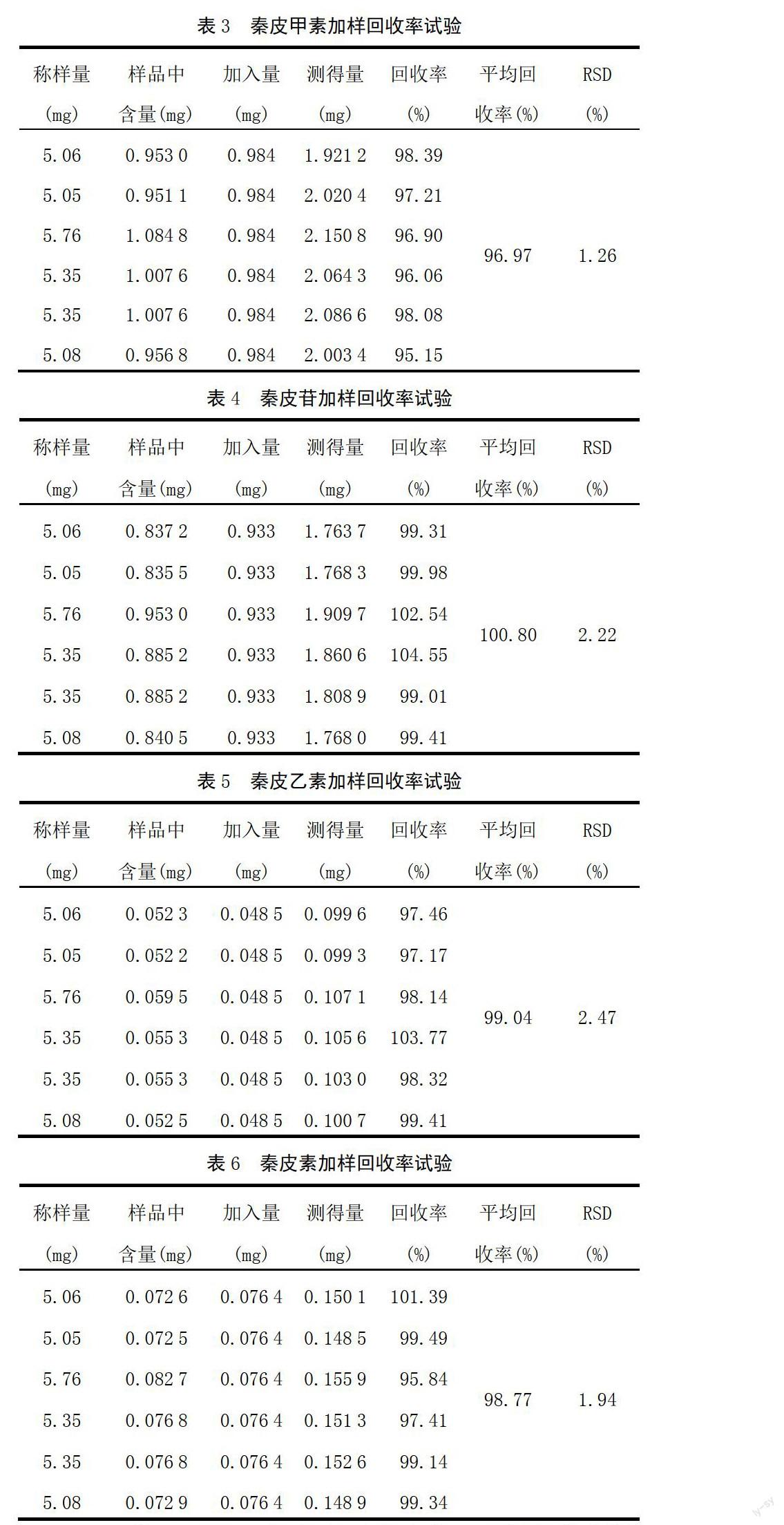
2.2.9 加样回收率试验 取同一批号已知含量样品6份(含秦皮甲素18.834 1%、秦皮苷16.545 0%、秦皮乙素1.033 6%、秦皮素1.435 6%)各5 mg,精密称定,分别精密加入0.984 0 mg/mL秦皮甲素1.0 mL、0.933 0 mg/mL秦皮苷1.0 mL、0.080 8 mg/mL秦皮乙素0.6 mL、0.152 9 mg/mL秦皮素0.5 mL,精密加入6.90 mL甲醇,称定质量,超声40 min,放冷,再称定质量,用甲醇补足减失的质量,摇匀,滤过,取续滤液,精密吸取8 μL进样分析,计算4种成分的回收率及其RSD,结果见表3~表6。秦皮甲素、秦皮苷、秦皮乙素、秦皮素的平均回收率分别为96.97%、100.80%、99.04%、98.77%,RSD(n=6)分别为1.26%、2.22%、2.47%、1.94%。说明本法准确性良好。
2.2.10 样品测定 取秦皮醇提取物、水提取物样品各3份,约5 mg,精密称定,按“2.2.3”项下方法制备供试品溶液,进样10 μL,在上述色谱条件下进行样品测定,结果见表7。
3 讨论
秦皮提取物中香豆素类成分是其发挥药效作用的物质基础,其中秦皮甲素、秦皮苷、秦皮乙素、秦皮素具有明确的药理活性,所以,以秦皮提取物中总香豆素含量及4种主要香豆素成分作为其质量控制指标,是发挥其药效的重要保证。
本研究采用UV测定秦皮提取物总香豆素含量,采用HPLC测定秦皮提取物4种主要香豆素成分的含量,2种方法线性关系良好,精密度、稳定性好,重复性和加样回收率符合规定,可用于秦皮提取物总香豆素和主要香豆素成分的质量控制。
本课题组已建立了秦皮药材中秦皮甲素、秦皮苷、秦皮乙素、秦皮素的含量测定方法,本研究根据以往工作基础[6]以甲醇作为提取溶媒;试验对超声处理、加热回流2种提取方法进行了比较,测得秦皮提取物4种成分含量总和的结果显示,超声法略优于回流法;对甲醇用量10、20、30 mL提取进行比较试验,结果显示不同甲醇用量测得4种成分含量总和相近,故采用10 mL进行提取;对超声提取20、30、40 min测得4种成分含量总和进行比较,结果超声40 min提取效果最佳。本研究参考前期药材检测方法及药典方法,对甲醇-0.25%醋酸水溶液、甲醇-0.30%醋酸水溶液、乙腈-0.01%磷酸水溶液等流动相系统进行考察,最终确定乙腈-0.01%磷酸水溶液系统,并采用梯度洗脱,缩短了检测时间,使4个成分在30 min内达到良好分离。
参考文献:
[1] 汪国松,杨亚滨,李璠,等.秦皮的研究进展[J].国外医药:植物药分册, 2007,22(3):108-111.
[2] 尹明浩,吕惠子,姜丽君,等.秦皮提取物对小鼠急性肝损伤保护作用的实验研究[J].时珍国医国药,2007,18(3):590-591.
[3] 王波.秦皮提取物的抗辐射研究[J].陕西农业科学,2010,56(4):40- 42.
[4] 杨宗辉,魏征人,尹建元,等.秦皮提取物对实验性脂肪肝的治疗作用及其机制[J].中国老年学杂志,2007,27(6):517-519.
[5] 张秀琴,徐礼燊.秦皮中香豆素的含量测定[J].药学通报,1981,16(9):56.
[6] 刘丽梅,李曼玲,冯伟红,等.HPLC法测定秦皮中香豆素类成分的含量[J].中草药,2004,35(7):819-822.
[7] 刘丽梅,陈琳,王瑞海,等.秦皮化学成分的研究[J].中草药,2001, 32(12):1073-1074.
[8] 刘丽梅,王瑞海,陈琳,等.秦皮化学成分的研究[J].中草药,2003, 34(10):889-890.
[9] 刘丽梅,王瑞海,陈琳.苦枥白蜡树化学成分的研究[J].中国民族民间医药,2009,18(16):5.
[10] 陈琳,刘丽梅,王瑞海,等.HPLC测定不同品种秦皮药材中香豆素成分[J].中国中药杂志,2008,33(23):2858-2860.
(收稿日期:2015-02-22)
(修回日期:2015-03-16;编辑:陈静)
