第二章 药品有效性评价指南
2015-05-26刘芳,翟所迪
药品有效性的评价主要遵循循证医学的方法,最终的评价成果汇总成卫生技术评估的有效性评价部分,作为制定药物政策、医疗保险政策、购入新药、药品选择、药品研发和上市的依据。
1 检索策略
1.1 数据库

表1 需检索的文献数据库
1.2 检索式
为全面获取所有关于“***”的文摘,只用“****”一个关键词进行全文检索或者主题检索。
⑴英文数据库
“****”。
⑵中文数据库
“***”。
2 文献纳入/分类标准
将检索到的文献按照文献纳入/分类标准进行分类,采用PICO-S原则设计纳入/分类标准,该药物所主要治疗的每个病种或适应证一个PICO-S。
2.1 研究人群(P)
描述评价人群的特征。
2.2 干预措施(I)
描述待评价的药物治疗。
2.3 对照措施(C)
描述和待评价药物对照的治疗措施或安慰剂。
2.4 结局指标(O)
相应的结局指标。
2.5 研究类型(S)
①卫生技术评估(HTA)、循证指南、系统评价(SR)、Meta分析;②随机对照试验(RCT);③若数据不够的话,必要的时候纳入观察性研究(如队列研究或病例对照研究)。
3 数据提取
按照预先设计好的数据提取表(见表2~表5),由1名评价者独立提取数据,由另外1名评价者核对提取的数据。有任何争议通过讨论解决,必要的时候咨询第3位评价者。提取的数据包括研究的基本特征、质量、主要结果和不良反应。
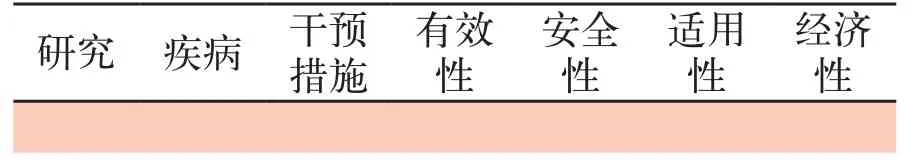
表2 纳入HTA的基本特征

表3 纳入指南的基本特征

表4 纳入SR/meta分析的基本特征

表5 纳入RCT的基本特征

表6 AGREE II
4 质量评价
由2名评价者独立评价纳入研究的质量,若存在争议则通过讨论解决或咨询第3位评价者。由于目前尚无全球共识的HTA质量评价工具,参考2011年澳大利亚发表的HTA中所采用的NHMRC(2000a)及CRD(2009)更新条目对其进行评价。采用AGREE II评价指南的质量(表6)。采用AMSTAR的评价标准评价SR/Meta分析的质量(表7,表8)。按照Cochrane手册的要求评价RCT研究的质量(表9)。
5 数据合并——评价结果
对纳入的卫生技术评估和循证指南进行描述性评价和分析。
对纳入的系统评价/Meta分析和RCTs进行描述性评价和分析,必要的时候对纳入的RCTs进行Meta分析。用表来总结纳入研究的数据(见表10)。
利用GRADE评价标准对获得的证据进行评价。其中RCT研究初步列为高质量证据,观察性研究列为低质量证据,根据影响证据质量的因素对证据进行升降级,其中:GRADE证据质量分级(见表11)。
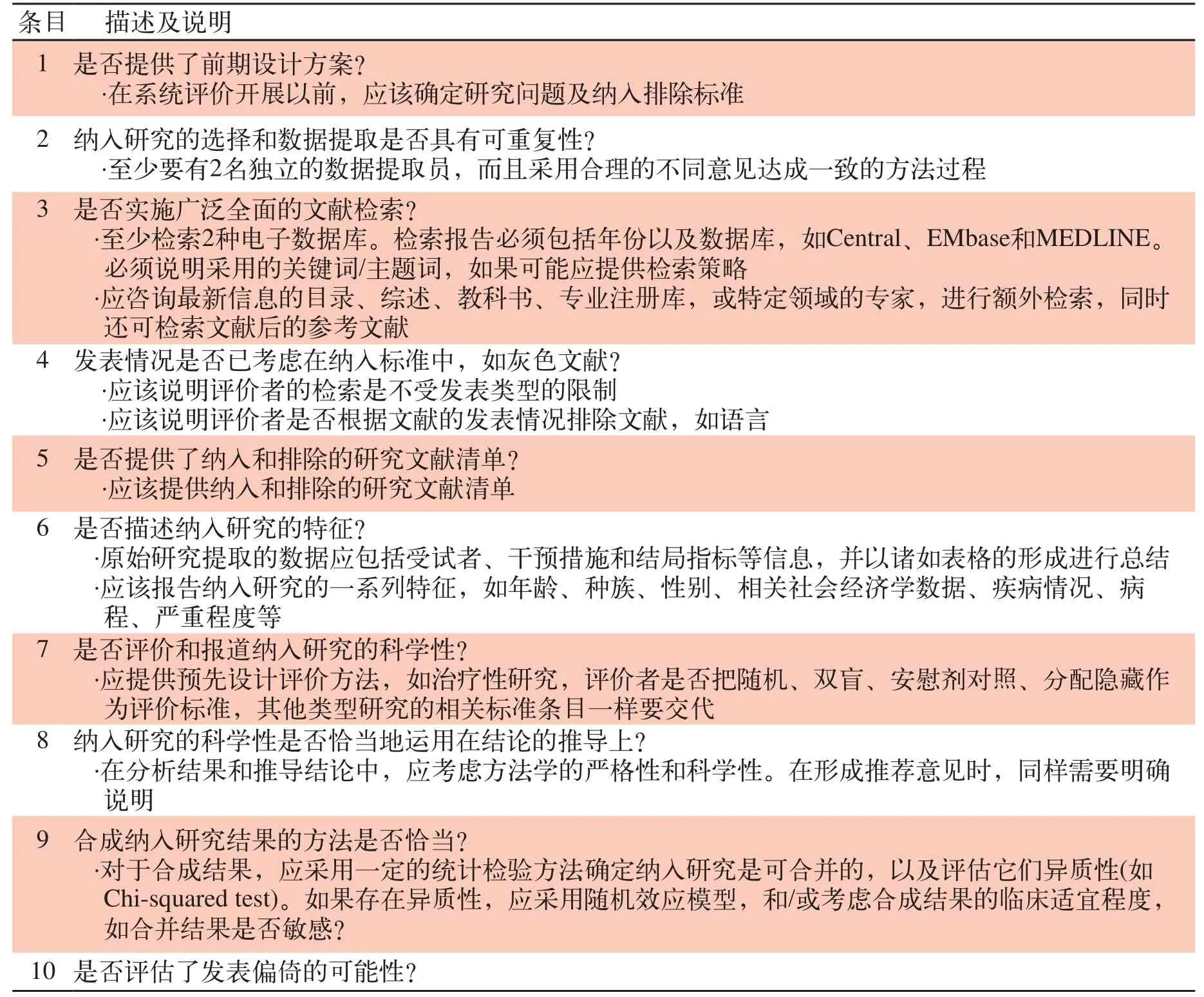
表7 AMSTAR清单及说明

表8 AMSTAR评价纳入系统评价的质量
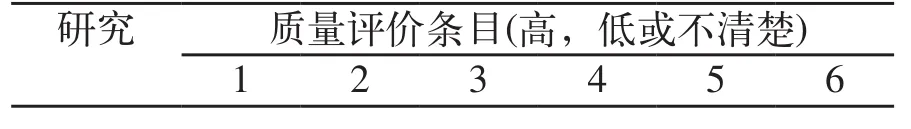
表9 RCT的质量评价

表10 临床研究证据总结表
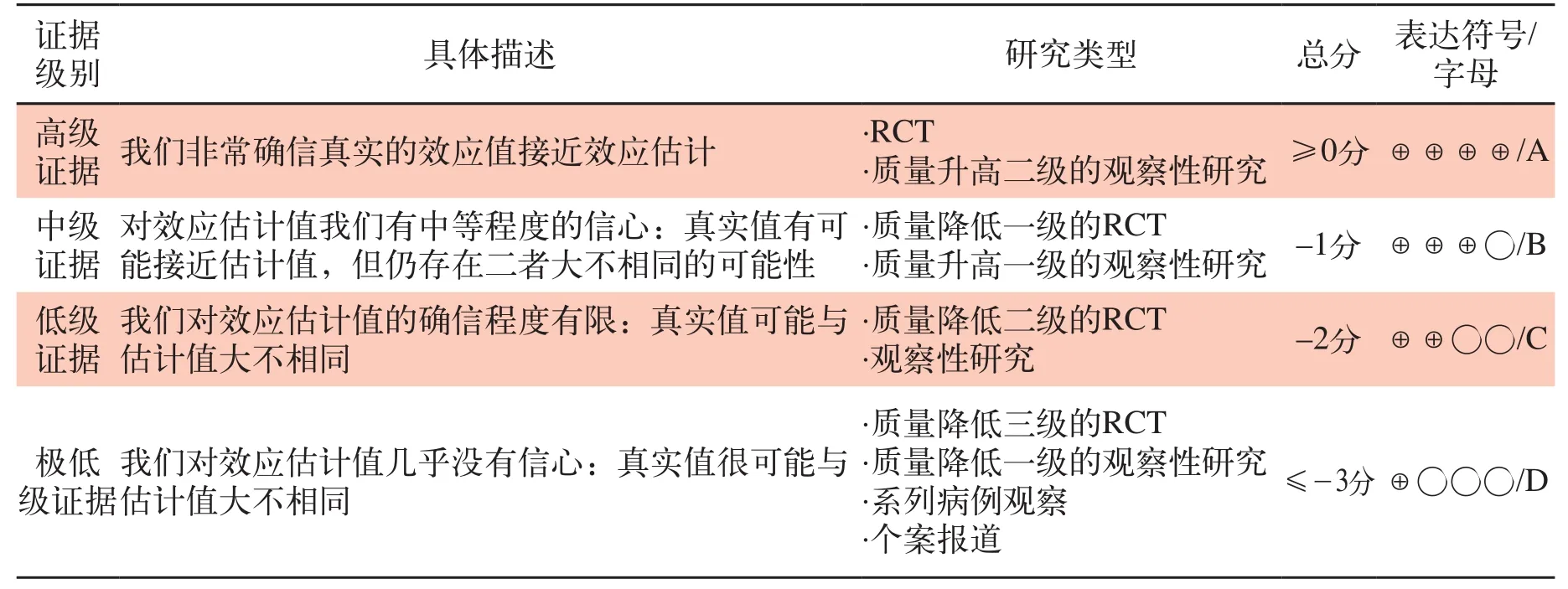
表11 临床研究证据的GRADE分级
