胸腔原位种植与经左心室注射建立肺癌脑转移动物模型的比较
2015-05-25陈愉生涂洵崴俞梅娥林献李鸿茹
陈愉生,涂洵崴,俞梅娥,林献,李鸿茹
(福建医科大学省立临床医学院,福州 350001)
研究报告
胸腔原位种植与经左心室注射建立肺癌脑转移动物模型的比较
陈愉生*,涂洵崴,俞梅娥,林献,李鸿茹
(福建医科大学省立临床医学院,福州 350001)
目的为研究肺癌脑转移机制提供一种可靠的造模方法。方法18只BALB/c nude裸鼠随机分为2组,分别经胸腔原位种植与经左心室注射的方法,接种处于对数期生长的人肺腺癌PC-9细胞(1×106/0.1 mL),接种后观察裸鼠状态,在裸鼠出现严重恶液质时处死。解剖裸鼠,观察肺、脑、肝、肾转移情况;病理取材、HE染色观察。结果胸腔原位种植组:3周后,第4、6、9号裸鼠可见胸壁瘤结凸起形成,渐增大;裸鼠于第4~6周开始出现体重减轻,并逐渐出现恶液质,分别于第5~7周处死。开胸后见:胸腔广泛灰白色肿瘤结节、团块形成,双侧肋骨、胸膜、脊柱多发种植灶,双肺被侵蚀压缩,颜色苍白,形态改变。HE染色见:肺表面广泛种植瘤形成,与正常肺组织分界清楚;仅6号裸鼠出现脑转移。经左心室注射组:裸鼠于第3周开始出现体重下降,并逐渐出现恶液质,全部裸鼠于第4周处死。开胸后:除11、18号裸鼠胸壁见2~3个散在瘤结分布(直径约1~3 mm),其余胸腔视野正常;肺组织轮廓清楚,未见瘤结生成。HE染色见:9只裸鼠均出现大小不一的多发脑转移灶。胸腔原位种植组:脑转移率为11.1%;经左心室注射组:脑转移率为100%。结论经左心室注射建立肺癌脑转移动物模型的方法,较胸腔原位种植的方法保证了更高的脑转移率。
肺癌脑转移;左心室注射;胸腔种植;动物模型
肺癌作为一种常见的恶性肿瘤,其死亡率占癌症死亡率之首[1]。肺癌最常见的远处转移部位之一是脑部,肺癌脑转移的发生率为23%~65%,是脑转移性肿瘤中最常见的类型[2]。由于脑组织解剖结构与功能的特殊性,肺癌脑转移患者放、化疗效果不佳,预后差,其中位生存期仅有4~5个月[3]。本研究以PC-9人肺腺癌细胞分别经胸腔原位种植与左心室注射的方法,接种裸鼠,拟建立肺癌脑转移的实验动物模型,为下一步研究脑转移具体机制提供可靠的造模方法。
1 材料与方法
1.1 材料
1.1.1 裸鼠与细胞
BALB/c nude裸鼠购自上海斯莱克实验动物有限责任公司【SCXK(沪)2012-002】,18只,体重(16 ±2)g,4~6周龄,均为雌性,随机编号1ˉ18(1ˉ9为胸腔原位种植组,10ˉ18为经左心室注射组),饲养于福建医科大学动物实验中心SPF级动物室【SYXK(闽)2012ˉ0001】;所用的饲料、水、垫料都经过严格灭菌处理,并按动物实验的3R原则给予人道的关怀。PC-9人肺腺癌细胞系由华中科技大学同济医学院同济医院分子医学中心惠赠。
1.1.2 试剂与设备
RPMI1640培养基(HyClone,美国)、胎牛血清(杭州四季青,中国)、0.25%Trypsin-EDTA(Gibco,美国)、Pen-strep双抗(Gibco,美国)、倒置显微镜(奥林巴斯,日本)、生物安全柜和CO2培养箱(三洋,日本),舒锐insulin syringe 29G(BD,美国)。
1.2 方法
1.2.1 细胞培养
PC-9细胞常规培养于含10%胎牛血清,1% Pen-Strep双抗,1%谷氨酰胺的RPMI 1640培养基中,置37℃、5%CO2的培养箱中培养;以0.25%胰酶消化传代。
1.2.2 细胞悬液置备
镜下观察肿瘤细胞生长状况良好时,取对数生长期的细胞,经胰酶消化制备细胞悬液,以2000 r/ min离心5 min,弃去上清液。加入无血清的1640培养基,吹打、再次2000 r/min离心5min,以无血清培养基稀释至细胞密度为1×107/mL的单细胞悬液。
1.2.3 接种动物
胸腔原位种植组:裸鼠经5%水合氯醛麻醉,右侧卧位固定,75%乙醇常规消毒裸鼠左侧胸皮肤,于腋后线第6肋间进针(以进针突破感后再进针3~4 mm为准)。经左心室注射组:裸鼠经麻醉、仰卧位固定、消毒后,于胸骨左缘第二肋间旁开2 mm处进针(进针前调节好BD针头至滞留空气0.05 mL左右后,再吸取细胞液;进针3~5 mm,以观察到血液喷射涌出作为进入左心室的标准;并在10 s内完成注射)。两组均注入肿瘤细胞悬液0.1 mL(即1× 106个肿瘤细胞),注射完毕后快速拔针,棉签按压进针点。PC-9细胞经上述方法接种裸鼠各9只。接种后的裸鼠置于SPF环境内饲养,并密切观察。
1.2.4 观察与标本留取
期间定期称重,观察裸鼠的精神状态、一般情况等,特别注意裸鼠是否出现共济失调、偏瘫、视物不明等,当裸鼠体重减轻20%或者低于16 g时,密切观察是否出现嗜睡、行动迟缓等症状或异样体征,并于裸鼠出现严重恶液质(主要表现为弓背、消瘦、精神萎靡、呼吸短促、食欲下降等)时处死。留取脑、肺、肝肾及可疑转移灶处组织,经脱水固定、石蜡包埋、切片、HE染色,观察。
2 结果
2.1 裸鼠的情况
两组裸鼠注射过程中均未发生死亡。胸腔原位种植组:裸鼠于注射后第4~6周体重开始下降,并逐渐出现恶液质,期间并未出现颅脑变形,共济失调、偏瘫、跛行、视物不明等情况,全部裸鼠于第5~7周处死。经左心室注射组:裸鼠于第3周开始出现体重减轻,并逐渐出现恶液质,期间部分裸鼠出现偏瘫、跛行、单侧眼失明,并未出现颅脑变形等情况,全部裸鼠于第4周处死。
2.2 肺部成瘤、脑部转移瘤及其他脏器转移情况
胸腔原位种植组:3周后,第4、6、9号裸鼠胸壁可见瘤结凸起形成,渐增大。开胸后见:多个大小不一的灰白色瘤组织占据胸腔,双侧肋骨、胸膜、脊柱多发种植灶,双肺被侵蚀压缩、颜色苍白、形态改变(图1-A-B)。脑、肝、肾肉眼取材均未见转移灶。病理HE示:残留少数肺组织结构背景下,大量异常腺体形成,大小不一,多数与正常肺组织分界清楚,少数腺癌细胞侵入肺实质(图2-A-B);仅6号裸鼠出现脑转移灶,直径约2~3 mm(图2-D);肝、肾组织未发现转移灶。经左心室注射组:开胸后:除11、18号裸鼠胸壁上见2~3个大小约为1~3 mm的瘤结形成,其余胸腔视野未见异常(图1-C);肺组织颜色润红、质软、充气良好,未见瘤结形成(图1-D)。脑、肝、肾肉眼取材时未见到转移灶(图1-E)。病理HE示:9只裸鼠均出现大小不一的多发脑转移灶(图2-E-F)。肺、肝、肾未见转移灶形成(图2-C)。
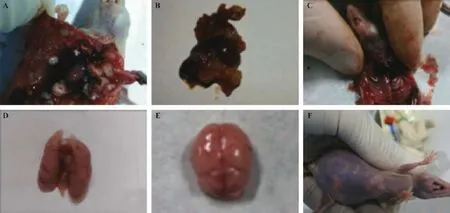
注:A、B.胸腔原位种植组:胸腔-肺组织形态;C、D.经左心室注射组:胸腔-肺组织形态;E.经左心室注射组:脑;F.胸腔原位种植组:腹腔肿块、腹腔积液。图1 裸鼠解剖形态Note.A-B:Thorax and lung atautopsy in the orthotopic implantation group;C-D:Thorax and lung atautopsy in the left ventricular injection group;E:Brain feature in the left ventricular injection group;F:Abdominalmasses and effusion in the orthotopic implantation group.Fig.1 Macroscopic features of the nudemice
2.3 脑转移率的比较
胸腔原位种植组脑转移率为11.1%;经左心室注射组脑转移率为100%。
3 讨论
肺癌最常见的远处转移部位之一是脑部,肺癌脑转移的发生率为23%~65%,是脑转移性肿瘤中最常见的类型[2]。一直以来,人们致力于肺癌脑转移发生机制的研究探索,希望能进一步改善肺癌脑转移患者的生活质量、生存期。因此,建立一个合适的肺癌脑转移实验动物模型是非常必须的。
目前建立脑转移实验动物模型的方法主要有以下四种:①脑内局部原位种植[4ˉ5]。脑原位植入肿瘤细胞,造成脑转移。②尾静脉注射[6]。小鼠经尾静脉注射肿瘤细胞,沿血液循环播散种植在脑中;③肿瘤“原发”部位种植[7ˉ9]。模拟肺癌、乳腺癌、前列腺癌、黑色素瘤等发生的脑转移,相应地将肿瘤细胞或者肿瘤组织块种植在肺、乳腺、前列腺、皮下来建立“原位”模型。④左心室[10ˉ12]或颈内动脉注射[13ˉ15]。经左心室或颈内动脉注射肿瘤细胞,沿血液循环播散种植在脑中。
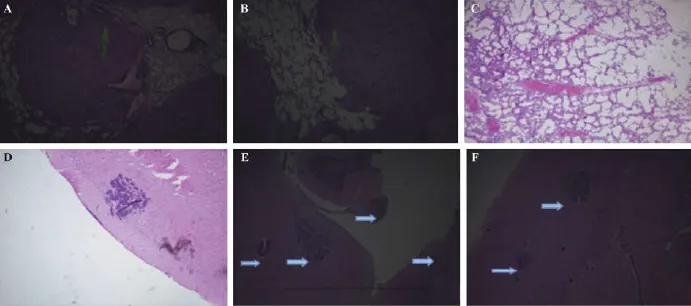
注:A、B.胸腔原位种植组:肺组织瘤结;C.经左心室注射组:正常肺组织;D.胸腔原位种植组:脑转移灶;E-F.经左心室注射组:脑转移灶。图2 裸鼠病理组织形态(HE染色×10)Note.A-B:Pulmonary pathology in the orthotopic implantation group;C:Normal lung tissue in the left ventricular injection group;D:Metastatic brain lesions in the orthotopic implantation group;E-F:Metastatic brain lesions in the left ventricular injection group.Fig.2 Pathology of the nudemice.H&E staining,×10
脑内原位种植,建模成功率高,但一般只有单发肿瘤,且不能模拟肿瘤细胞自原位形成、移行、侵入血管,透过血脑屏障的过程,在研究肿瘤脑转移的发生机制上具有局限性。尾静脉注射,肿瘤细胞经静脉系首先滞留于肺部,只有那些通过肺毛细血管床及从肺部转移灶脱离的肿瘤细胞方可进入体循环,进而形成脑转移可能;且该方法实验周期较长,脑转移成瘤性不高。
肿瘤“原位”种植,就肺癌脑转移研究上,可将肺癌细胞或组织块经支气管移植、胸腔注射等方法进行原位建模研究。该方法虽较好地模拟了肿瘤发生、发展、转移的过程,但实验周期长,动物模型的生长一致性差,不易形成对照;而且,支气管移植的方法操作要求高、难度大;而胸腔种植又存在气胸、腹腔转移等情况。本实验采用胸腔原位种植的方法,在注射过程中,裸鼠虽未出现呼吸急促、呼吸困难等气胸表现;但存在胸腔广泛种植情况,甚至转移至腹腔,出现腹部肿块、腹腔积液表现(图1-F);另外,9只裸鼠恶液质出现时间不一致,没有形成良好对照;且病理HE示:仅有一只裸鼠出现脑转移,转移率低。我们猜想:这可能与裸鼠在脑转移灶形成前,就因不堪胸腔负瘤状态出现恶液质死亡有关。
左心室注射、颈内动脉注射的方法很好地模拟了肺癌的血道转移过程:即通过肺毛细血管床的肿瘤细胞以及从形成的转移灶脱离的肿瘤细胞进入左心室,随血流流向脑部,产生脑转移可能[12]。此外,该方法大大减少了肺毛细血管床对肿瘤细胞的滞留,增加了穿过脑实质的肿瘤细胞数量,并延迟因肺癌而导致的死亡,进而延长了肿瘤细胞在脑内生长、增殖的时间,从而获得更高的脑转移形成的成功可能[16ˉ17]。与颈内动脉注射方法相比,左心室注射虽然存在其他脏器转移的可能,但操作方法相对简单。按照“种子与土壤”转移学说的观点,进入动脉系统的肿瘤细胞形成特定器官的转移,是肿瘤细胞异质性与靶器官微环境相互作用的结果,而与“血流机械”理论无关[18]。因此,经左心室注射进入体循环的肿瘤细胞,虽然开始没有经历肺毛细血管床的阻滞,但在后续过程中肿瘤细胞同样要经过粘附、降解、迁移等过程,才能透过血脑屏障,形成脑转移[19]。本实验采用左心室注射的方法:裸鼠于第3周开始出现体重下降,并逐渐出现恶液质,裸鼠各阶段生存状况相一致;第4周裸鼠处死时,肉眼虽未见到肺、脑脏器表面异常结节形成,但病理HE示:全部裸鼠均出现大小不一的多发脑转移灶,脑转移率100%;而肺组织形态正常。我们推测,这与肺癌细胞直接经动脉系统进入脑组织有关。另外,就开胸后少数裸鼠胸腔内出现散在微小种植灶,我们考虑:左心室注射过程中,不可避免的导致肿瘤细胞漏出至胸腔或针道带出的可能,期望通过加强左心室注射方法的练习得以改进。
综上所述,就胸腔原位种植与经左心室注射建立肺癌脑转移实验动物模型的两种方法,在操作简并性与可行性上相当;但经左心室注射的方法,裸鼠各阶段生存状况相一致,且保证了更高的脑转移率。
[1] Siegel R,Naishadham D,Jemal A.Cancer statistics[J].CA Cancer JClin,2012,62(1):10ˉ29.
[2] Preusser M,Capper D,Ilhan-Mutlu A,et al.Brainmetastases:pathobiology and emerging targeted therapies[J].Acta Neuropathol,2012,123(2):205ˉ222.
[3] Sandler A,Hirsh V,Reck M,et al.An evidence-based review of the incidence of CNSbleeding with anti-VEGF therapy in nonsmall cell lung cancer patients with brain metastases[J].Lung Cancer,2012,78(1):1ˉ7.
[4] Wang J,Daphu I,Pedersen PH,et al.A novel brainmetastases model developed in immunodeficient rats closely mimics the growth ofmetastatic brain tumours in patients[J].Neuropathol Applied Neurobiol,2011,37:189ˉ205.
[5] Martinez-Murillo R,Martinez A.Standardization of an orthotpic mouse brain tumor model following transplantation of CT-2A astrocytoma cells[J].Histol Histopathol,2007,22:1309ˉ 1326.
[6] Shen L,Chen L,Wang Y,et al.Long noncoding RNA MALAT1 promotes brain metastasis by inducing epithelial-mesenchymal transition in lung cancer[J].J Neurooncol.2015,121(1):101ˉ108.
[7] Johnston MR,Mullen JB,Pagura ME,etal.Validation ofan orthotopic model of human lung cancer with regional and systemic metastases[J].Ann Thorac Surg,2001,71(4):1120ˉ1125.
[8] 王亚伟.荧光标记人肺腺癌细胞A549后原位种植法建立NSCLC脑转移模型及其活检测[D].济南:山东大学,2006.
[9] 张翠香,高恒宇,陈永春,等.肺癌脑转移型A549/GFPˉ2细胞的筛选及其条件液对脑微血管内皮细胞的作用[J].现代生物医学进展,2014,14(9):1652ˉ1656.
[10] Yin JJ,Tracy K,Zhang L,et al.Noninvasive imaging of the functional effects of anti-VEGF therapy on tumor cell extravasation and regional blood volume in an experimental brain metastasismodel[J].Clin Exp Metast,2009,26:403ˉ414.
[11] Gupta P,Adkins C,Lockman P,et al.Metastasis of breast tumor cells to brain is suppressed by phenethyl isothiocyanate in a novelmetastasismodel[J].PLoSONE,2013,8N6:e67278.
[12] 雷贝,曹杰,沈杰,等.人肺腺癌脑转移动物模型建立及显像的研究[J].中国肺癌杂志,2013,16(8):391ˉ399.
[13] Wu YJ,Muldoon LL,Gahramanov S,et al.Targeting alphaV-integrins decreasedmetastasis and increased survival in a nude rat breast cancer brain metastasismodel[J].JNeurooncol,2012,110:27ˉ36.
[14] 徐磊,周伟,刘科.GFP标记Lewis肺癌细胞3LL颈内动脉注射建立脑转移癌动物模型的可行性研究[J].重庆医学,2013,42(23):2754ˉ2757.
[15] Zhang Z,Hatori T,Nonaka H.An experimentalmodel of brain metastasis of lung carcinoma[J].Neuropathology,2008,28:24ˉ28.
[16] Yoshimasu T,Sakurai T,Oura S,et al.Increased expression of integrin alpha3beta1 in highly brain metastatic subclone of a human non-small cell lung cancer cell line[J].Cancer Sci,2004,95(2):142ˉ148.
[17] Shintani Y,Higashiyama S,Ohta M,et al.Overexpression of ADAM9 in non-small cell lung cancer correlateswith brainmetastasis[J].Cancer Res,2004,64(12):4190ˉ4196.
[18] Fokas E,Engenhart-Cabillic R,Daniilidis K,et al.Metastasis:the seed and soil theory gains identity[J].Cancer Metastasis Rev,2007,26(3ˉ4):705ˉ715.
[19] Fidler IJ. The role of the organ microenvironment in brain metastasis[J].Semin Cancer Biol,2011,21:107ˉ112.
Com parison between the establishmentmethods ofmousemodels of lung cancer brain metastases by intrathoracic orthotopic im plantation and by left ventricular injection
CHEN Yu-sheng,TU Xun-wei,YU Mei-e,LIN Xian,LIHong-ru
(Fujian Provincial Hospital,Fujian Medical University,Fuzhou 350001,China)
ObjectiveTo establish an appropriate animalmodel ofbrainmetastases from lung cancer in nudemice by thoracic orthotopic implantation in the chestor left ventricular injection,and to serve further studies on themechanisms of lung cancer brain metastasis.M ethodsPC-9 cells(1×106/0.1 mL)in logarithmic phase were respectively injected into 18 nudemice by orthotopic implantation in the chest or left ventricular injection(n=9 each group).The statuses of nudemice were observed after implantation.Animals showing clear signs of dyscrasia were killed.At autopsy,the lung,brain,liver and kidney were removed and histological sectionswere stained with H/E to detect the presence of tumor cells.Resu ltsIn the thoracic orthotopic implantation group,three weeks after implantation,the number 4,6,9 mice showed tumor nodules in the chestwall,they began to loseweight in the fourth to sixth week differently,showing signs of dyscrasia gradually,and were sacrificed at the fifth to seventh week.The thoracotomy revealed that thewhole thorax was occupied bymany large lung cancermasses,spreading into bilateral ribs,pleura and spinal vertebra,with scarce eroded,compressed,pale and distorted lung tissues left.Histological examination with HE staining showed the presence of neoplasms in their lung tissues but only the number 6 mouse showed metastatic lesions in the brain tissue.In the left ventricular injection group,themice almost began to loseweight in the third week simultaneously and becamemoribund slowly,which were all sacrificed at the fourth week.After thoracotomy,the thoraxeswere clear except the number 11 and 18 mice which appeared 2-3 tiny tumor foci in the chestwall,with normal lung tissues.Histological examination with HE staining showed the presence of brain metastases in all the ninemice.The rate of brain metastases from lung cancer in the left ventricular injection group was 100%,compared with 11.1%in the thoracic orthotopic implantation group.ConclusionsThe establishment method ofmousemodel by left ventricular injection shows significantly higher rate of lung cancer brainmetastases than that by thoracic orthotopic implantation.
Brain metastases from lung cancer;Left ventricular injection;Intrathoracic implantation;Animal model;Mice
Q95-33
A
1005-4847(2015)05-0490-05
10.3969/j.issn.1005ˉ4847.2015.05.009
2015-03-04
国家卫生和计划生育委员会科研基金(WKJ-FJ-17,2013-2016);福建省立医院优秀青年医师项目(2014YNQN03);福建省自然科学基金(2015J01376)。
陈愉生(1957年ˉ),女,教授,博士生导师。Email:slyyywb@126.com