子宫内膜异位症对小鼠生育能力的影响
2015-05-25崔阳阳孙伟伟赵瑞华徐彩吴天思
崔阳阳,孙伟伟,赵瑞华*,徐彩,吴天思,2
(1.中国中医科学院广安门医院妇科,北京 100053;2.北京中医药大学,北京 100029)
研究报告
子宫内膜异位症对小鼠生育能力的影响
崔阳阳1,孙伟伟1,赵瑞华1*,徐彩1,吴天思1,2
(1.中国中医科学院广安门医院妇科,北京 100053;2.北京中医药大学,北京 100029)
目的建立子宫内膜异位症小鼠模型,观察子宫内膜异位症对模型小鼠妊娠能力的影响。方法通过“腹腔+皮下”同系异体子宫内膜注射法建立子宫内膜异位症小鼠模型,与假手术组、空白组比较,观察其妊娠率及活胎率,观察子宫内膜异位症对模型小鼠妊娠能力的影响。结果建模2周后,小鼠皮下和腹腔均见有子宫内膜异位病灶生成,模型组、假手术组和空白组,共三组。通过生育功能检测,三组妊娠率差异有显著性意义(P<0.05)。三组的活胎数差异有显著性意义(P<0.05)。结论成功建立子宫内膜异位症小鼠模型,并证实子宫内膜异位症可影响模型小鼠生育功能。
子宫内膜异位症;小鼠;生育功能
子宫内膜异位症(endometriosis,EM),是一种常见的雌激素依赖性疾病,是育龄妇女最常见的疾病之一,简称内异症。内异症患者并发不孕高达40%~60%,而在不孕症患者中也有40%~50%存在子宫内膜异位症[1],内异症患者不孕为非内异症人群的20倍[2]。可见,内异症与不孕症存在紧密联系。2000年Buyalos等[3]首次提出“内异症相关不孕”。本研究以中医理论为指导,在前期工作的基础上,通过建立子宫内膜异位症小鼠模型,探讨EM对小鼠妊娠能力的影响。
1 材料与方法
1.1 材料
1.1.1 实验动物
SPF级KM小鼠,雌性,7周龄,体重(25±3)g,40只,雄性,10周龄,体重(33±2)g,10只。所有实验动物购自北京华阜康生物科技股份有限公司【SCXK(京)2009-0007】。实验动物饲养于中国中医科学院广安门医院SPF级动物实验室【SYXK(京)2009-0034】,灯光(12L:12D),室温22℃。饲养动物所需的笼具及饮水瓶均由专业饲养人员高压灭菌后提供。雌性KM小鼠用于模型小鼠的供体、受体及空白对照,雄性KM小鼠用于与雌鼠合笼。
1.1.2 实验药物
苯甲酸雌二醇购自宁波第二激素厂(中国,浙江,批号:110252511)。HE染色由北京大学医学部病理实验室进行操作。其余所有的实验药物及试剂均来自于中国中医科学院广安门医院免疫实验室。
1.2 方法
1.2.1 子宫内膜异位症小鼠模型的建立[4]
模型建立前,选择动情周期正常的小鼠[5]作为模型小鼠的内膜的供体以备移植注射,供体小鼠皮下注射苯甲酸雌二醇(E2)促进内膜生长并且使内膜易于剥离。模型建立的实验过程皆在无菌条件下进行操作。
脱颈处死供体小鼠,常规消毒后小鼠腹部并做一5 cm的切口暴露子宫,剪下子宫将其置于盛有生理盐水的培养皿中(含100 U/mL青霉素,100 U/ mL链霉素)。用盐水冲洗子宫,尽可能去除子宫上附着的多余脂肪组织、血块及杂质,使用“滚针法”细心剥离子宫内膜[6]。将完整的管状子宫内膜纵形剖开,剪成1 mm×1 mm的小碎片以备注射使用(如图1)。
受体小鼠以0.9%水合氯醛腹腔注射进行麻醉,腹部常规消毒备用,将以16号针头吸取0.2 mL的子宫内膜碎片悬液(含4~8个小碎片)分别进行腹腔注射与皮下注射[7ˉ8]。次日,小鼠皮下注射0.02 mL E2(1 mg/mL),促进接种内膜生长,以5 d为一周期,持续3个周期。每日腹腔注射青霉素1万单位,连续5 d以预防感染。假手术组给予注射等量生理盐水。空白组不给予任何处理。所有小鼠注射的伤口恢复良好,体征正常,无不良反应。模型建立的操作由第一作者完成。
1.2.2 子宫内膜异位症KM小鼠模型异位病灶取材及标本处理
子宫内膜异位症小鼠模型的异位病灶于2.4实验步骤处死小鼠时同步取材[4]。将取出的异位病灶用生理盐水冲洗干净,去除多余的脂肪组织和血块后,将标本置于4%中性甲醛固定24 h后,梯度酒精脱水,二甲苯透明,石蜡包埋,连续切片,常规HE染色。HE染色的操作人员不被告知实验组别。于倒置显微镜下观察异位内膜的组织形态学结构及特点。
1.2.3 子宫内膜异位症小鼠成模判断标准
子宫内膜异位症小鼠建模成功判断标准是根据EMs的病理诊断标准[9]而定,镜下出现子宫内膜,腺体或腺体样结构,间质和出血这4种改变的2种可判断模型建立成功。
1.2.4 子宫内膜异位症KM小鼠模型妊娠能力的观察
建模2周后,将三组雌鼠分别与以2∶1与性成熟雄鼠合笼,次日清晨见阴栓者视为交配成功,定为妊娠第1天。于合笼后第7天处死小鼠,观察妊娠率及活胎数,其判断标准[10]如下:妊娠率:妊娠率=妊娠只数/见栓只数;活胎:妊娠7d,孕体鲜明,判为存活;活胎率:活胎率=活胎数/总胎数。
1.2.5 统计学方法
2 结果
2.1 子宫内膜异位症小鼠模型异位病灶观察
建模2周后,模型小鼠腹部皮下手可触及米粒大小的结节,活动度较好。子宫内膜异位症小鼠模型[4]的观察结果如下(如图2ˉ6):小鼠皮下病灶,多为红色、白色或暗红色的米粒大小的结节;小鼠腹腔内病灶,多为隆起囊泡或结节,囊泡内充满淡黄色清亮透明或混浊粘稠液体。皮下和腹腔内病灶表面皆有血管网覆盖并清晰可见。肉眼观察下,在模型小鼠皮下和腹腔均可见病灶生成,小鼠皮下及腹腔有不同程度的粘连,而腹腔内粘连较严重。通过病灶的HE染色可见:切片中可见有血管生成,并有大量腺体和间质存在。本次建模共14只小鼠,仅1只未在腹腔及皮下找到病灶,仅见腹腔及皮下粘连,成功建模13只,可见,子宫内膜异位症小鼠“腹腔+皮下”注射法建立模型的成功率达90%以上。

图2 子宫内膜异位症小鼠模型皮下内异位症灶Fig.2 Ectopic lesions of endometriosis in the subcutaneous tissue in themodelmice

图3 子宫内膜异位症小鼠模型腹腔内异位症灶Fig.3 Ectopic lesions of endometriosis in the abdominal cavity ofmodelmice
2.2 子宫内膜异位症模型小鼠妊娠率及活胎数
采用Fisher精切概率法,三组妊娠率差异有显著意义(P<0.05)。通过两两比较,模型组妊娠率明显低于假手术组与空白组(P<0.05);而假手术组与空白组的妊娠率差异无显著性(P>0.05)(见表1)。
采用非参数检验,三组的活胎数差异有显著性(P<0.05)。通过两两比较,模型组的活胎数明显低于假手术组与空白组(P<0.05),而假手术组与空白组的活胎数差异无显著性(P>0.05)(见表2)。

注:A:正常子宫内膜;B:异位子宫内膜;C:异位子宫内膜图4 子宫内膜异位症小鼠模型腹腔内异位症灶(标尺=300μm)Note.A:Normal endometrium;B:Ectopic endometrium;C:Ectopic endometriumFig.4 Ectopic endometriotic lesions in the abdominal cavity ofmodelmice.Bar=300μm.

图5 子宫内膜异位症小鼠模型异位症灶(标尺=100μm)Fig.5 Ectopic endometriotic lesions in themodelmice.Bar=100μm.

注:A正常内膜(标尺=50μm);B异位内膜(标尺=25μm)图6 正常内膜和子宫内膜异位症小鼠模型异位内膜Note.A:Normal endometrium(Bar=50μm);B:Ectopic endometrium(Bar=25μm.)Fig.6 Normal endometrium(A)and ectopic endometriotic lesions(B)in themodelmice.
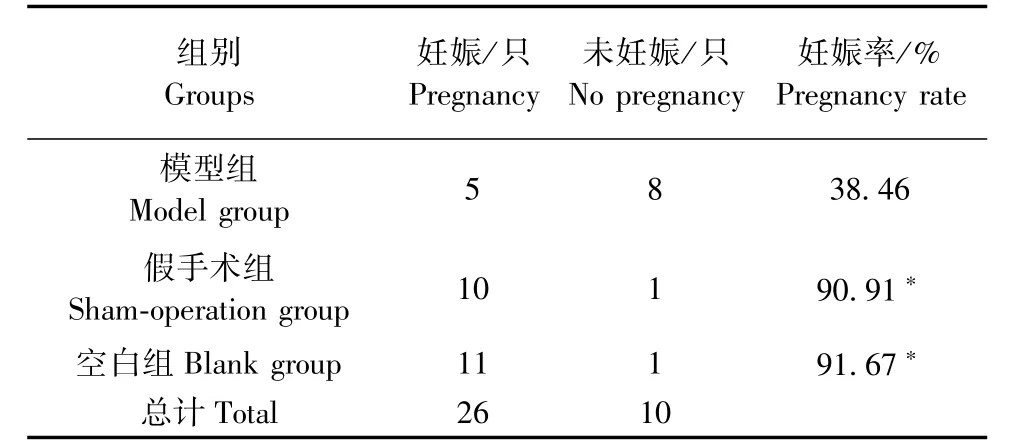
表1 三组妊娠率比较Tab.1 Comparison of pregnancy rates in the three groups

表2 各组活胎数比较Tab.2 Comparison of live embryo number in the three groups
3 讨论
内异症是一种常见的、多发的良性妇科疾病,具有侵袭性和复发性。子宫内膜异位症的最佳诊断方法为腹腔镜检查,而腹腔镜是有创性的检查。内异症这种疾病仅自发于人类和灵长类动物,因此,关于子宫内膜异位症的研究受到实际操作和伦理道德因素的限制而无法对子宫内膜异位症患者进反复进行创伤性检查,或进行具有侵袭性的EM对照试验研究。因此,动物模型则成为研究该内异症的一个主要方式及重要手段。目前,国内外EM动物模型在狒狒、猴、巴马香猪、兔、大鼠和小鼠等动物中都已有研究和发展。其中以兔和鼠最为常用,自发性EM动物模型以有月经周期的灵长类动物为实验动物,但因发病率低且代价昂贵而限制了在EM模型中的应用。诱发性EM动物模型以子宫内膜不发生脱落的动情动物为主,如:兔、鼠等。现有的模型大多是以自体移植诱导模型为主,移植方法是将动物自体的子宫内膜缝合到其腹膜、子宫系膜或肠系膜上,此法虽然能形成病灶且生长良好,但病灶深藏于动物腹腔体内,须进行二次手术进行探查。此法建立的动物模型不能保留完整子宫,限制了子宫内膜异位症关于子宫内膜、妊娠、胚胎方面的研究。为了减少动物内膜和人类内膜存在的种属和生化方面的差异,研究者故将免疫缺陷的裸鼠和严重联合免疫缺陷(SCID)小鼠作为实验研究对象,其模型建立方法是将人类的子宫内膜移植于小鼠腹腔[11,12]或皮下[13],模型成功率可高达100%。但裸鼠价格较高,且免疫缺陷小鼠不能用于免疫方面的研究。马丽等实验研究根据可靠的组织学观察发现,免疫功能正常的ICR小鼠模型建立成功率可达83.3%,小鼠在价格和免疫学[14]研究应用方面很大的优势。针对于大鼠和兔模型,小鼠模型在某些方面有极大优势。如小鼠对E2的敏感性要超过大鼠等。
本实验选用KM小鼠,因其动情周期短而规律、性成熟早、繁殖力强、生存及适应能力强,免疫功能正常,价格适宜。通过“腹腔+皮下”同种异体子宫内膜注射法建立EM小鼠模型。实验研究结果发现,假手术组的妊娠率和活胎数与空白组比较无明显差异(P>0.05),这表明小鼠的妊娠功能并未受到“腹腔+皮下”内膜注射法整个操作过程的影响。而利用此方法建立模型较传统开腹自体移植等造模方法相比,对动物创伤小,可在一定程度避免腹腔手术操作、线结异物刺激对盆腔微环境可能产生的影响,减少动物感染、死亡的发生。同时“皮下+腹腔”的叠加方法,不仅有利于观察异位病灶的生长带来方便,避免二次开腹探查,而且也不会脱离腹腔环境,使异位病灶依附于腹腔微环境之中。采用该方法建立的EM小鼠模型异位病灶肉眼可见,形态典型、易观察,病灶生长部位分散且易见粘连带,符合人类内异症的发病特征。经HE染色的病理组织学验证,其造模成功率可达90%以上,故以“腹腔+皮下”同种异体子宫内膜注射法建立EM KM小鼠模型是一种较优的动物模型。
本研究结果显示,模型组的妊娠率、活胎数均明显低于假手术组和空白组(P<0.05),假手术组的妊娠率和活胎数与空白组比较无明显差异(P>0.05),这表明从动物实验角度验证,内异症可降低小鼠的妊娠功能,通过本实验造模方法所建立的EM小鼠模型,既保留了小鼠的完整双子宫,又保持较强的生命活力,这与传统自体移植建模方法相比,该模型更适用于子宫内膜异位症相关不孕、生育能力、妊娠、辅助生殖及后续程序繁琐等实验研究,可作为内异症相关不孕研究的理想动物模型,为子宫内膜异位症相关不孕的基础研究提供了良好的研究手段和对象。
[1] 张惜阴.实用妇产科学[M].2版.北京:人民卫生出版社,2003:745ˉ749.
[2] Birmingham A.Endometriosis and infertility[J].Fertil Steril,2004,82(1):40ˉ45.
[3] Buyalos RP,Agarwal SK.Endometriosis-associated infertility[J].Curr Opin Obstet Gynecol,2000,12(5):377ˉ381.
[4] 崔阳阳,孙伟伟,赵瑞华.子宫内膜异位症模型小鼠胞饮突时间位点观察[J].辽宁中医杂志,2015,42(1):200ˉ202.
[5] 李靖,李炫诚,吴云霞.确定小鼠动情周期的三种方法[J].实验动物科学,2007,24(3):62ˉ64.
[6] 谭毅,顾美礼,王智彪,等.完整分离围着床期小鼠子宫内膜方法的建立[J].中国实验动物学报,2001,9(1):40ˉ44.
[7] 马丽,谢淑武,朱焰,等.注射法小鼠下下子宫内膜异位症模型及组织学观察[J].中国实验动物学报,2008,16(3):192ˉ195.
[8] 郭方,徐丛剑.腹腔注射甲氨蝶呤对小鼠异位内膜生长的影响[J].中国实用妇科与产科杂志,2007,23(9):692ˉ693.
[9] 高颖.子宫内膜异位症病理.见:曹泽毅主编.中华妇产科学.北京:人民卫生出版社,2004.1486ˉ1488.
[10] 刘光芒,吴德,张明,等.铁与维生素A水平对小鼠子宫分泌蛋白及胚胎存活率影响[J].动物营养学报,2007,19:392ˉ400.
[11] Van Langendonckt A,Casanas-Roux F,Eggermont J.Characterization of iron deposition in endometriotic lesions induced in the nude mousemodel[J].Hum Reprod,2004,19(6):1265ˉ1271.
[12] Nisolle M,Casanas-Roux F,Donnez J.Early-stage endometriosis:adhesion and growth of human menstrual endometrium in nudemice[J].Fertil Steril,2000,74(2):306ˉ312.
[13] Aoki D,Katsuki Y,Shimizu A,et al.Successful heterotransplantation of human endometrium in SCID mice[J].Obstet. Gynecol,1994,83(2):220ˉ228.
[14] Somigliana E,Vigano P,RossiG,etal.Endometriosis ability to implant in ectopic sites can be prevented by interleukin-12 in a murinemodel of endometriosis[J].Human Reprod,1999,14(12):2944ˉ2950
Fffects of endometriosis on the reproductive ability ofm ice
CUIYang-yang1.2,SUNWei-wei1,ZHAO Rui-hua1*,XU Cai1,WU Tian-si1,2
(1.Department of Gynecology,Guang'anmen Hospital,China Academy of Chinese Medical Sciences,Beijing 100053,China;2.Beijing University of Chinese Medicine,Beijing 100029)
ObjectivesThe aim of the study was to establish amousemodel of endometriosis,and to observe the effects of endometriosis on the reproductive ability in themice.M ethodsThemousemodels of endometriosiswas established by subcutaneous and intraperitoneal injection of heterogenous endometrium.The pregnancy rate and live embryo number in the experimental,sham operation and blank groupswere observed and compared,and the effects of endometriosis on reproductive ability of themice were evaluated.ResultsTwo weeks after the establishment of the mouse model of endometriosis,there were lesions in the peritoneal cavity and subcutaneous tissue of the mice.Compared the pregnancy rates among themodel group,sham operation group and blank group,the differences were statistically significant(P<0.05).Compared the live embryo number in the three groups,there were also significant differences(P<0.05).ConclusionsA mousemodel of endometriosis is successfully established,and it demonstrates that endometriosismay affect the reproductive ability ofmice.
Endometriosis;Mouse;Reproductive ability
Q95-33
A
1005-4847(2015)05-0479-05
10.3969/j.issn.1005ˉ4847.2015.05.007
2015-05-05
国家自然科学基金(No:81173297)。
崔阳阳(1987年ˉ),女,硕士,专业:中医妇科学。Tel:18810465649,E-mail:cuiyang870216@163.com
赵瑞华,女,博士生导师,研究方向:子宫内膜异位症、不孕症、月经失调方向。Tel:010-88001139,E-mail:rhzh801@126.com
