脂多糖联合MPTP诱导的小鼠慢性帕金森病模型的评价
2015-05-25史肖锦屈洪党
史肖锦,屈洪党
(蚌埠医学院第一附属医院神经内科,安徽蚌埠 233000)
研究报告
脂多糖联合MPTP诱导的小鼠慢性帕金森病模型的评价
史肖锦,屈洪党*
(蚌埠医学院第一附属医院神经内科,安徽蚌埠 233000)
目的建立脂多糖(lipopolysaccharide,LPS)联合1-甲基-4-苯基-1,2,3,6-四氢吡啶(1-methyl-4-phenyl-1,2,3,6-tetrahydropyridine,MPTP)诱导的慢性小鼠帕金森病模型,探讨其行为学和黒质多巴胺能神经元细胞的变化情况。方法将20只C57BL/6小鼠随机分为模型组和对照组,模型组每日腹腔注射LPS(0.25 mg/kg)一次,连续3 d,最后一次注射LPS 4 h后,每日腹腔注射MPTP(25 mg/kg)一次,连续2 d,对照组腹腔注射相同量的生理盐水。8周后用步态分析和转棒实验评价小鼠的行为学能力,免疫组化法观察黑质酪氨酸羟化酶(TH)阳性细胞变化情况。结果模型组小鼠行为学变化较对照组差异有显著性(P<0.05),模型组小鼠中脑黒质区显示出严重的神经元细胞损伤。结论LPS联合MPTP腹腔注射可成功诱导出慢性小鼠帕金森病模型,提示该模型可用于帕金森病的发病机制及药物治疗效果等相关研究。
LPS;MPTP;帕金森病;小鼠模型;酪氨酸羟化酶
帕金森病(Parkinson’s disease,PD)是一种常见的神经系统退行性疾病,其主要的病理改变为黑质多巴胺能神经元的进行性丢失和残留的神经元胞浆中路易小体形成[1]。最近的研究假设PD的发病机制可能涉及到多个起因,包括(但不局限于)暴露于环境的神经毒素(如农药、重金属)、遗传学、生活习惯(如农村生活环境)和氧化应激,免疫炎症反应也涉及到PD病因学[2,3]。且炎症不再被认为仅仅是神经退病变过程的一个附带现象,相反它是一个活跃的贡献者[4]。目前对PD病因和病理生理机制的认知,主要来源于PD动物模型,因此模拟出一个能反映PD的发病机制、病理学和行为学方面动物模型,是一个有待解决的问题。目前MPTP和6-OHDA等均是单一因素下诱导的PD模型,凋亡的多巴胺神经元可在短时间内自发恢复至正常,且仅仅一个因素并不能必然导致人类慢性多巴胺的耗竭[5]。细菌内毒素脂多糖(lipopolysaccharide,LPS)诱导一系列的炎症反应,通过激活迷走神经的传入纤维及中枢神经系统中促炎性细胞因子IL-1β、IL-6和TNF-α等,进而激活中枢炎症过程[6]。研究表明,LPS预处理后应用MPP+(MPTP,1-methyl-4-phenyl-1,2,3,6-tetrahydropyridine的代谢毒物),结果显示LPS预处理组动物模型的纹状体DA持续性减少,超过单独应用MPP+组,且持续的时间也较长,表明LPS和MPTP共同作用可放大神经退行性变的过程[7]。本实验通过注射LPS诱导系统性炎症后,继续注射低剂量的MPTP诱导出慢性PD模型,观察其行为学和黒质多巴胺神经元细胞的改变情况,证实其更符合PD的缓慢进行性发病的过程,可成为研究PD的可靠动物模型。
1 材料与方法
1.1 材料
1.1.1 实验动物
SPF级雄性12周龄的C57BL/6J小鼠,20只,体重25~27 g,购自扬州大学比较医学中心【SCXK(苏)2012-004】,饲养于蚌埠医学院SPF级实验动物中心【SYXK(皖)2012-002】,标准饲养盒内饲养,每盒5只。温度控制在18~22℃,自由饮水和摄食,并保持12 h/12 h昼夜循环。
1.1.2 试剂
脂多糖,MPTP,兔抗酪氨酸羟化酶抗体,生物素标记的二抗,均购自Sigma(美国)。
1.2 方法
1.2.1 动物模型
20只C57BL/6J小鼠适应性饲养1周,随机分为空白对照组和模型组,每组10只。模型组小鼠每日腹腔注射LPS(0.25mg/kg)一次,连续3 d。最后一天注射LPS 4 h后,继续腹腔注射MPTP(25 mg/kg)一次,连续2 d,相当于LPS注射3次,MPTP注射2次。空白对照组腹腔注射相同体积的生理盐水。
1.2.2 行为学检测
(1)步长分析
自制一个长1 m、宽10 cm、高20 cm的单向通道,用同样长宽的宣纸铺在通道的底部,训练小鼠穿过通道以测量步长。将小鼠的两后脚掌涂抹墨汁,放于通道的入口,到达另一端出口后其脚印便留在纸上,测量小鼠同侧身体两个脚印的距离,计算出平均步长。通道的开始和结束的步幅长度均不列入计算,因为小鼠在开始行走时会加速步幅不规则,而出口小鼠为了逃离通道步幅会变小。
(2)转棒实验
将小鼠置于直径为3 cm的旋转杆上,转速调整为20 r/min,每次同时测定5只小鼠,每个隔室中1只。记录小鼠从转棒开始转动至掉离转棒所经历的时间,测定时间为5 min,共测5次取平均值,同一只小鼠检测间隔为30 min。
(3)游泳实验
将小鼠单独放入一40 cm×25 cm×16 cm的有机玻璃箱中测试器游泳分数,水深为12 cm,水温为(27±2)℃。评分标准如下:3分,3 min内连续不断的游泳;2分,大部分时间游泳偶尔漂浮;1分,偶尔游泳;0分,四肢无活动。
1.2.3 免疫组化染色检测小鼠黒质酪氨酸羟化酶(tyrosine hydroxylase,TH)的表达
(1)制作中脑黒质石蜡切片
对小鼠进行水合氯醛麻醉,用生理盐水灌流,4%多聚甲醛灌注内固定,剥离出完整的脑组织浸入多聚甲醛中固定24 h。进行梯度脱水、透明、石蜡包埋,在中脑黑质区连续冠状石蜡切片,选取5张切片行TH免疫组织化学染色。
(2)免疫组化步骤
烘片,二甲苯脱蜡、梯度乙醇脱水,0.01 mmol/L 3%过氧化氢室温下反应10 min,磷酸盐缓冲液(PBS)冲洗3次×5 min,抗原修复,高火2 min,使其快速达到95℃左右,低火维持12~14 min,自然冷却至室温,PBS冲洗3次,每次5 min。5%羊血清37℃封闭,去掉多余羊血清,加入一抗4℃过夜,37℃复温1 h,PBS冲洗3次,每次5 min。加入生物素标记二抗,37℃室温下反应1 h,PBS冲洗3次,每次5 min。DAB显色,复染,梯度乙醇脱水,二甲苯透明,封片,拍照。
1.3 统计分析方法
采用SPSS 16.0进行数据分析,实验数据均采用均数±标准差表示,两组数据采用独立样本t检验进行比较,以P<0.05有统计学意义。
2 结果
2.1 各组小鼠步长分析、转棒实验和游泳实验的比较
8周末进行的行为学检测,与对照组相比,模型组小鼠平均步长明显减少、在转棒上的时间明显缩短、游泳分值明显下降,P均<0.05,差异具有统计学意义(见表1)。
表1 各组小鼠步长和转棒实验数据结果比较(±s,n=10)Tab.1 The stride length and rotarod performance in the mice of each group
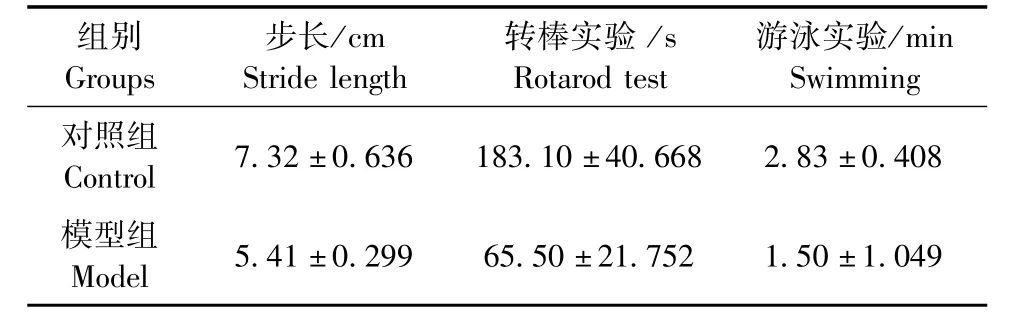
表1 各组小鼠步长和转棒实验数据结果比较(±s,n=10)Tab.1 The stride length and rotarod performance in the mice of each group
组别G r o u p s游泳实验/ m i n S w i m m i n g对照组C o n t r o l 7 . 3 2 ± 0 . 6 3 6 1 8 3 . 1 0 ± 4 0 . 6 6 8 2 . 8 3 ± 0 . 4 0 8模型组M o d e l 5 . 4 1 ± 0 . 2 9 9 6 5 . 5 0 ± 2 1 . 7 5 2 1 . 5 0 ± 1 . 0 4 9步长/ c m S t r i d e l e n g t h转棒实验/ s R o t a r o d t e s t
2.2 黒质酪氨酸羟化酶免疫组化结果
与正常对照组小鼠相比,模型组小鼠中脑黒质区显示出严重的神经元损伤,多巴胺神经元细胞明显减少,且表现出更多的神经元细胞的萎缩和损坏,细胞体积变小,突起变短,纤维少而稀疏(见图1)。
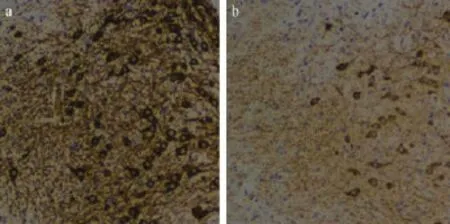
注:a:对照组;b:模型组。图1 中脑黑质TH免疫组织化学检测(×100)Note.a:Control;b:ModelFig.1 Representative photomicrographs of TH-immunoreactive neurons in the substantia nigra ofmouse brain(×100)
3 讨论
PD是一种与年龄相关的神经退行性疾病,越来越多的研究显示炎症与黑质多巴胺能神经元凋亡的相关性[8]。尸检报告显示PD患者中脑黒质多巴胺神经元凋亡与小胶质细胞形态学改变和促炎因子的退化均有关[9],但是其具体的机制仍未明确[10]。为了更好的研究PD的发病机制及相应的治疗策略,模拟出一个能反应PD的发病机制、病理学和行为学方面的慢性PD动物模型,是一个急需解决的问题。目前的6-OHDA和MPTP诱导的PD模型均为单一定点注射直接损毁小鼠中脑黑质多巴胺,不能很好的模拟PD慢性的发病过程。研究表明[11],PD神经系统进行性退化可能始发于黒质以外的其他神经系统,故利用神经毒素联合注入黒质以外的部位诱导的小鼠帕金森病模型,引起越来越多的人关注。
LPS是一种内毒素[12,13],对神经元无毒性作用,但它可诱导强大的先天免疫反应,激活小胶质细胞,释放一系列的细胞炎症因子,导致黑质纹状体通路损害和帕金森病行为学症状。MPTP[14]为高亲脂性化合物,能有效的通过血脑屏障,主要被小胶质细胞识别,被单胺氧化酶氧化成MPDP+,随后自氧化成毒素MPP+。MPP+被DA神经元摄取,阻断线粒体复合酶I的活性,大幅度增加氧化应激的水平,从而导致纹状体多巴胺水平下降,并逐渐导致中脑黒质致密部多巴胺神经元的死亡。研究表明LPS可能会影响血脑屏障,从而影响大脑中MPTP的浓度,系统性注射LPS可以提高MPTP的毒性[15]。且Gao等[16]认为注射LPS后继续注射MPTP会产生一种协同作用,后Byler等[5]利用LPS联合MPTP腹腔注射成功诱导出慢性帕金森病小鼠模型,然而这种模型在国内并未引起广泛关注。
本研究利用LPS联合小剂量的MPTP作用于C57BL/6J小鼠诱导慢性帕金森模型,8周末行为学检测显示模型组小鼠步长、转棒时间和游泳分值较对照组均下降,TH免疫组化结果显示模型组中脑黒质TH阳性细胞数量较对照组减少,且神经元细胞体积变小,突起变短,纤维少而稀疏。提示LPS联合小剂量的MPTP腹腔注射可成功诱导出PD小鼠模型,且更符合PD的缓慢发病过程,说明此种模型可用于帕金森病的病因、病理生理机制及药物治疗效果的研究。
研究表明[17],6-OHDA和MPTP诱导的PD小鼠模型仅导致纹状体多巴胺短时的减少,可很快恢复至正常水平,且缺乏相应的行为学改变,而LPS联合MPTP模小鼠型步长缩短及黒质纹状体多巴胺减少至少可持续4个月。本研究结果与这一观点相符合,LPS联合MPTP小鼠模型步长缩短及黒质多巴胺神经元损伤较严重,持续时间较长,且该模型未出现小鼠死亡或者诱导运动功能减退失败的情况。步长缩短是帕金森病患者身上的主要特征[18,19],故利用步长测定进行行为学检测,更能反应帕金森小鼠模型的行为学改变情况。
总之,LPS联合MPTP腹腔注射可成功诱导出帕金森病小鼠模型,该模型可用于PD的发病机制和病理生理变化的研究,也可为研究药物的治疗效果提供合适的动物模型。以后可以对小胶质细胞增生、促炎因子的表达以及突触核蛋白的聚集的情况做出进一步研究。
[1] Lazzarini M,Martin S,MitkovskiM,etal.Doxycycline restrains glia and confers neuroprotection in a 6-OHDA Parkinson model[J].Glia,2013,61:1084ˉ1100.
[2] 孟凛冽,李峰,伞勇智,等.帕金森病氧化应激机制及抗氧化药物治疗进展[J].现代生物医学进展,2015(2):380ˉ 383.
[3] 王茜,张辉,刘名,等.小白菊内酯对帕金森病小鼠模型黑质多巴胺能神经元的保护作用[J].神经解剖学杂志,2014,30(3):357ˉ362.
[4] 王玲.α-synuclein诱导的神经炎症在帕金森病发生中的作用[D].南京医科大学,2013.
[5] Byler SL,Boehm GW,Karp JD,et al.Systemic lipopolysaccharide plusMPTP as amodel of dopamine loss and gait instability in C57Bl/6Jmice[J].Behav Brain Res,2009,198(2):434ˉ 439.
[6] 杨绍松,陶凯,逯芳芳,等.iNOS在LPS诱导活化小胶质细胞中的表达变化[J].神经解剖学杂志,2014,30(6):666 ˉ670.
[7] Goralski KB,Renton KW.Brain inflammation enhances 1-methyl-4-phenylpyridinium-evoked neurotoxicity in rats[J].Toxicol Appl Pharmacol,2004,196:381ˉ389.
[8] Anitua E,Pascual C,Pérez-Gonzalez R,etal.Intranasal PRGFEndoret enhances neuronal survival and attenuates NF-κB-dependent inflammation process in a mouse model of Parkinsonˊs disease[J].JControlled Release,2015,203:170ˉ180.
[9] 王岚,沈伟.美满霉素对脂多糖诱导的BV-2小胶质细胞肿瘤坏死因子-α表达的影响[J].临床神经病学杂志,2014,27(4):286ˉ288.
[10] Hu Y,Yu SY,Zuo LJ,etal.Parkinson disease with REM sleep behavior disorder features,α-synuclein,and inflammation[J]. Neurology,2015,84(9):888ˉ894.
[11] Del Tredici K,Jost WH.[Gastrointestinal dysfunction in idiopathic Parkinsonˊs disease][J].Der Nervenarzt,2012,83(10):1282ˉ1291.
[12] Gao H M,Zhang F,Zhou H,et al.Neuroinflammation andαsynuclein dysfunction potentiate each other,driving chronic progression of neurodegeneration in a mouse model of Parkinsonˊs disease[J].Environ Health Persp,2011,119(6):807.
[13] 郭玉霞,杨波,石磊,等.姜黄素对中脑定位注射脂多糖引起帕金森样病变小鼠的抗炎机制研究[J].医学研究生学报,2012,25(6):582ˉ587.
[14] 陈浩,师亮,王燕宏,等.甘草黄酮对MPTP帕金森病小鼠的实验性治疗研究[J].中风与神经疾病杂志,2013,12:1112ˉ1113.
[15] Lecca D,Nevin DK,Mulas G,et al.Neuroprotective and antiinflammatory properties of a novel non-thiazolidinedione PPARγ agonist in vitro and in MPTP-treated mice[J].Neuroscience,2015,302:23ˉ35.
[16] Gao HM,Liu B,ZhangW,etal.Synergistic dopaminergic neurotoxicity of MPTP and inflammogen lipopolysaccharide:relevance to the etiology of Parkinson’s disease[J].FASEB J,2003,17(13):1957ˉ1959.
[17] Tillerson JL,Caudle WM,Reverón ME,et al.Detection of behavioral impairments correlated to neurochemical deficits in mice treated withmoderate doses of1-methyl-4-phenyl-1,2,3,6-tetrahydropyridine[J].Exp Neurol,2002,178(1):80ˉ90.
[18] 文龙,钱晋武,沈林勇,等.帕金森病患者步态测量与定量分析[J].中国康复医学杂志,2014,29(7):637ˉ641.
[19] 李利,刘晶,罗蔚锋,等.帕金森病冻结步态研究进展[J].中华神经科杂志,2014,47(8):565ˉ567.
Evaluation of a mouse model of Parkinson’s disease induced by lipopolysaccharide plus MPTP
SHIXiao-jin,QU Hong-dang
(the First Affiliated Hospital of Bengbu Medical College,Bengbu 233000,China)
ObjectiveThe aim of this study was to establish a mouse model of chronic Parkinson’s disease induced by systemic administration of lipopolysaccharide plus1-methyl-4-phenyl-1,2,3,6-tetrahydropyridine(MPTP),and to study the changes of behavioral manifestation,numbers of dopaminergic neurons in the substantia nigra pars compacta.M ethodsTwenty C57BLmice were randomly divided into 2 groups:the saline control group and model group.Themice in themodel group received three intraperitoneal(i.p.)injections of LPS(0.25mg/kg),once daily for three consecutive days.Four hours following the final LPS injection,the mice received one subcutaneous injection of low-dose MPTP(25 mg/kg).Themice of controlgroup were injected with the same volume of saline.Eightweeks later,themotor ability of the mice was evaluated by footprint test and rotarod test.The tyrosine hydroxylase(TH)-positive cellswere observed by immunohistochemical analysis.ResultsCompared with the control group,the scores of behavioral testwere significantly lower,numbers of TH immunoreactive cells were significantly less in the Parkinson’smodel group(P<0.05).ConclusionsBehavioralmanifestation,number of dopaminergic neurons in the substantia nigra are significantly changed in the mouse models of Parkinson’s disease produced by repeated injection of LPSplus MPTP,suggesting that this chronic animalmodel can be used in the experimental study for pathogenesis and therapy of Parkinson’s disease.
Lipopolysaccharide,LPS;MPTP;Parkinson’s disease(PD);Ratmodel;Tyrosine hydroxylase
Q95-33
A
1005-4847(2015)05-0513-04
10.3969/j.issn.1005ˉ4847.2015.05.014
2015-05-20
蚌埠医学院研究生创新计划项目(Byycx1406);教育厅重点项目(KJ2014A163)。
史肖锦(1988ˉ),女,蚌埠医学院硕士研究生,研究方向:神经病学。Email:137481290@qq.com
屈洪党,男,主任医师, 研究方向:神经病学的临床、科研和教学工作。Email:qhd820@souhu.com