多发性硬化实验动物模型研究进展
2015-05-25李迎霞关东升任德启郭健吴川杰
李迎霞,关东升*,任德启,郭健,吴川杰
(1.河南中医学院第二临床医学院,郑州 450008;2.郑州大学第一附属医院,郑州 450003)
研究进展
多发性硬化实验动物模型研究进展
李迎霞1,关东升1*,任德启1,郭健1,吴川杰2
(1.河南中医学院第二临床医学院,郑州 450008;2.郑州大学第一附属医院,郑州 450003)
实验性自身免疫性脑脊髓炎(experimental autoimmune encephalomyelitis,EAE)是多发性硬化的实验动物模型,经过近2个多世纪的发展,已可以在猴、大鼠、小鼠等动物制备EAE模型,在同一种品系动物采用不同免疫抗原制备的EAE模型在敏感性和临床特点具有多样性。本研究就EAE的发展史和目前不同品系实验动物、不同抗原制备EAE模型的特点做一述评,对未来EAE模型的发展前景进行探讨。
多发性硬化;实验性自身免疫性脑脊髓炎;模型,动物
实验性变态反应性脑脊髓炎(experimental allergic encephalomyelitis,EAE)亦称实验性自身免疫性脑脊髓炎(experimental autoimmune encephalomyelitis,EAE)。以中枢神经系统内小血管周围出现单个核细胞浸润及髓鞘脱失为病理特征,由于EAE病理改变与人类多发性硬化(MS)相似,而使其成为MS的理想动物模型,在MS的研究中具有重要意义。
1 实验性自身免疫性脑脊髓炎模型的发展
自18世纪30年代以来,EAE被广泛应用于MS的实验研究[1]。EAE在免疫学特征、发病特点和病理学特征上与人类MS的表现非常相似[1ˉ9]。目前,可以通过用组成髓鞘的多肽致敏和病毒感染两种方式建立EAE模型。最早的EAE模型是使用同种/异种脊髓匀浆(SCH)作为免疫原诱导建立的[1ˉ3]。Rivers等[1]第一次进行了实验性变态反应性脑脊髓炎的研究,使用兔的脑组织SCH为免疫原,肌肉注射于猴,制备出最早的实验性变态反应性脑脊髓炎。1946年,首次使用SCH抗原乳化于完全弗氏佐剂(含有灭活的结核杆菌),混合成油包水乳状液,注射于实验动物,制备出EAE模型,这种急性脑脊髓炎可以持续数周,这即是目前已知最早的EAE[4ˉ6]。早期的研究证明,在SCH中导致脑脊髓炎的主要抗原是髓磷脂碱性蛋白(MBP)。1960年,Paterson[5]通过被动给予来自致敏动物的特异性脑脊髓炎抗原激活的T细胞,建立了被动免疫的EAE。在啮齿动物身上至今尚未观察到自发的EAE。在啮齿动物,EAE或被动免疫的EAE可以观察到一个上升性瘫痪状态,开始与尾部张力降低,后肢瘫痪和迟缓性死亡。
2 实验性自身免疫性脑脊髓炎的免疫原
Theiler’s病毒、中枢神经系统SCH或乳化于弗氏佐剂的中枢神经系统特异性抗原均可在不同品系的实验动物及其同种品系的不同实验动物上诱导EAE。常见的建立EAE的抗原包括髓磷脂碱性蛋白(MBP),蛋白脂质蛋白质(PLP),髓鞘相关糖蛋白(MAG),髓鞘少突胶质细胞糖蛋白(MOG),某些非髓性蛋白,如神经原蛋白、胶原纤维酸蛋白也参与EAE的发病[6ˉ10]。这些抗原可以引起强烈的细胞毒性T细胞介导的反应。
SCH中致敏的主要抗原是MBP,而MBP占髓鞘蛋白的30%~40%[11],30%~40%的MBP在髓鞘。H-2u小鼠,尤其是B10.PL和PL/J系,Lewis大鼠,是对MBP高度敏感的品系[12]。对C57BL/6(B6)是最常见的小鼠品系之一,对MBP不敏感[13]。
另外,EAE也可以通过被动转移特异性T细胞获得。在同一品种的动物之间,这些被转移的特异性T细胞迁移到被动免疫实验动物的中枢神经系统,参与局部炎症和继发性瘫痪。而且,这种能引起被动EAE的脑脊髓炎特异性T细胞,并不需要从敏感品系获得,非敏感品系的脑脊髓炎特异性T细胞也可以诱导[14]。
3 诱导FAF的易感性与动物种类的关系
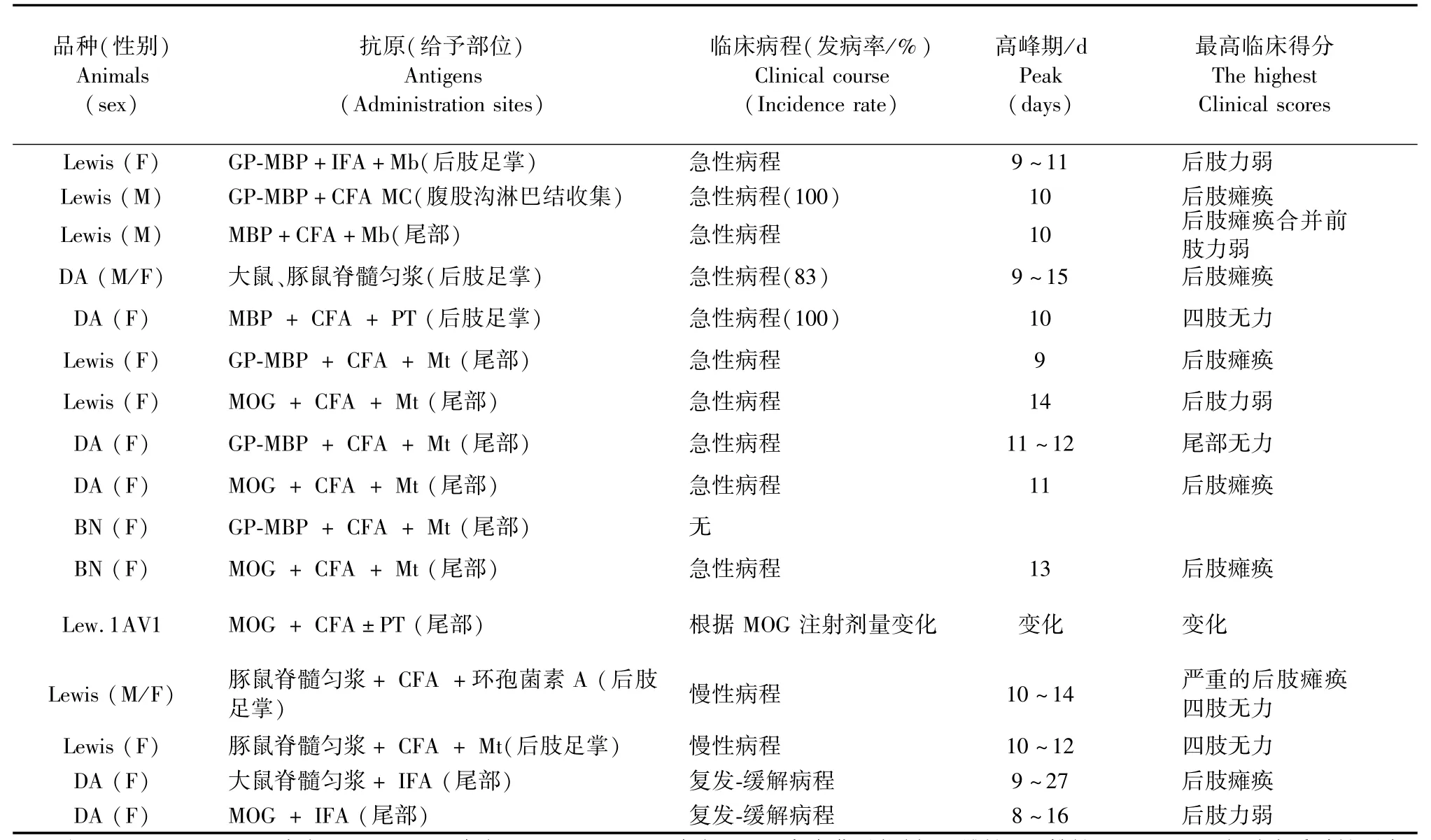
表1 不同研究方案建立大鼠EAE模型的特点[10ˉ19]Tab.1 Characteristics of the rat EAEmodels established by different studies
EAE的敏感性和临床过程的特点(急性,超急性,慢性或复发缓解),取决于以下因素,如实验动物的动物品种、年龄、性别,甚至动物的商业来源;抗原、及其剂量、物理状态及给药途径;免疫佐剂的应用。表1、2描述了影响EAE发病特点的研究结果。
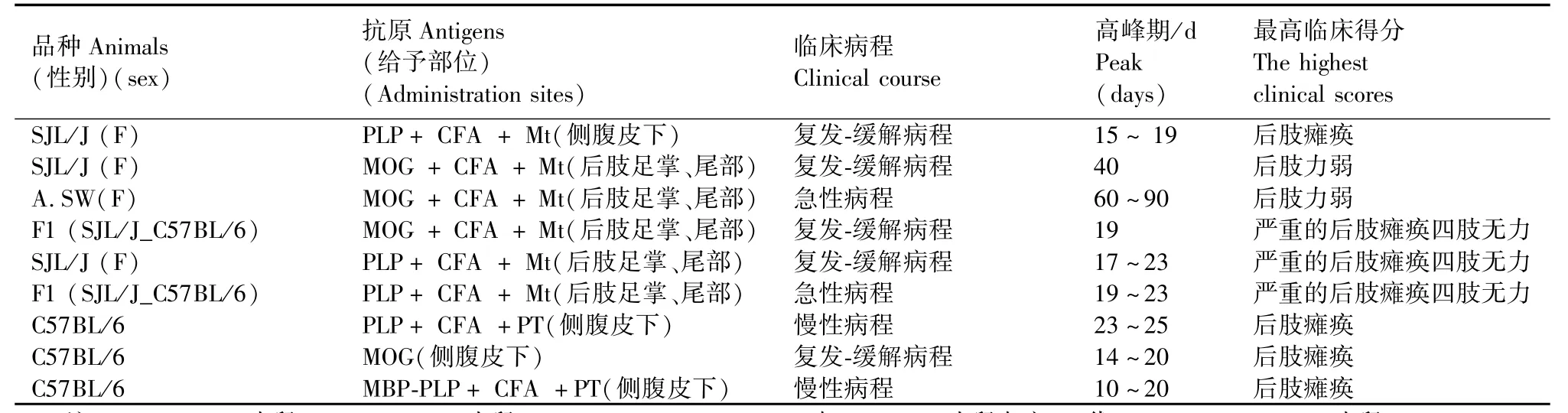
表2 不同研究方案建立小鼠EAE模型特点[10ˉ19]Tab.2 Characteristics of themouse EAEmodels established by different regimens
不同品种和不同品系的实验动物诱导EAE的易感性和临床特点不同,这归因于主要组织相容性复合体基因的多样性表达[13]。从这个角度来讲,每种动物建立的EAE模型在MS的研究中都具有一定的意义。在过去30年中,大鼠和小鼠是建立EAE最多的实验动物。如表2所示大鼠自行恢复的急性病程的EAE,提供了研究有关诱导和恢复阶段的机制的模型。有些大鼠品系即使给予低剂量抗原的情况下,仍然显示可预测的临床症状和统一的敏感性[16]。大鼠EAE的病理学特征为在脊髓、脑干和脑实质的血管周围单个核细胞浸润。大鼠EAE不同与人类MS的主要特点是髓鞘脱失对大鼠的影响是微乎其微的。因此,引起瘫痪的最重要很可能是水肿和炎症[17]。而小鼠的病理学特点与人类相似[18],在慢性进展型病程和复发缓解型病程上均可见脱髓鞘特征。小鼠建立EAE的优点还包括的敏感品系较多,可用的实验试剂较多,在转基因小鼠上研究遗传学的易感性。
小鼠建立EAE的主要缺陷是相对于易感大鼠,小鼠通常更难以诱导EAE,小鼠对EAE相对抵抗,体现为发病率和发病时间的差异,以及需要佐剂辅助诱发疾病。除了使用百日咳毒素作为辅助补充外,往往需要多次注射高剂量的抗原[15]。
使用灵长类动物(如恒河猴和狨猴),在遗传学和免疫学上具有接近人类的优势[20]。在灵长类动建立EAE,主要表现为慢性病程,急性炎症和脱髓鞘,伴随不断形成新的免疫活性受伤[21]。但使用MBP和MOG诱导灵长类(猕猴)动物,表现为急性病程。病理以广泛的中性粒细胞浸润、坏死、白质破坏,从而影响髓鞘及轴突[22]。狨猴对重组、人类MOG和完全福氏佐剂的乳剂高度易感,相比之下,无百日咳毒素的MBP是一种弱抗原[23]。
4 CFA在FAF建立过程中的影响
大多数EAE模型的建立方案中均采用完全弗氏佐剂(complete Freun’s adjuvant,CFA),CFA是多种研究中最常应用的免疫佐剂,佐剂的作用是通过降低机体对抗原的破坏,从而延迟机体对抗原的免疫耐受。促进抗原的弥散,使抗原逐渐而持续的对机体发挥免疫原性。另外,在EAE模型的建立方案中多采用分歧杆菌,以扩大免疫效应,导致淋巴结增生,主要激发T细胞介导的免疫反应[5,6]。
不论是皮下或者皮内注射CFA,均有助于促进细胞免疫反应的强度。从而激发多种自身免疫性疾病。然而,单独使用CFA本身就能够诱导强烈的炎症反应,产生众多的免疫调节功能,甚至导致局部皮肤的肉芽肿和坏死。将CFA注射入动物足掌底部时,CFA能够引起局部慢性疼痛,潜藏有慢性伤害感受性的机制,可以用于慢性疼痛的研究。鉴于此,在EAE模型建立过程中,注射CFA时,应当采用合理的方案,选用恰当的剂量和适宜的部位。CFA还可以提高EAE模型血脑屏障(blood-brain barrier,BBB)的通透性和导致CNS血管周围血清蛋白渗出[21]。
在没有CFA的情况下,使用MBP抗原腹腔注射免疫Lewis大鼠,需要重复注射抗原的同时使用次氯酸钠预治疗(增加淋巴节对MBP的吸收程度)和百日咳毒素作为免疫佐剂。另一个方案是直接注射MBP水溶液到腘窝淋巴结,并且于致敏前3周给予金属锡作为致敏剂。
5 发展新的FAF模型的原则
EAE与人类MS尚存在一定的差距,要建立能够更好的反映人类MS发病机制的EAE模型,必须注意以下几点[24,25]:①人类与实验动物在遗传学上的差异,虽然鼠类和狨猴等实验动物与人同属哺乳动物,但是在遗传学上还是有巨大的差异;②MS的发病与环境密切相关;③MS临床病程的特点:建立与人类MS临床病程特点更加吻合的EAE模型;④病理机制:MS的病理特征是其区别与其他疾病的最主要特征;⑤临床治疗反应:建立EAE的最终目的是治疗MS,因此,建立的EAE要能够反映MS的临床治疗反应。遗传学上的差异在任何实验动物上均存在。目前,研究者几乎不可避免的使用近交系动物,然而临床治疗反应才是决定药物安全性、有效性、代谢的主要因素。
综上所述,EAE模型的建立是涉及多因素研究工作,选用实验动物,抗原、佐剂以及抗原给予部位等因素均能够影响EAE模型的发病特点及其病理变化。研究出能够真实、准确还原人类MS特点的EAE,是EAE研究发展的最终目标。与此同时,研究者需要根据研究目的选择恰当的EAE建立方案。
[1] Rivers TM,Schwentker FF.Encephalomyelitis accompanied by myelin destruction experimentally produced in monkeys[J].J Exp.1935,61(5):689ˉ702.
[2] Levine S,SowinskiR.Experimental allergic encephalomyelitis in inbred and outbred mice[J].J Immunol,1973,110(1):139–143.
[3] Simone A.Teixeira,Ana A.etal.Experimental autoimmune encephalomyelitis:a heterogeneous group of animalmodels to study human multiple sclerosis.[J].Inflamm Infect Dis.2005,2(2):127ˉ134.
[4] Steinman L,Zamvil SS.How to successfully apply animal studies in experimental allergic encephalomyelitis to research on multiple sclerosis[J].Ann Neurol,2006,60(1):12ˉ21.
[5] Paterson PY.Transfer of allergic encephalomyelitis in rats by means of lymph node cells[J].JExp Med,1960,111(1):119–136.
[6] Levine S.Experimental allergic encephalomyelitis production by myelin basic protein adsorbed on particulate adjuvants[J].Immunology,1972,23(4):609ˉ614.
[7] Raivicha G,Banati R.Brainmicroglia and blood-derived macrophages:molecular profiles and functional roles inmultiple sclerosis and animalmodels of autoimmune demyelinating disease[J]. Brain Res Rev,2004,46(3):261ˉ281.
[8] Friese MA,Montalban X,Willcox N.etal.The value of animal models for drug development in multiple sclerosis[J].Brain,2006,129(Pt8):1940ˉ1952.
[9] Schluesener HJ,Sobel RA,Linington C.et al.A monoclonal antibody againstamyelin oligodendrocyte glycoprotein induces relapses and demyelination in central nervous system autoimmune disease[J].J Immunol1987,139(12):4016ˉ4021.
[10] Petzold A,Baker D,Pryce G,et al.Quantification of neurodegeneration bymeasurement of brain-specific proteins[J].JNeuroimmunol,2003,138(1ˉ2):45ˉ48.
[11] MartensonRE,DeiblerGE,Kies MW.Myelin basic proteins of the rat central nervous system.Purification,encephalitogenic properties,and amino acid compositions[J].Biochim Biophys Acta,1970,200(2):353ˉ362.
[12] WekerleH,KojimaK,Lannes-Vieira J,et al.Animalmodels.Ann Neurol,1994,36(Suppl):S47ˉS53.
[13] 关东升,高颖,朱陵群.C57BL/6J小鼠实验性自身免疫性脑脊髓炎模型的建立及其病理特征[J].中国实验动物学报,2008,6(16):406ˉ409.
[14] StromnesIM,GovermanJM.Passive induction of experimental allergic encephalomyelitis[J].Nat Protoc,2006,1(4):1952ˉ 1960.
[15] Pappalardo LW,Liu S,Black JA.et al.Dynamics of sodium channel Nav1.5 expression in astrocytes in mousemodels ofmultiple sclerosis[J].Neuroreport.2014,25(15):1208ˉ1215.
[16] Savarin C,Hinton DR,Valentin-Torres A,et al.Astrocyte response to IFN-γlimits IL-6-mediated microglia activation and progressive autoimmune encephalomyelitis[J].J Neuroinflam,2015,12(1):79ˉ86
[17] Liu Z,Xu Y,Zhang X,et al.The motorized RhoGAP myosin IXb(Myo9b)in leukocytes regulates experimental autoimmune encephalomyelitis induction and recovery[J].JNeuroimmunol. 2015,15(282):25ˉ32.
[18] Abramowski P,Steinbach K,Zander AR,etal.Immunomodulatory effects of the ether phospholipid edelfosine in experimental autoimmune encephalomyelitis[J].JNeuroimmunol.2014,274(1ˉ2):111ˉ124.
[19] Sakuma H,Kohyama K,Park IK,et al.Clinicopathological study of amyelin oligodendrocyte glycoprotein-induced demyelinating disease in LEW.1AV1 rats[J].Brain,2004,127(10):2201ˉ2213.
[20] Ovadia H,Siegal T,Weidenfeld J.Delayed central nervous system irradiation effects in rats—part2:aggravation of experimental autoimmune encephalomyelitis[J].Neuroimmunomodulation,2013,20(1):51ˉ56.
[21] Laman JD,van Meurs M,Schellekens MM,et al.Expression of accessory molecules and cytokines in acute EAE in marmoset monkeys(Callithrixjacchus)[J].JNeuroimmunol,1998,86(1):30ˉ45.
[22] StewartWA,Alvord EC Jr,Hruby S,et al.Magnetic resonance imaging of experimental allergic encephalomyelitis in primates[J].Brain,1991,114(Pt2):1069ˉ1096.
[23] Brok HP,Uccelli A,Kerlero De Rosbo N,et al.Myelin/oligodendrocyte glycoprotein-induced autoimmune encephalomyelitis in common marmosets:the encephalitogenic T cell epitope pMOG24 ˉ36 is presented by amonomorphic MHC class IImolecule[J]. J Immunol,2000,165(2):1093ˉ1101.
[24] LassmannH,BruckW,Lucchinetti C.Heterogeneity of multiple sclerosis pathogenesis:implications for diagnosis and therapy[J].Trends Mol Med,2001,7(3):115ˉ121.
[25] Sriram S,SteinerI.Experimental allergic encephalomyelitis:a mis-leadingmodel ofmultiple sclerosis[J].Ann Neurol,2005,58(6):939ˉ945.
Research progress of animalmodels ofmultiple sclerosis
LIYing-xia1,GUAN Dong-sheng1,REN De-qi1,GUO Jian1,WU Chuan-jie2
(1.Henan University of Traditional Chinese Medicine,Zhengzhou 450008,China,2.The Frist Affiliated Hospital of Zhengzhou University,Zhengzhou 450003)
Experimental autoimmune encephalomyelitis(EAE)is a classic animalmodel for multiple sclerosis. Aftermore than 2 centuries of development,EAE can be established inmice,monkeys and rats,etc.Some animals can be immunized by different immune antigenswhich have different features in sensibility and clinical characteristics.In this paper,wewill review the developmentof EAE,discuss the characteristics of EAEmodels produced by immunization of different animals with different antigens.In summary,we explore the development of animalmodels of EAE.
Multiple sclerosis;Experimental autoimmune encephalomyelitis;Models,animal.
Q95-33
A
1005-4847(2015)05-0535-04
10.3969/j.issn.1005ˉ4847.2015.05.018
2015-05-11
国家自然科学基金青年项目(No.81202657);河南省中医管理局河南省中医临床学科领军人才培育计划(No.201301006);河南省教育厅科学技术研究重点项目(No.13A360556)。
李迎霞(1978ˉ),女,博士,研究方向:多发性硬化的实验研究。
关东升,博士,副教授,研究方向:多发性硬化的实验研究。Email:gds349@126.com
