Midkine-a通过限制心肌细胞总数的方式阻碍斑马鱼胚胎心脏生长
2015-05-25陈静LuoJingHitchcockPeter
陈静,Luo Jing,Hitchcock Peter
(1.福建师范大学生命科学院,福州 350117;2.美国密歇根大学安娜堡分校克鲁格眼科中心,安娜堡 48103)
研究报告
Midkine-a通过限制心肌细胞总数的方式阻碍斑马鱼胚胎心脏生长
陈静1*,Luo Jing2,Hitchcock Peter2
(1.福建师范大学生命科学院,福州 350117;2.美国密歇根大学安娜堡分校克鲁格眼科中心,安娜堡 48103)
目的探讨一种可溶性的外分泌因子midkine-a在斑马鱼胚胎心脏发育过程中的功能。方法 在整体胚胎上做midkine-a RNA的原位杂交实验;利用原有的转基因斑马鱼系Tg(pmidkine-a:EGFP),动态观察胚胎从出生到心脏发育成形这一段时间心脏荧光表达情况;将原有的转基因斑马鱼体系Tg(phsp:midkine-a:EGFP)胚胎进行热休克而过表达midkine-a,观察胚胎心脏表型;利用Tg(pcm lc2:dsRed)鱼系胚胎的心肌细胞核带有红色荧光,能进行单个心脏心肌细胞计数这一特点,将杂合的Tg(phsp:midkine-a:EGFP)鱼系与纯合的Tg(pcmlc2:dsRed)鱼系交配,以得到Tg(phsp:midkine-a:EGFP/pcmlc2:dsRed)的杂合胚胎,对其进行热休克而过表达midkinea,计算每个胚胎心脏内心肌细胞的总数;用吗啉寡聚核苷酸(morphonino,MO)阻碍新生胚胎内的midkine-amRNA表达,观察胚胎心脏表型。结果原位杂交试验证实midkine-a在胚胎48 hpf(hour post fertilization,受精后,用来标记斑马鱼胚胎年龄)大时表达于心脏;转基因Tg(pmidkine-a:EGFP)胚胎在72 hpf时其EGFP表达于心脏;Tg(phsp:midkine-a:EGFP)胚胎在过表达midkine-a后心脏变小;吗啉寡聚核苷酸敲除midkine-a对胚胎心脏发育无影响;最后在Tg(phsp:midkine-a:EGFP/pcmlc2:dsRed)鱼系胚胎内过表达midkine-a导致其单个心脏内心肌细胞数目变少,与其小心脏外形吻合。结论midkine-a在斑马鱼胚胎发育过程中表达于胚胎心脏;过表达midkine-a导致胚胎心脏内心肌细胞总数减少及心脏变小;敲除midkine-a则对胚胎心脏发育无影响。
斑马鱼胚胎;心脏发育;midkine-a;心肌细胞池
midkine是一种可溶性细胞生长因子,能与小分子肝素结合,并在调节细胞生长、增殖、分化及存活方面起着重要的多样化的作用[1]。它是一个13 kda的分泌分子,由两个结构域组成,C端结构域能与肝素结合,N端结构域能与受体结合,两个结构域之间以双硫键相连[1]。Midkine-a广泛地表达于神经系统[2]、免疫系统、肿瘤组织及心脏等器官或组织内。midkine能促进神经元生长[3],促进细胞分裂、存活、抗细胞凋亡、促进肿瘤细胞趋药现象发生等[1]。
不同于哺乳动物只有一种midkine,由于基因重复的结果midkine在斑马鱼体内有2种亚型:a型和b型[3]。midkine-a首先表达于斑马鱼胚胎尾芽期的胚胎的轴旁中胚层,而后midkine-a表达逐渐开始集中于神经组织如头部的神经外胚层、神经管及脊髓[3]。在16 hpf时,midkine-a开始出现在体节中[3]。故而人们普遍地认为midkine-a在神经组织形成及胚胎正常发育中起着重要的作用[2,3]。有文献报道midkine-a亦表达于斑马鱼视网膜的干细胞之内,并作为Id2a信号通路的主要成员调节动态的细胞周期进程[4]。此外midkine-a也存在于成年哺乳动物的心脏[5],可能通过其抗细胞凋亡的功能在心肌缺血时保护心脏[6]。在成年斑马鱼受到心肌损伤而导致的心脏再生过程中,再生心肌内midkine-a基因的转录水平升高,故而其可能在心脏再生中也起着一种积极的保护性[7]。我们的研究表明midkine-a也表达于斑马鱼胚胎心脏区域内,尽管如此,midkine-a在胚胎心脏发育过程中的功能尚不明了,而且不一定与它在成年心脏或心肌再生中的作用平行一致。由此促使我们开始探索midkine-a在心脏发育中的作用。类似于midkine-a,midkine-b也是一种能与小分子肝素结合的可溶性细胞生长因子,在体外细胞培养中表现出促进神经生长和血管新生的作用[1]。有报道表明midkine-b在斑马鱼胚胎发育过程中的原肠胚期中起着促进神经板图式形成的作用,它能调节神经板边缘的干细胞的分化[6]。在斑马鱼胚胎内,midkine-a和midkine-b分别表达于互不重叠的区域[3]。而我们的前期数据表明midkine-b并不表达于斑马鱼成年或胚胎心脏,故在本系列实验设计时忽略midkine-b。
斑马鱼的胚胎心脏发育可分为如下过程:心脏前区形成,心脏前体细胞迁移,心腔形成及心袢形成。在斑马鱼胚胎原形形成之前心脏前体细胞分散在胚胎腹侧及侧面的区域内[7]。在胚胎受精后12 h(12 hpf,hours post fertilization),胚胎两侧的心脏前体细胞向中线前部迁移,形成一个平行对称的心脏前区域[8]。而后心脏前区域分化出位于中间的心内膜前体细胞群,及位于侧部的心肌前体细胞群[8]。在胚胎处于13-原节期时(15.5 hpf),心脏前区域分出前心室前体细胞群及前心房前体细胞群。在19 hpf时心肌前体细胞层在中线上汇集并形成一个圆锥形结构[8]。该圆锥形结构在22 hpf时进一步演化成一个位于胚胎前后轴上的初始心管。到48 hpf时,这个心管历经心腔形成,右向心袢形成,心瓣膜生成,血循环形成,形成一个成熟的有功能的心脏[8]。
我们初步的研究表明:①原位杂变试验证实midkine-a表达于发育中的心脏;②Midkin-a基因5’端上游2.2 kb长的DNA序列能引导EGFP在胚胎体内普遍表达,包括心脏或的表达;③过表达midkine-a导致斑马鱼胚胎心脏变小;④MO敲除midkine-a对胚胎心脏发育没有影响。⑤过表达midkine-a导致心脏内心肌细胞总数减少,与小心脏的表型一致。这些数据表明,midkine-a在斑马鱼胚胎心脏的发育中起着重要的作用,能通过限制心肌细胞总数的方式调整发育中的心脏生长。
1 材料与方法
1.1 斑马鱼饲养
所有实验斑马鱼及胚胎均为清洁级,来源于野生型AB品系[10,11]。用于交配的30只斑马鱼均为24月龄,体重0.11~0.23 kg。实验操作地址为美国密歇根大学安娜堡分校克罗格眼科中心。斑马鱼胚胎存放于27℃的海盐水(60μg/mL Instant Ocean Salts;Aquarium Systems,Mentor,OH)中。房间明暗周期为14 h/10 h[12]。转基因斑马鱼Tg(phsp:midkine-a:EGFP)是实验室原有的鱼系。其转入的基因为热休克蛋白启动子连接midkine-a和EGFP(加强绿色荧光蛋白,enhanced green fluorescent protein)的融合基因。在热休克处理下,该株鱼系会过表达midkine-a:EGFPmRNA。Tg(pmidkine-a:EGFP)是另外一株转基因斑马鱼系,转入基因为midkine-a。转录起始位点5’端上游2.2 kb的启动子片段连接EGFP报告蛋白。该株鱼系胚胎在有midkine-a表达的组织和器官会表达midkine-a:EGFP融合蛋白而发出绿色荧光。Tg(pcmlc2:dsRed2-nuc)是另外一株能在胚胎心脏心肌细胞核发出红色荧光的斑马鱼转基因鱼系,其转入的基因为心肌特异性基因肌球蛋白轻链2的启动子连接红色荧光蛋白(r ed fluorescent protein,RFP)(Stainier 2001)。该RFP蛋白具有核定位信号引导RFP在心肌细胞核内表达[8]。建立这种鱼系的目的是为了更好的心肌细胞荧光显影并对某单个心脏内的心肌细胞数目进行计数。
1.2 原位杂交
斑马鱼胚胎的全组织包埋原位杂交实验根据文献报道的方法进行[12]。首先收集48 hpf的胚胎,而后对这些胚胎进行固定、渗透化及预杂化。杂化在70℃下进行。探针为与midkine-a mRNA相对应的地高辛标记的小片段反义RNA。接下来这些胚胎标本经洗涤后加入有碱性磷酸酶标记的抗地高辛抗体。显色反应于室温下的碱性Tris缓冲液内进行,而后胚胎标本在Zeiss Image A2蔡司显微镜(德国蔡司公司)下显像。
1.3 心肌细胞计数
Tg(pcm lc2:dsRed2-nuc)胚胎用来对心肌细胞进行计数。将杂合子斑马鱼Tg(phsp:midkine-a:EGFP)line与纯合子Tg(pcmlc2:dsRed-nuc)斑马鱼交配,后代胚胎基因型有一半是双重转基因胚胎
Tg(phsp:midkine-a:EGFP)+/ˉ;Tg(pcmlc2:dsRed-nuc)+/ˉ。这些胚胎在热休克处理下能普遍的过表达midkine-a:EGFP,并且它们的心脏心肌细胞核也能发出红色荧光。此种交配产生的另一半胚胎具有pcmlc2:dsRed-nuc+/ˉ基因型,但不能过表达midkine-a,这些胚胎可用来做心肌细胞计数实验的对照。在热休克处理后,在荧光显微镜下根据心脏有无绿色荧光将这两组胚胎分开。这些胚胎存养在0.003%苯硫脲海盐水中以抑制表皮色素形成。而后在72 hpf时将这些胚胎置入玻片上的含10%胎牛血清的Lebovitzˊs L15培养液中,盖上盖玻片后立即在荧光下显像。在每张心脏图像上进行心肌细胞计数[7]。此实验重复三次。每次试验的对照组和实验组都包括10只胚胎。用来荧光显像及心肌细胞计数的胚胎则从这些胚胎中随机选择。
1.4 热休克处理
多次热休克处理的方法:将Tg(phsp:midkinea:EGFP)胚胎在15、20、24、27、30及48 hpf大时,置于37℃持续1 h,而后将胚胎置于24℃的环境中恢复。这种热休克处理方法能在最大程度上促进midkine-a的表达,同时野生型胚胎也置于相同条件的环境中作为对照。胚胎心脏于50 hpf时显像。
1.5 统计分析
实验组与对照组平均值之间差异显著性用Statistica 7.0(StatSoft,Inc.,Tulsa,OK)软件中的双向分差分析计算,而后用Fisher LSD实验进行验证。结果用平均值+标准差表示,“*”表明组之间差异具有显著性,P≤0.05。
2 结果
2.1 早期斑马鱼胚胎发育过程中m idkine-a在心脏表达
我们的原位杂交实验结果表明midkine-a mRNA在胚胎早期发育过程中如48 hpf时即表达于心房和心室(图1)。与此表达一致的是,在72 hpf转基因斑马鱼Tg(pmidkine-a:EGFP)的胚胎内,midkine-a 5’端转录起始位点上游2.2 kb的DNA片段即可诱导其后的融合基因midkine-a:EGFP在心脏特异性的表达(图2)。总而言之,midkine-a能在早期胚胎心脏发育过程中表达于心脏,这说明midkine-a在心脏发育过程中可能扮演了特定的角色。
2.2 胚胎体内m idkine-a过表达导致心脏发育异常变小
为了理清midkine-a的功能,我们利用了Tg(phsp:midkine-a:EGFP)转基因斑马鱼以进一步研究过表达midkine-a对心脏发育的影响。该鱼系的转基因是由热休克基因的启动子与其后的融合基因midkine-a和EGFP报告基因组成。在较高的环境温度下,热休克基因的启动子被激活,诱导其后的midkine-a和EGFP融合基因的表达。当这些胚胎用热休克处理(方法详见材料和方法,及图3)后,这些胚胎体内的midkine-a:EGFP普遍的大量的整体表达,包括在胚胎心脏的表达,所以在荧光下整体胚胎包括心脏呈绿色。由于心脏位于胚胎腹侧的体表下,故带绿色荧光的心脏能很容易地与其他组织分辨开来(图4B,B’)。这些心脏与对照组非转基因胚胎心脏比较,其心脏明显变小并伴有轻度的心包积液(图4C,D)。除了心脏变小的表型外,这些胚胎还并发心动过缓的异常体征。转基因胚胎心脏平均跳动23次/分,而对照组胚胎的正常心跳平均为126次/分。(midkine-a整体表达于胚胎内,包括心脏、视网膜、骨骼肌等。由于心脏位于胚胎头部腹侧的体表下,故带绿色荧光的心脏能很容易地与其他组织分辨开来。

注:斑马鱼胚胎在48 hpf时的midkine-a全组织包埋原位杂交实验。方向:A,anterior(前方);P,posterior(后方);V,ventral(腹面);D,dorsal(背部)。箭头指向,A,atrium(心房);V,ventricle(心室)。图1 原位杂交显示midkine-a mRNA存在于胚胎的心脏中(×20)Note.The whole-mount in situ hybridization of48 hpf embryos showing the heart.Orientation:A,anterior;P,posterior;V,ventral;D,dorsal.The arrows point to A,atrium;V,ventricle.Fig.1 In situ hybridization shows thatmidkine-amRNA exists in a 48 hpf embryonic heart

注:Tg(pmidkine-a:EGFP)转基因斑马鱼胚胎在心脏内表达EGFP,证实midkine-a在胚胎发育早期就表达于心脏。箭头指向动脉球(bulbus arteriosus)和心室(ventricle)。方向:A.Anterior(前方);P.Posterior(后方);V.Ventral(腹面);D.Dorsal(背部)。图2 转基因斑马鱼Tg(pmidkine-a:EGFP)胚胎在心脏内表达EGFP(×100)Note.Tg(pmidkine-a:EGFP)transgenic fish expresses EGFP in the heart,demonstrating thatmidkine-a expresses in the early developmental stage of the embryonic heart.The arrows point to the bulbus arteriosus and the ventricle.Orientation:A,anterior;P,posterior;V,ventral;D,dorsal.Fig.2 The embryo of transgenic fish Tg(pmidkinea:EGFP)specifically expresses EGFP in the heart

注:热休克处理示意图表明对Tg(phsp:midkine-a:EGFP)转基因斑马鱼胚胎进行热休克处理以诱导midkine-a:EGFP蛋白大量表达。胚胎分别在15、20、24、27、30、48 hpf时予以37℃1 h的热处理后,转移至24℃恢复。图3 热休克处理示意图Note.Diagram showing the regimen of heatshock treatments of Tg(phsp:midkine-a:EGFP)embryos at 15,20,24,27,30,48 hpf to induce the maximum production of midkine-a.For each heatshock treatment,embryos were exposed in a 37℃ incubator for 1 h and then recovered in the 24℃ incubator.Fig.3 Diagram of the heat shock treatment
2.3 吗啉寡合核苷酸敲除m idkine-a对斑马鱼早期胚胎心脏发育无影响
与过表达midkine-a不同的是,用吗啉寡合核苷酸(morpholino,MO)阻碍midkine-a的转录对斑马鱼早期胚胎心脏发育没有影响。在0~48 hpf之间,斑马鱼胚胎心脏发育历经心腔形成、右向心袢形成、心瓣膜生成、血循环形成,最终形成一个成熟的心脏。而我们从0~120 hpf仔细观察了midkine-a有机体(morphant,指注射了吗啉寡合核苷酸的胚胎)的心脏表型,未见明显异常(图5)。在82 hpf时midkine-a有机体心脏发育正常,心腔形成,及右向心袢、心瓣膜、血循环形成无异常,与对照组无差别,未见小心脏或心包积液的产生。这说明midkine-a的存在对于斑马鱼胚胎心脏的正常发育不是必需的。本midkine-a吗啉寡合核苷酸阻碍midkine-a翻译作用的有效性及特异性用midkine-a及midkine-b cD-NA体外翻译实验(图6)证实。该实验结果证实midkine-a吗啉寡合核苷酸能有效地阻碍midkine-a cDNA体外翻译;而无阻止同源基因midkine-b cNDA体外翻译的作用,证实了其有效性及特异性。

注:热休克引导midkine-a:EGFP在48 hpf Tg(phsp:midkine-a:EGFP)胚胎中的表达。从野生型与半合子Tg(phsp:midkine-a:EGFP)斑马鱼交配的后代经历热休克后,在荧光显微镜下根据心脏有无绿色荧光蛋白的引导表达,分成野生型(A,WT)与转基因型[B,Tg(phsp:midkine-a:EGFP)]两组。A,B为胚胎整体图;A’,B’为心脏细节图。白色箭头指向表达绿色荧光蛋白的心脏。C、D,野生型与Tg(phsp:midkine-a:EGFP)胚胎在热休克处理后的心脏DIC图像。心房用红色线描出,心室用白色线描出。图4 热休克引导midkine-a:EGFP在Tg(phsp:midkine-a:EGFP)胚胎中的过表达导致胚胎心脏变小(上图×100,下图×20)Note.Heatshock treatments induce midkine-a:EGFP protein expression in the whole embryos.Wild-type and heterozygous Tg(phsp:midkine-a:EGFP)fish were crossed to get the wild-type(A)and Tg(phsp:midkine-a:EGFP)(B)embryos,and then these embryoswere heatshcocked to induce the transgene expression.A,B,whole embryos expressingmidkine-a:EGFP;A’,B’,the corresponding hearts expressingmidkine-a:EGFP.White arrow points to the green heart.C,D,DIC images of the wild-type and Tg(phsp:midkine-a:EGFP)hearts.The atriums were outlined by red color and the ventricles were outlined by white color.Fig.4 Heat shock treatment induces the expression of the fusion protein midkine-a:EGFP in Tg(phsp:midkine-a:EGFP)embryos,leading to a small heart
2.4 斑马鱼胚胎过表达m idkine-a导致心肌细胞总数减少
如前(材料与方法)所述,我们将转基因鱼Tg(phsp:midkine-a:EGFP)与Tg(pcm lc2:dsRed-nuc)交配,得到并分离基因型为Tg(phsp:midkine-a:EGFP)/Tg(pcmlc2:dsRed-nuc)杂合子胚胎。先用热休克处理诱导midkine-a的过表达,而后按照材料与方法所述在荧光显微镜下计算每个杂合子胚胎心脏的心肌细胞总数,与对照组相比。结果发现在热休克处理之前1 h,过表达midkine-a组与对照组的心肌细胞总数相比较没有区别;而在热休克处理之后的72 hpf时,过表达组心肌细胞总数明显减少至每个心脏平均126个心肌细胞。相反的是对照组的心肌细胞总数在这一时刻有约218个心肌细胞(图7)。两者之间的统计学上差异有显著性。这说明,与表型一致的是,过表达midkine-a导致心脏内心肌细胞总数减少,且这一现象与过表达midkine-a胚胎的小心脏表型密切相关。这说明很可能midkine-a过表达阻碍了胚胎心肌细胞增殖,使其心肌细胞总数减少,导致小心脏的表型。

注:注射过对照MO(左)及midkine-MO(右)的胚胎的心脏DIC图像。图中箭头指向心脏位置。摄像拍于胚胎82 hpf时。图5 MO敲除midkine-a不影响胚胎心脏正常发育(×20)Note.DIC images of the embryonic control heart(Left)and the heart ofmidkine-a Knock-down embryos(Right)with morpholino. Black arrows point to the hearts.Fig.5 Knock-down ofmidkine-a withmorpholino does not affect the embryonic heart development
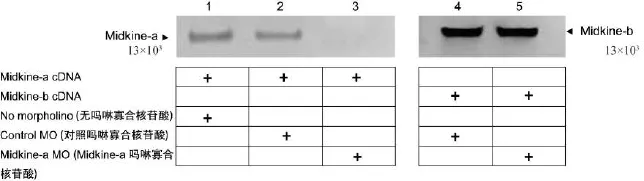
注:体外翻译实验证实midkine-a吗啉寡合核苷酸阻碍midkine-a cDNA翻译作用的有效性及特异性。midkine cDNA体外翻译实验用35S-甲硫氨酸标记。为决定midkine-a吗啉寡合核苷酸的有效性,midkine-a cDNA体外翻译实验在无吗啉寡合核苷酸(1道)、有对照吗啉寡合核苷酸(2道)及有midkine-a吗啉寡合核苷酸(3道)存在的条件下进行。为决定midkine-a吗啉寡合核苷酸的特异性,midkine-b cDNA体外翻译实验在有对照吗啉寡合核苷酸(4道)或有midkine-a吗啉寡合核苷酸(5道)存在的条件下进行。图6 midkine-a吗啉寡合核苷酸对斑马鱼midkine-a cDNA体外翻译阻碍作用的有效性与特异性Note.In vitro translation using35S-methionine label shows the effectiveness and specificity ofmidkine-a MO.To determine the effectiveness ofmidkine-a MO,midkine-a cDNA in vitro translation experimentswere conducted in the absence(Lane 1),presence of control MO(Lane 2),and the presence ofmidkine-a MO(Lane3).To determine the specificity ofmidkine-a MO,midkine-b cDNA in vitro translation experiments were conducted in the presence of control MO(Lane 4),and the presence ofmidkine-a MO(Lane 5).Fig.6 The specificity and effectiveness ofmidkine-a MO on blocking the in vitro translation ofmidkine-a and midkine-b cDNA
3 讨论
Midkine是一种可溶性细胞生长因子,能与小分子肝素结合,并在调节细胞生长、增殖、分化及存活方面起着重要的多样化的作用[1,13]。它是一个13 ×103的分泌分子,由两个结构域组成,C端结构域能与肝素结合,N端结构域能与受体结合,两个域之间以双硫键相连[1,13]。它广泛地表达于神经系统、免疫系统、肿瘤组织及心脏等器官或组织内[13,14]。midkine能促进神经元生长,促进细胞分裂、存活、抗细胞凋亡、促进肿瘤细胞趋药现象发生等[13,14]。尽管midkine也表达于胚胎及成年哺乳动物心脏,但它在心脏中的功能人们还知之甚少。

注:杂合子鱼系Tg(phsp:midkine-a:EGFP)与纯合子鱼系Tg(cmlc2:dsRed-nuc)交配,后代胚胎经热休克后,在72 hpf时根据心脏绿色荧光的有无分两组,野生型(A)和midkine-a过表达组(B)。在荧光显微镜下两组72 hpf胚胎的发红色荧光的心肌细胞被计数。C图所显示的数目来自野生型和midkine-a过表达组各三组,每组平均3只胚胎的统计。*表明差异有显著性,P<0.05。图7 过表达midkine-a组的胚胎心脏内心肌细胞总数比对照组低(×50)Note.The heterozygous(phsp:midkine-a:EGFP)fish was crossed with homozygous(cmlc2:dsRed-nuc)fish.Their progenies were heat-shocked and grouped into wild-type(A)and midkine overexpression(B)groups by the absence and presence of green fluorescence in the heart.To count their cardiomyocytes,the embryonic heartswere imaged with the red fluorescence undermicroscope at72 hpf.The experimentswere repeated three times and three embryoswere counted each time to get the average number of the cardiomyocytes in each group.*shows a significant statistical difference between the numbers of cardiomyocytes in the wild type and midkine-a overexpression groups.Fig.7 Overexpression ofmidkine-a leads to a reduced total number of cardiomyocytes in the embryonic heart
斑马鱼的midkine存在两种亚型:midkine-a和midkine-b[3]。二者在斑马鱼胚胎发育及神经系统形成的过程中起着重要的作用。在斑马鱼胚胎时期,midkine-a和midkine-b各自表达于独立的互不重叠的区域[3]。有文献报道表明,midkine-a首先表达于原肠胚晚期的胚胎。当神经胚开始形成时,midkine-a开始出现在未分节的延髓傍中胚层[3]。而后,midkine-a以波浪式的方式从前至后表达于这一区域。在后期,midkine-a表达于轴旁中胚层及前神经龙骨[3]。此时midekine-a的表达区域标定了无midkine-a表达的内侧底板。midkine-a的表达在时间和空间上与内侧底板的出现一致[3]。在斑马鱼胚胎体内,过表达midkine-amRNA可致内侧底板增大和其细胞数目显著增加,而吗啉寡核苷酸敲除midkine-a可致内侧底板发育异常及其标记物表达的缺失[3]。内侧底板与脊索临近,且均由中线前体细胞发育而来。该研究表明midkine-a可削弱脊索的发育,而内侧底板的增大是以脊索发育的减弱为代价,故而midkine-a在特化内侧底板及脊索细胞命运上起着重要的作用[3]。midkine在脊椎动物发育过程中的作用多样化,并不单独依赖于midkine作为生长因子的作用。虽然midkine-a是一种生长因子,BrdU掺入法及抗磷酸化组蛋白的免疫组化实验均表明底板细胞数目的增加并不来源于细胞增殖。故而midkine-a在特化内侧底板及脊索细胞命运上的作用与其自身作为生长因子的作用无关[3]。我们的实验表明Mdikine-a也表达在胚胎心脏内。在胚胎内过表达Mdikine-a能阻碍心脏生长。故而我们提出假说,即类似于midkine-a在特化内侧底板及脊索细胞命运的功能相似,过表达midkine-a阻碍胚胎心脏发育的机制也可能是其通过特化正常心肌细胞的命运,限制心肌细胞总数,使得心肌细胞总数减少。早期的胚胎心脏生长依赖于心肌细胞总数的增加,而过量的midkine-a可能通过阻碍心前细胞分化或阻碍心肌细胞增殖这两种方式,降低心脏内心肌细胞总数。而吗啉寡合核苷酸敲除midkine-a对斑马鱼早期胚胎心脏发育无影响,说明midkine-a对心脏发育不是必需的,而过多的midkine-a则能起着限制性的作用。总之,midkine-a在斑马鱼胚胎心脏发育早期起着通过限制心肌细胞总数的方式以特化心肌细胞的命运的作用。本研究的意义在于它将是将来进一步研究midkine在心脏中的下游信号通路的基础,并提供人们对心肌损伤后的心脏分子内环境进一步的认识,为成人心肌缺血或梗死的可能的分子生物学治疗奠定基础[15]。
[1] Kadomatsu K,Muramatsu T.Midkine and pleiotrophin in neural development and cancer[J].Cancer Lett,2004,204(2):127 ˉ143.
[2] Winkler C,Yao S.Themidkine family of growth factors:diverse roles in nervous system formation and maintenance[J].Br J Pharmacol,2014,171(4):905ˉ912.
[3] Winkler C,Schafer M,Duschl J,etal.Functional divergence of two zebrafish midkine growth factors following fish-specific gene duplication[J].Genome Res,2003,13(6A):1067ˉ1081.
[4] Luo J,Uribe RA,Hayton S,et al.Midkine-A functions upstream of Id2a to regulate cell cycle kinetics in the developing vertebrate retina[J].Neural Dev,2012,7(1):33.
[5] Horiba M,Kadomatsu K,Yasui K,et al.Midkine plays a protective role against cardiac ischemia/reperfusion injury through a reduction of apoptotic reaction[J].Circulation,2006,114(16):1713ˉ1720.
[6] Liedtke D,Winkler C.Midkine-b regulates cell specification at the neural plate border in zebrafish[J].Dev Dynamics,2008,237(1):62ˉ74..
[7] Lien CL,Schebesta M,Makino S,etal.Gene expression analysis of zebrafish heart regeneration[J].PLoSBiol,2006,4(8):e260.
[8] Stainier DY.Zebrafish genetics and vertebrate heart formation[J].Nat Rev Genet,2001,2(1):39ˉ48.
[9] Thisse C,Thisse B.High-resolution in situ hybridization to whole-mount zebrafish embryos[J].Nat Protoc,2008,3(1):59ˉ69.
[10] 何嘉玲,刘静,王天奇,等.斑马鱼的质量标准化[J].中国实验动物学报,2014,22(6):99ˉ102.
[11] 李阔宇,潘鲁湲,孙永华.斑马鱼资源的开发保藏与国家斑马鱼资源中心[J].中国实验动物学报,2014,22(6):93ˉ 98,105.
[12] 柯贤福,胡慧颖,吴立仁,等.实验用斑马鱼养殖地方标准的初步探讨[J].中国比较医学杂志,2014,24(8):75ˉ 78.
[13] Jones DR.Measuring midkine:the utility of midkine as a biomarker in cancer and other diseases[J].Br JPharmacol,2014,171(12):2925ˉ2939.
[14] Sato W,Sato Y.Midkine in nephrogenesis,hypertension and kidney diseases[J].Br JPharmacol,2014,171(4):879ˉ 887.
[15] Muramatsu T,Kadomatsu K.Midkine:an emerging target of drug development for treatment of multiple diseases[J].Br J Pharmacol,2014,171(4):811ˉ813.
M idkine-a inhibits zebrafish embryonic heart grow th by lim iting the cardiom yocyte pool
CHEN Jing1,LUO Jing2,Hitchcock Peter2
(1.Fujian Normal University,Fuzhou 350117,China;2.Kellogg Eye Center of University of Michigan-Ann Arbor,Ann Arbor,US 48103)
ObjectiveTo investigate the functional role of a soluble secretion factormidkine-a in the process of zebrafish embryonic heart development.M ethodsWhole-mount in situ hybridization was performed to detect whether midkine-a is expressed in the embryonic heart.In the transgenic embryonic heart of Tg(pmidkine-a:EGFP),the expression of EGFP in the heartwasmonitored.Multiple heat shock treatmentswere applied to Tg(phsp:midkine-a:EGFP)embryos in order to overexpressmidkine-a,and the phenotype of the heart was observed.The heterozygous Tg(phsp:midkine-a:EGFP)fish were crossed with homozygous Tg(pcm lc2:dsRed)fish,which specifically expresses RFP in the nucleoli of embryonic cardiomyocytes to facilitatemyocyte number counting.To get Tg(phsp:midkine-a:EGFP/pcmlc2:dsRed)embryos,and the total number of cardiomyocytes in their heartwas counted and compared with the controls when the heat shock induced overexpression ofmidkine-a.Morphonino knocked out ofmidkine-a was performed to observe the heart phenotype.ResultsMidkine-a was expressed in the zebrafish embryonic heart during development.Overexpression ofmidkine-a led to a smaller heart and reduced total number of cardiomyoctes in a single heart,which might be associated with the smaller heart phenotype.Morphonilo knocked out ofmidkine-a had no effect upon the heart development.ConclusionsMidkine-a impedes zebrafish embryonic heart growth by limiting its cardiomyocyte pool.
Zebrafish embryo;Heart development;midkine-a;Cardiomyocyte pool
Q95-33
A
1005-4847(2015)05-0458-08
10.3969/j.issn.1005ˉ4847.2015.05.004
2015-04-27
国家自然科学基金(No.30971106);福建省自然科学基金(No.2014J01304);教育部留学回国人员基金(教外司留【2010】1561号)。
陈静(1972ˉ),女,副教授,博士,研究方向:斑马鱼胚胎心脏发育。.E-mail:jc2417@fjnu.edu.cn