斑马鱼消化器官发育缺陷突变体的遗传筛选
2015-05-25黄超张冲蒋发明王飞阮华黄红辉
黄超,张冲,蒋发明,王飞,阮华,黄红辉
(淡水鱼类资源与生殖发育教育部重点实验室,三峡库区生态环境与生物资源省部共建国家重点实验室培育基地,西南大学生命科学学院,重庆 400715)
研究报告
斑马鱼消化器官发育缺陷突变体的遗传筛选
黄超,张冲,蒋发明,王飞,阮华*,黄红辉*
(淡水鱼类资源与生殖发育教育部重点实验室,三峡库区生态环境与生物资源省部共建国家重点实验室培育基地,西南大学生命科学学院,重庆 400715)
目的正向遗传筛选斑马鱼肝脏、肠和胆囊发育缺陷突变体。方法ENU诱变野生型斑马鱼并开展经典的F2代筛选,以lfabp为探针的全胚原位杂交、BES-H2O2-Ac荧光染料分别检测斑马鱼早期胚胎肝脏、肠和胆囊的表型。结果在128个突变基因组中筛选获得了源自14个F2家族的斑马鱼消化器官发育缺陷突变体品系23个,并按表型划分为6类。结论斑马鱼肝脏、肠和胆囊的发育调控机制有相似性和差异性。
斑马鱼;消化器官;遗传筛选;突变体
肝脏、胆囊、肠等是重要的消化器官,在食物消化、贮存、营养吸收、排泄和内分泌等方面都有着重要的作用[1]。斑马鱼是常用的脊椎模式动物,它的消化器官组成结构和发育分子机制类似于哺乳动物[2]。斑马鱼具有体外发育、胚胎透明、胚胎发育周期短、产卵量大等优点,突显其在遗传学研究上的优势,也使得斑马鱼成为目前唯一适合于大规模遗传筛选的脊椎模式动物[3]。构建斑马鱼消化器官发育缺陷突变体有助于研究消化器官发育的分子机制,并可能用于人类相关先天性疾病的研究。本课题通过在斑马鱼中进行无基因差别的正向遗传筛选,获得不同消化器官发育缺陷的突变体,为后续消化器官发育分子机制的研究奠定基础。
1 材料与方法
1.1 材料
1.1.1 实验动物
斑马鱼(Danio rerio),品系AB Tüebingen,用于突变体遗传诱变及传代。
1.1.2 实验试剂
多聚甲醛、氯化钾、磷酸氢二钠、氯化钠、磷酸二氢钾、柠檬酸钠、氯化镁、柠檬酸、去离子甲酰胺(上海生工生物工程股份有限公司);PTU(1-phenyl-2-thiourea)、 ENU (N-ethyl-N-nitrosourea)、 Tris(pH 9.5)、蛋白酶K、BSA、NBT(nitrotetrazolium blue chloride)、BCIP(5-bromo-4-chloro-3-indolyl phosphate)、肝素、tRNA(Sigma);BES-H2O2-Ac过氧化氢荧光染料(日本和光纯药工业株式会社)。
1.1.3 实验器材
斑马鱼养殖系统(北京爱生科技发展有限公司);荧光体视显微镜(Zeiss SteREO Discovery V20);全自动荧光正置显微镜(Zeiss Axiolmage Z2);移液器(Gilson 10μL、20μL、100μL、200μL、1 mL);恒温培养箱(MemmentINE800);盘旋混合仪(江苏海门市其林贝尔仪器制造有限公司KB-3-D);分子杂交箱(UVP HL-2000 hybrilinker hybridization Oven/UV cross linker);pH计及精密电子天平(Mettler Toledo);圆周式摇床(GFL 3005型);24孔细胞培养皿(Costar)。
1.2 方法
1.2.1 胚胎收集及处理
斑马鱼交配产生的受精卵收集于0.03%的海盐水中,并于28℃恒温箱饲养。胚胎的发育阶段依据已有报道确定[4]。在胚胎12 hpf(hours post-fertilization)起用0.03%PTU处理抑制色素形成,并在3.5 dpf(days post-fertilization)和5dpf时收集用于实验的胚胎。
1.2.2 全胚胎原位杂交(whole-mount in situ hybridization,WISH)
lfabp探针合成与全胚胎原位杂交实验依据已有报道进行[5]。3.5 dpf胚胎用蛋白酶K(1:1000稀释)在37℃消化26 min。反义RNA探针用地高辛标记。NBT/BCIP显色时,室温闭光0.5~1 h即有明显信号。
1.2.3 BES-H2O2-Ac(DCFH-DA)荧光染色
BES-H2O2-Ac(DCFH-DA)可用于检测生理过程中产生的细胞源性活性氧分子(reactive oxygen species,ROS)如O2ˉ,H2O2,HO˙等,斑马鱼胚胎发育过程中肠和胆囊可产生H2O2,可被BES-H2O2-Ac(DCFH-DA)标记[6]。收集的5 dpf斑马鱼胚胎放入24孔细胞培养盒中,并换上新的0.03%的海盐水。每孔之中加入1μL BES-H2O2-Ac荧光染料(1mg/ L,溶于DMSO),使稀释度约为1∶10 000,轻轻晃动,使染液迅速分散开,然后将培养盒放入28℃恒温箱中1~2 h后取出,在荧光显微镜下观察肠和胆囊的形态发育状况。
1.2.4 筛选过程及表型分类
用ENU处理野生成年雄性斑马鱼若干,存活的雄鱼称为F0,与野生型杂交产生F1代。F2家族由来自不同F0的F1鱼交配产生。将来自同一F2家族的斑马鱼随机交配以获取F3子代,利用1.2.2及1.2.3中所述方法进行实验,若F3子代中1/4左右的个体表现出相同的缺陷表型,则其F2父母可被认定为携带隐性突变的杂合突变体。将F2杂合突变体与野生型杂交传代,产生的后代称为F3,以同样的方法利用F4胚胎来确定F3杂合突变体。最终确定的F3突变体,将会依据其表型特征被分为几种不同的类别[7]。
2 结果
2.1 FNU诱变与F2家族的建立
用ENU处理30条约6月龄期健康雄鱼,9条F0存活,将F0与野生型雌鱼杂交产生子代,即F1代(每条F1代表一个突变基因组),保留F0第二次与第三次交配产生的子代饲养至成鱼,可保证F1携带较多突变,并降低来自于同一精母细胞带有相同突变的精子都产生子代的概率,每条F0生产约100条F1,共计958条,然后将不同F0产生的F1交配产生F2家族。
2.2 F2代筛选与突变体的传代
将来自同一F2家族的鱼随机交配,检测产生的F3胚胎的表型,并根据孟德尔遗传定律判断亲本是否为候选突变体。我们从64个F2家族中的204对鱼中,筛选得到了65对候选突变体,并对表型不确定的候选突变体做了二次鉴定,排除了12对非突变体。有4对因表型非特异性被舍弃,另有9对在筛选中丢失或死亡而无法鉴定。最终,来自23个F2家族的32对突变体与野生型进行传代,产生了F3家族,见表1。因为F2家族是由不同的F1相互杂交产生的,所以每个F2家族突变体代表两个突变基因组,故此次筛选的规模为128个突变基因组。
2.3 F3代建立与筛选
F3代家族筛选与F2代筛选类似,将来自同一F3家族的斑马鱼雌雄个体之间随机交配以产生F4胚胎,根据F4胚胎表型比例确定F3是否为杂合突变体。在总共32个F3家族中,其中有一个家族(L39-4)因全是雌鱼无法配对而被舍弃。其余31个F3家族共成功交配251对斑马鱼,从中筛选得到了40对突变体。二次鉴定之后,18个F3家族的表型是可遗传的。最终,依据表型、初始F2家族,保留下来的34对突变体归为23个F3突变品系,见表2。
2.4 F3突变体的表型分类
F3筛选结束之后,根据突变品系的不同表型特征,将其分为六类,见表3和表4,代表品系展示见图1。第I类为“肠特异性缺陷突变体”,这类突变体的肠具有较大程度缺陷,基本表现为肠弯曲窄细或者几乎无染料荧光,但是肝脏和胆囊都较为正常。第II类为“肝脏特异性缺陷突变体”,其肠和胆囊较为正常,而肝脏缺陷较为严重,通常表现为无肝脏和肝脏偏小的表型。第III类为“胆囊特异性缺陷突变体”,其肝脏和肠并无明显缺陷,但是胆囊呈现出偏小或者缺失的性状。第IV类为“肠和胆囊共同缺陷突变体”,该类突变体中肝脏并没有出现发育缺陷但是肠、胆囊染色均出现了缺陷表型。第V类为“肝脏和胆囊共同缺陷突变体”,其肝脏和胆囊都出现了发育缺陷但是肠染色却是正常的,通常表现为肝脏偏小和胆囊偏小的表型。第VI类为“肝脏、肠和胆囊共同缺陷突变体”,lfabp和BES-H2O2-Ac染色结果都显示肝脏、肠和胆囊存在明显的发育缺陷。

表1 F2代筛选结果Tab.1 Results of the F2 generation screening

表2 F3代筛选结果Tab.2 Results of the F3 generation screening

表3 F3代突变体的表型分类Tab.3 Classification of the F3 mutant phenotypes
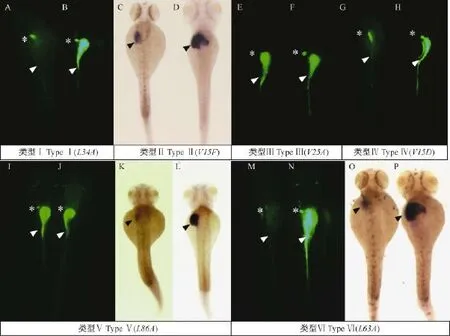
注:胆囊(星号),肠(白色箭头),肝脏(黑色箭头),B、D、F、H、I、L、N、P为对照组,A、C、E、G、J、K、M、O为突变体,A、B、E、F、G、H、M、N为侧面观,C、D、K、L、O、P为背侧观,I、J为腹侧观。类型I.肠特异性缺陷突变体(L34A,A&B);类型II.肝脏特异性缺陷突变体(V15F,C&D);类型III.胆囊特异性缺陷突变体(V25A,E&F);类型IV.肠和胆囊共同缺陷突变体(V15D,G&H);类型V.肝脏和胆囊共同缺陷突变体(L86A,I~L);类型VI.肝脏、肠和胆囊共同缺陷突变体(L63A,M~P)。图1 6类突变体品系代表示意图Note.The gallbladder(asterisk),intestine(white arrowhead),liver(black arrowhead).B,D,F,H,I,L,N,P are siblings.A,C,E,G,J,K,M,O are mutants.A,B,E,F,G,H,M,N are lateral views.C,D,K,L,O,P are dorsal views.I,Jare ventral views.Type I.The intestine specific mutant(L34A,A&B);Type II.The liver specific mutant(V15F,C&D);Type III.The gall bladder specific mutant(V25A,E&F);Type IV.The intestine and gall bladdermutant(V15D,G&H);Type V.The liver and gall bladder mutant(L86A,I~L);Type VI.The liver,intestine and gall bladder mutant(L63A,M~P).Fig.1 Six groups of representativemutant lines

表4 突变体品系汇总Tab.4 Summary of themutant lines
3 讨论
3.1 遗传筛选的结果分析
虽然正向遗传筛选斑马鱼发育缺陷突变体的研究已广泛开展,但是利用ENU诱变同时筛选多个消化器官发育缺陷突变体的案例却并不多。本次筛选工作着重关注肝脏、胆囊以及肠3个消化器官的发育缺陷,在一次筛选中获得多种突变体,提高了突变群体的利用率,并可获得单个消化器官特异性缺陷的突变体。
ENU筛选过程中的突变效率一般为0.2%左右[8],本次研究中并没有检测突变效率,但是在128个突变基因组的筛选中,最终获得了突变品系23个,可见本次突变和筛选的效率都是比较高。这些突变体表型多样化,说明调控不同消化器官发育的基因是不同的,但也发现不同突变体表型之间有交叉。从23个突变品系分类来看,有约40%的突变品系具有2种及以上的发育缺陷表型。说明这些消化器官在各自发育过程中的某些调控因子之间存在相似性,也暗示了它们在分子发育调控过程中存在着必然的联系。
3.2 筛选过程中存在的不足和限制性因素
ENU筛选工作量大,空间和人手都是限制性因素。此次筛选规模并不大,为了弥补这一缺陷,我们采用F1代雌雄个体进行交配而非传统的F1外交生产F2家族的策略,提高了筛选效率,但也导致了突变体的遗传背景更为杂乱,获得的突变体需外交传代稀释遗传背景。
我们的筛选获得了23个突变品系,将利用图位克隆技术鉴定突变基因,并针对突变体表型和突变基因进一步探究,有望对斑马鱼乃至其他脊椎动物消化器官发育的分子机制有进一步的理解。
[1] Field HA,Ober EA,Roeser T,etal.Formation of the digestive system in zebrafish.I.Liver morphogenesis[J].Dev Biol. 2003,253(2):279ˉ290.
[2] Zorn AM,Wells JM.Molecular basis of vertebrate endoderm development[J].Int Rev Cytol.2007,259:49ˉ111.
[3] Amsterdam A,Burgess S,Golling G,et al.A large-scale insertionalmutagenesis screen in zebrafish[J].Genes Dev.1999,13(20):2713ˉ2724.
[4] Kimmel CB,Ballard WW,Kimmel SR,etal.Stages of embryonic development of the zebrafish[J].Dev Dyn.1995,203(3):253ˉ310.
[5] Huang H,Ruan H,Aw MY,et al.Mypt1-mediated spatial positioning of Bmp2-producing cells is essential for liver organogenesis[J].Development.2008,135(19):3209ˉ3218.
[6] Shi Y,Zhang Y,Zhao F,et al.Acetylcholine serves as a derepressor in Loperamide-induced opioid-induced bowel dysfunction(OIBD)in zebrafish[J].Sci Rep.2014,4:5602.
[7] Jiang F,Chen J,Ma X,etal.Analysis ofmutants from a genetic screening reveals the control of intestine and liver developmentby many common genes in zebrafish[J].Biochem Biophys Res Commun.2015,460(3):838ˉ844.
[8] de Bruijn E,Cuppen E,Feitsma H.Highly efficient ENUmutagenesis in zebrafish[J].Methods Mol Biol.2009,546:3ˉ12.
Genetic screening of zebrafish mutants w ith developmental defects in the digestive organs
HUANG Chao,ZHANG Chong,JIANG Fa-ming,WANG Fei,RUAN Hua*,HUANG Hong-hui*
(Key Laboratory of Freshwater Fish Reproduction and Development,Ministry of Education,State Key Laboratory Breeding Base of Eco-Environments and Bio-Resources of the Three Gorges Reservoir Region,School of Life Sciences,Southwest University,Beibei,Chongqing 400715,China)
ObjectiveTo obtain zebrafish mutants with developmental defects in digestive organs from a forward genetic screening.M ethodsENUmutagenesis and a classical F2 genetic screening were performed.RNA wholemount insitu hybridization using lfabp as probe and BES-H2O2-Ac staining was applied to examine the liver,intestine and gall bladder phenotype in zebrafish embryos.ResultsWe harvested 23 mutant lineswith developmental defects in digestive organs(originated from 14 F2 families)after screening 128 mutagenized genomes.These mutants were classified into six groups according to their phenotypes.ConclusionsThe liver,intestine and gall bladder share and differ in their developmental molecularmechanisms in zebrafish.
Zebrafish;Digestive organs;Genetic screening;Mutants
Q95-33
A
1005-4847(2015)05-0441-05
10.3969/j.issn.1005ˉ4847.2015.05.001
2015-06-22
国家自然科学基金面上项目(31471365);西南大学中央高校基本科研业务费(XDJK2014A013、2362014xk02)。
黄超(1990ˉ),男,硕士,研究方向:发育生物学E-mail:zjhc2007@126.com
黄红辉(1974ˉ),男,博士,教授,研究方向:发育生物学E-mail:honghuih@126.com;
阮华(1974ˉ),女,博士,教授,研究方向:发育生物学,E-mail:ruanhua23@126.com
