顺铂诱导三阴性乳腺癌4T1耐药小鼠模型的建立
2015-05-25盛佳钰陈红风
盛佳钰,陈红风
(上海中医药大学附属龙华医院乳腺科,上海 200032)
研究报告
顺铂诱导三阴性乳腺癌4T1耐药小鼠模型的建立
盛佳钰,陈红风*
(上海中医药大学附属龙华医院乳腺科,上海 200032)
目的建立一种耐药性稳定的三阴性乳腺癌4T1耐药小鼠模型,为研究体内肿瘤耐药机制和逆转药物的筛选奠定实验基础。方法采用顺铂(DDP)低剂量诱导及体内外交叉致瘤结合的方法建立三阴性乳腺癌耐药小鼠模型;MTT法检测细胞耐药特性;实时荧光定量PCR法分析耐药相关基因MDR1、BCRP、MMP7及GST-π表达差异;免疫组化分析耐药相关蛋白P-gp、BCRP、MMP7表达差异;蛋白印迹法检测磷酸化Akt(phosphorate-Akt,p-Akt)和总Akt(total-Akt,t-Akt)蛋白表达;小动物成像检测观察肿瘤生长情况。结果MTT显示建立的三阴性乳腺癌耐药4T1小鼠模型的耐药指数为12.84;耐药小鼠肿瘤组织中MDR1、BCRP、MMP7、GST-π基因mRNA的表达量及P-gp、BCRP、MMP7蛋白的表达量均高于非耐药小鼠(P<0.01);Western blot显示,耐药小鼠肿瘤组织的p-Akt蛋白表达明显高于非耐药小鼠,t-Akt蛋白表达没有差异。非耐药小鼠与耐药小鼠肿瘤组织生长速度未见明显区别(P>0.05)。分别给予这两种模型小鼠相同剂量的DDP治疗后,耐药小鼠对DDP的敏感性明显低于非耐药小鼠(P<0.01)。结论初步建立了三阴性乳腺癌耐药4T1小鼠模型,为三阴性乳腺癌临床个体化治疗及耐药逆转研究等提供了良好的实验动物平台。
三阴性乳腺癌;肿瘤抗药性;顺铂;动物模型;小鼠
目前认为乳腺癌是一种高度异质性肿瘤,不同的病理特点和分子特征导致其对治疗的反应和预后明显不同。临床上根据免疫组化检测的雌激素受体(estrogen receptor,ER)、孕激素受体(progesterone receptor,PR)、人表皮生长因子受体2(human epidermal growth factor receptor-2,HER-2)表达均阴性者被称为三阴性乳腺癌(triple negative breast cancer,TNBC)。该亚型乳腺癌对内分泌治疗及抗HER-2的靶向治疗均不敏感,因此化疗是其主要的治疗手段。近年来研究发现,TNBC这类与乳腺癌易感基因1(breast cancer susceptibility gene-1,BRCA1)相关的乳腺癌亚型对铂类药物表现出较高的敏感性[1]。然而,事实证明对化疗相对敏感的TNBC患者并不意味着拥有更高的生存率。与其他化疗药物一样,在临床应用过程中多数患者经铂类药物化疗缓解后,即会产生耐药性而使后续治疗效果受到严重影响。本实验以顺铂(cisplatin,DDP)为诱导药物,三阴性乳腺癌细胞株4T1为诱导对象,采用化疗药物诱导耐药及体内外交叉致瘤的方式建立三阴性乳腺癌耐药小鼠模型,并对三阴性乳腺癌4T1耐药小鼠模型产生顺铂耐药性的机制进行初步探讨,为耐药逆转研究提供实验依据。
1 材料与方法
1.1 材料及试剂
注射用顺铂(冻干粉)购自齐鲁制药有限公司(批号:ZWA2A1305034A),RPMI-1640液体培养液、胎牛血清、胰酶、磷酸盐缓冲液(PBS)均为Gibco公司产品;四甲基氮唑蓝(methylthiazolyl tetrazolium,MTT)及DMSO均购自上海生工生物有限公司。TRIZOL提取试剂盒、反转录试剂盒和实时荧光定量PCR试剂盒购自日本TaKaRa公司;实时荧光定量PCR所用引物均由宝生物工程(大连)有限公司合成;抗磷酸化 Akt(phosphorate-Akt,p-Akt)、总 Akt(total-Akt,t-Akt)、内参GAPDH(均为抗兔单克隆抗体)及其相应的二抗均购自美国Cell Signaling公司;P-gp、BCRP、MMP7抗体均购自美国ABCAM公司;EliVision plus试剂盒、DAB试剂盒均购自福州迈新生物科技有限公司,D-luciferin购自上海乐辰生物科技有限公司。
1.2 细胞培养及动物饲养
鼠三阴性乳腺癌细胞株4T1购自中国科学院上海细胞库,用含10%胎牛血清的RMPI-1640培养基培养,培养基中加入100 U/L青霉素和10 mg/mL链霉素。置于37℃、CO2体积分数为5%的恒温培养箱中培养,次日观察细胞贴壁情况并换液。贴壁生长良好的乳腺癌细胞经0.25%胰蛋白酶消化,选用对数生长期细胞进行实验。
SPF级BALB/c雌性小鼠56只,体重16~18 g,其中24只小鼠用于耐药动物模型的建立(每轮6只,共4轮),余32只小鼠用于后续分组研究。小鼠均来源于上海斯莱克实验动物有限责任公司[SCXK(沪)2012-0002],适应性喂养1周,饲养在恒温(23±2)℃,湿度50%~60%,人工光照明暗各12 h的饲养室内,标准饲料和自来水自行取用。
1.3 模型的建立
采用化疗药物诱导耐药及体内外交叉致瘤的方式建立三阴性乳腺癌耐药小鼠模型。将4T1细胞体外培养至对数生长期后按105个/只,接种于6只小鼠的第二乳房垫处,随机均分为2组。待肿瘤组织长至0.5 cm×0.5 cm时(约5 d),模型组(3只)荷瘤小鼠给予腹腔注射0.3 mg/mL DDP,对照组(3只)小鼠给予同等剂量的NS腹腔注射。每周1次,连续4周,给药结束后,在无菌条件下取出各组肿瘤组织,行原代细胞培养。将组织块置于培养皿内,剪碎成米粒样大小,用胰酶反复消化瘤块,将消化下来的肿瘤细胞,按4T1细胞培养条件进行培养。各组原代培养细胞经稳定传代2次后,再接种于小鼠第二乳房垫,每次原代培养细胞均用采用MTT的方法计算耐药倍数。反复4轮体内外交叉致瘤,至耐药倍数达到中度耐药时(耐药倍数5~15倍)为止。最后一轮小鼠给药结束后,2组小鼠各取部分肿瘤组织置于4%多聚甲醛溶液及ˉ80℃冰箱保存用于免疫组化、real-time PCR及western blot检测;剩余肿瘤组织分别行原代细胞培养。
取上述第4轮达中度耐药的原代培养4T1/ DDP细胞,培养至对数生长期,接种于6孔板中,继续培养24 h,当细胞达到70%~80%融合时,进行转染。转染按照Lipofectamine TM 2000试剂操作指南进行操作。转染48 h后,G418筛选抗性细胞及其单克隆化,得到稳定表达荧光素酶的4T1/DDP-luc细胞。取对数生长期的4T1/DDP-luc细胞接种到96孔黑板中,常规培养24 h。第2天采用活体成像仪进行luc发光信号的观察,检测luc的表达,用Living Imaging软件分析处理数据。
取32只小鼠,将上述经鉴定能稳定表达Luc质粒的耐药细胞株4T1/DDP-luc及非耐药细胞株4T1-luc体外培养至对数生长期后,按105个/只,分别接种于4组小鼠的第二乳房垫处,分别建立三阴性乳腺癌耐药及非耐药小鼠模型各16只。待各小鼠肿瘤组织均长至0.5 cm×0.5 cm时(约5 d),16只三阴性乳腺癌小鼠模型随机分组为:Model-A组及DDP-A组,每组各8只小鼠;16只三阴性乳腺癌耐药小鼠模型随机分组为:Model-B组、DDP-B组,每组各8只小鼠。各组小鼠均按0.2 mL/20 g剂量腹腔注射相应药物,给药频次为,给药周期为4周,具体给药为:DDP-A及DDP-B组小鼠给予0.3 mg/mL DDP;模型组-A及模型组-B组小鼠给予0.9%生理盐水。
1.4 M TT法检测细胞药物敏感
分别取对数生长期原代培养4T1细胞(Control组)和4批原代培养的4T1/DDP细胞(Model-1、2、3、4组),调整细胞密度为5×104个/mL,接种于96孔培养板中,每孔100μL。置37℃、CO2体积分数为5%的恒温培养箱中培养。培养24 h后,加药组更换为含不同浓度药物的完全培养液继续培养。每组都设6个复孔,并设置调零孔(只含相应培养液,无细胞)和对照孔(只含细胞、培养液)。待药物组作用24 h后,每孔加入MTT(5 mg/mL)15μL,继续培养4 h,小心吸弃培养液和MTT溶液,每孔加入DMSO 150μL,振荡10 min使充分溶解显色。用全波长酶标仪测定吸光度值(A490),实验重复3次,取平均值,按下式计算细胞生长抑制率。
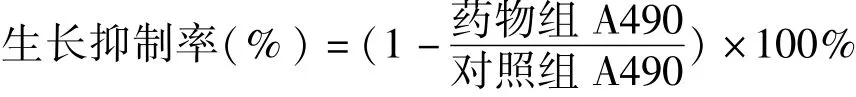
根据生长抑制率,采用SPSS16.0软件计算药物半数抑制浓度(IC50),并按下式计算耐药倍数(RF)。
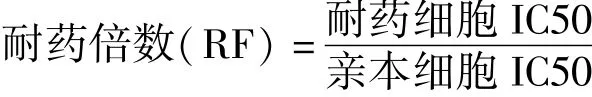
1.5 Real-time PCR检测耐药相关基因
采用TRIZOL法分别提取第4批耐药模型Model-4组以及对照模型Control-4组小鼠肿瘤组织的总RNA,分光光度法测定其纯度及浓度。用反转录试剂盒将各组细胞总RNA反转录,生成cDNA,进一步用MDR1、BCRP、MMP7、GST-π引物及内参GAPDH引物扩增(引物相关信息见表2)。Real-time PCR结果由Rotor-Gene 6软件分析,确定各反应样本的Ct值,采用相对定量的2ˉΔΔCt法计算目的基因的相对表达量,分析各样本之间基因的表达差异。每组取三个样本,取均数。

表1 引物合成表Tab.1 List of primers for the real-time PCR
1.6 免疫组化法检测耐药相关蛋白
取出第4批耐药模型(Model-4组)及对照模型(Control-4组)小鼠肿瘤组织经石蜡包埋,5μm切片,常规脱蜡至水,PBS洗3次,每次3 min;用pH 8.0 0.01 mol/L TE热诱导修复(100℃,15 min),室温自然冷却,PBS洗3次,每次3 min;0.3%H2O2抑制内源性过氧化酶10 min;室温,PBS洗3次,每次3 min;20%正常羊血清室温孵育30 min,不洗,适当稀释特异性一抗(P-gp、BCRP、MMP7抗体以1∶5000稀释)37℃孵育2 h,PBS洗3次,每次3 min;EnVision试剂(HRP-M/R)37℃,30 min;PBS洗3次,每次3 min;DAB显色8~12 min;苏木素衬染色,热水蓝化;吹干后,树脂封片;镜下观察,核紫蓝色,阳性呈棕黄色。每组随机选取5张切片,在200倍视野下,每张切片随机选择阳性细胞表达明显的3个视野作为测定目标。采用Image Pro Plus 6.0软件进行图像分析,比较各组平均吸光度值。
1.7 W estern blot检测Akt磷酸化相关蛋白
提取出第4批耐药模型(Model-4组)及对照模型(Control-4组)小鼠肿瘤组织的蛋白,并定量样本后,将等量的蛋白样品(30μg)加入聚丙烯酰胺凝胶,常规电泳、转膜。用含5%脱脂牛奶的TBST封闭硝酸纤维素膜,室温60 min,分别加入1∶8000稀释的P-gp、MDR1及BCRP抗体及1∶5000稀释的GAPDH(内参照)抗体。置于4℃摇床过夜,用含0.05%Tween 20的PBS(PBST)洗3次,每次5 min,加入1∶8000稀释的二抗室温培育1 h,TBST洗涤3次,加入化学底物发光液结合显影、定影和扫描。用Photoshop Image J软件分析各条带灰度值。以目的条带灰度值/GAPDH条带灰度值的比值表示目的条带的相对表达量。

1.8 动物活体成像检测
取材处理前1 d,所有4组小鼠均行活体成像检测。具体方法如下:实验前10 min将每组老鼠称重,按0.2 mL/20 g体重的量腹腔注射D-luciferin试剂(PBS配比,最终使其浓度为15 mg/mL),用异氟烷将小鼠放人麻醉盒中麻醉,将小鼠安放于成像暗箱内,调整体位为仰卧位,当时间到达注射D-荧光素酶后的15 min,使用精诺真Xenogen IVIS成像向导完成图像拍摄,应用Living Image 4.3(Lumina XR)软件对小鼠体内区域信号进行数据分析。选择反应单位弧度、单位体积、单位时间从体内发出的光子数的Radiance(photons)作为定量单位,即Radiance(p/s/cm2/sr),计算肿瘤灶数目。
1.9 统计学处理
所有实验均平行重复3次,数据以xˉ±s表示。应用SPSS 16.0软件,两两比较采用单因素方差分析,检验水准α=0.05。
2 结果与分析
2.1 形态学观察
将在无菌条件下取出各组肿瘤组织行原代细胞培养,约24 h后几乎所有的细胞都沉积于瓶底,轻晃培养瓶约2/3的细胞随培养液晃动,另1/3细胞贴壁。用PBS冲洗细胞后,显微镜下观察可见,原代培养24 h后细胞呈三角形或多角形,并聚集生长成团块;经1次传代培养后,细胞分散程度较前改善,细胞形态趋于一致;经2次传代培养后,贴壁细胞增殖迅速,形态均一,以多角形为主,胞体饱满(见图1)。

图1 4T1/DDP细胞形态变化(×200)Fig.1 Morphology of 4T1/DDP cells(×200)
2.2 耐药程度测定
MTT法检测原代培养的4T1细胞(Control组)以及4批原代培养的4T1/DDP细胞(Model-1、2、3、4组)对DDP的IC50分别为和5.73、9.50、17.16、36.03μg/mL及 73.63μg/mL,4批原代培养的4T1/DDP细胞对DDP的RF分别为1.66、2.99、6.29及12.84,第4批原代培养的4T1/DDP细胞已达中等耐药程度,可用以后续获得性多药耐药小鼠模型建立(见图2)。
2.3 鉴定4T1/DDP-luc细胞荧光素酶活性
将已获得的稳定表达luc荧光素酶的4T1/DDP细胞置于96孔黑板中,加入底物D-luciferin并轻轻混匀后,运用活体成像系统对贴壁培养的细胞进行成像和图像釆集。图3(左图)显示,4T1/DDP-luc细胞于96孔黑板中检测到的生物发光信号。体内检测,将4T1/DDP-luc细胞接种于小鼠后1周,运用活体成像系统对小鼠进行图像采集。图3(右图)显示,接种了4T1/DDP-luc细胞的小鼠检测到的生物发光信号。
2.4 耐药相关基因表达
Real-time PCR检测结果显示,第4批耐药模型(Model-4组)肿瘤组织中MDR1、BCRP、MMP7及GST-π基因mRNA的表达量均高于control组,差异有统计学意义(P<0.01),分别是control-4组肿瘤组织的2.05倍、3.85倍、3.58倍及3.66倍(见图4)。

图2 顺铂对4T1和4T1/DDP细胞增殖的影响Fig.2 Effect of DDP on proliferation of the 4T1 and 4T1/DDP cells
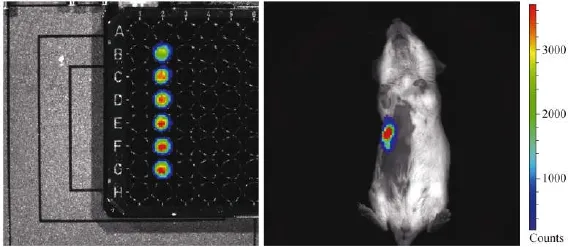
图3 荧光素酶活性鉴定Fig.3 Identification of the luciferase activity
2.5 耐药相关蛋白表达
免疫组化检测结果显示,P-gp、BCRP、MMP7蛋白在第4批耐药模型(Model-4组)肿瘤组织中均较强(棕黄色颗粒为阳性产物),分别为(4.34± 0.56)、(0.98±0.50)、(1.08±0.27);而在Control-4组中表达均较低,分别为(14.93±1.18)、(10.95 ±1.62)、(15.66±1.11),差异均具有统计学意义(P<0.01)(见图5)。
2.6 Akt磷酸化相关蛋白表达
Western blot检测结果显示,在基础状态下第4批耐药模型(Model-4组)肿瘤组织内磷酸化Akt(p-Akt)水平显著高于control-4组,两组t-Akt蛋白表达无明显差异。上述western blot研究结果证实了三阴性乳腺癌获得性多药耐药小鼠模型顺铂诱导三阴性乳腺癌耐药4T1小鼠模型中存在着PI3K/Akt通路改变(见图6)。
2.7 肿瘤动态观察
第4周,通过活体成像系统对采集到的图像进行分析,以radiance(photons)为计量单位,计算各组小鼠体内光子通量。如图7,Mode-A组与Model-B组无明显差异(P>0.05)。与Model-A组相比,DDP-A组光子通量数减少(P<0.01);而与Model-B组相比,DDP-B组光子通量数无明显差异(P>0.05)。可见,DDP对耐药模型小鼠肿瘤的抑制效果明显低于非耐药模型小鼠。

注:**为与control-4组比较差异有显著性(P<0.01)。图4 MDR1、BCRP、MMP7和GST-π的基因在control-4和model-4组肿瘤组织的表达Note.**P<0.01 compared with the control-4 group.Fig.4 ThemRNA expression of MDR1,BCRP,MMP7 and GST-πin the tumor tissues of control-4 and model-4 groups
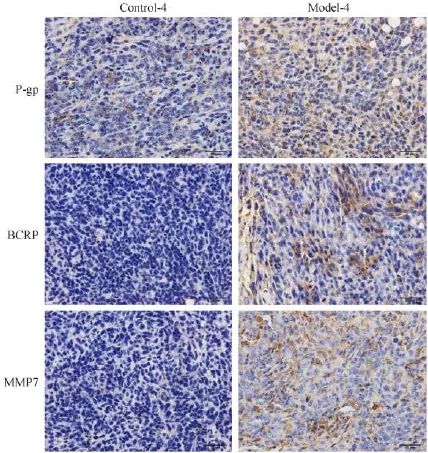
图5 Control-4和model-4组肿瘤组织中P-gp、BCRP和MMP7的蛋白表达(×200)Fig.5 The protein expression of P-gp,BCRP and MMP7 in the tumor tissues of control-4 and model-4 groups(×200)
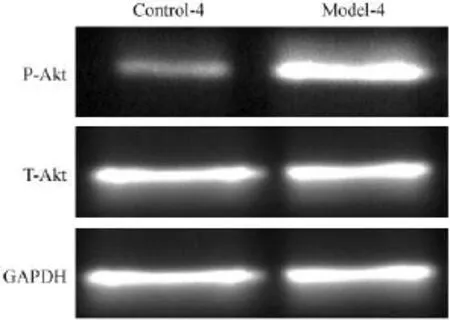
图6 Control-4和Model-4组肿瘤组织中p-Akt、t-Akt的蛋白表达Fig.6 The protein expression of p-Aktand t-Akt in the tumor tissues of control-4 and model-4 groups
3 讨论
顺氯氨铂(cisplatin,DDP),简称顺铂,其抗瘤谱广泛、活性高,且骨髓抑制等副作用较轻[2]。DDP的作用部位是DNA,它与DNA碱基产生链内及链间交叉连结,阻止DNA的转录和复制,从而抑制肿瘤细胞的分裂[3]。三阴性乳腺癌存在一定的DNA损伤修复障碍,因此该类型乳腺癌对铂类药物敏感性较高。DDP物美价廉,治疗效果好,但应用中却发现其容易产生耐药性,部分患者先天和后天对铂类药物具有耐药性[4],严重降低该药物的治疗效果,使其抗肿瘤谱降低,限制了该药物的临床使用。
开发耐药肿瘤模型对于耐药相关基础研究和药物评价意义重大。当前国内外对耐药机制的认识和逆转剂的研究主要来自体外细胞实验的研究成果,研究对象是体外诱导的耐药细胞,并不能很好地反映体内肿瘤耐药形成的情况。肿瘤动物模型水平的研究比肿瘤细胞培养水平的研究更能模拟人体内的肿瘤生长情况。目前常用的耐药肿瘤的动物模型建立方法有三种:转基因法[5]、耐药性肿瘤细胞悬液移植法[6]及药物诱导法[7]。
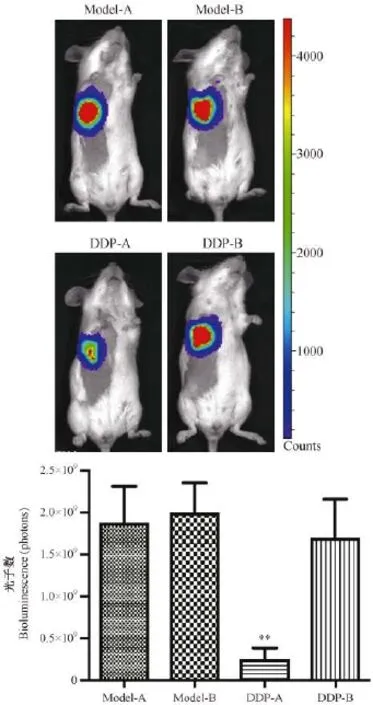
注:**为与model-A组比较差异及其显著(P<0.01)。图7 小鼠体内光子通量数测定Note.**P<0.01 compared with themodel-A group.Fig.7 Determination of the number of photons in vivo
但随着研究的深入,我们发现药物耐药的形成机制众多,主要包括外排蛋白的表达增加或活性提高、细胞解毒系统活力增强、抗肿瘤靶点改变以及凋亡应答失敏等。这些因素并非独立存在,往往相互关联,共同介导了耐药的发生[8,9]。因此,类似转基因法这种借助单一因素建立的多药耐药肿瘤动物模型难以模拟真实情况。而另两种方法相比较,耐药性肿瘤细胞悬液移植法简单易行,在已有耐药细胞株的前提下实验周期短,应用较广;而药物诱导法则相对周期较长,但却更能模拟临床实际情况。目前,乳腺癌耐药研究中应用较多的是激素受体阳性乳腺癌,针对三阴性乳腺癌的较少,且主要集中于阿霉素诱导耐药,尚未有顺铂诱导的耐药细胞模型。此外,由于耐药细胞株构建时间较长,一般需要9~12个月,因此,本研究采用了药物诱导法建立三阴性乳腺癌耐药4T1小鼠模型,并在传统的化疗药物单纯诱导的基础上进行了改进,增加了体内外交叉致瘤的方法。将体外培养的对数生长期的三阴性乳腺癌4T1细胞接种在小鼠第二乳房垫,形成肿瘤后,低剂量DDP体内持续给药4周诱导耐药发生,采用肿瘤组织块行体外原代培养细胞,再将此原代培养细胞分别于新一批小鼠第二乳房垫接种致瘤;反复4次。采用此种体内外交叉进行致瘤的方法,逐步提高耐药性,不仅模拟临床耐药形成条件,还提高了耐药细胞的致瘤率和缩短致瘤时间,并在诱导过程中做到了对耐药性的实时监测,且整个建模时间缩短为4个月。
经测定第4批原代培养4T1/DDP细胞对DDP的RF为12.84,已达中等耐药程度。通过real-time PCR及免疫组化鉴定该耐药细胞的特性,MDR1、BCRP、MMP7及GST-π基因及P-gp、BCRP、MMP7蛋白均显示其在三阴性乳腺癌4T1耐药小鼠模型的肿瘤组织中呈现高表达,而在非耐药小鼠模型的肿瘤组织中均呈现阴性表达。此外,通过western blot检测还发现,通过此种方法建立的三阴性乳腺癌获得性多药耐药小鼠模型中存在着Akt磷酸化的改变。通过小动物活体成像仪对各组小鼠体内肿瘤生长状态进行直观观测发现,经过4周生长非耐药小鼠与耐药小鼠肿瘤组织大小未见明显区别(P>0.05)。而给予这两种模型小鼠相同剂量的DDP治疗后,耐药小鼠对DDP的敏感性明显低于非耐药小鼠(P<0.01),提示接种了4T1/DDP-luc细胞的模型小鼠体内发生了耐药。良好的耐药模型的建立是进行下游实验的基础,该耐药动物模型的建立,为三阴性乳腺癌临床个体化治疗及耐药逆转研究等提供了良好的实验动物平台。
[1] Rottenberg S,Nygren AO,Pajic M,et al.Selective induction of chemotherapy resistance of mammary tumors in a conditional mousemodel for hereditary breast cancer[J].Proc Natl Acad Sci U SA,2007,104(29):12117ˉ12122.
[2] 杨乐,刘文超,李蓉.顺铂水针剂与粉针剂体外细胞毒作用的差异研究[J].现代肿瘤医学,2008,16(5):1101ˉ1102.
[3] 郭青龙.肿瘤药理学[M].北京化学工业出版社,2008,第1版:140ˉ141.
[4] Lieder B,Matema V,Schadendorf D,et al.Over-expression of cMOAT(MRP2/ABCC2)is associated with decreased formation of platinum-DNA adducts and decreased G2-arrest in melanoma cells resistant to DDP[J].Invest Dermatol,2009,121(1):172ˉ 176.
[5] Van de VrieW,Marquet RL,Stoter G,et al.In vivomodel in P-glycoprotein-mediated multidrug resistance[J].Crit Rev Clin Lab Sci,1998,35(1):lˉ57.
[6] Satta T,Isobe K,YamauchiM,et al.Establishment of drug resistance in human gastric and colon carcinoma xenograft lines[J]. Jpn JCancer Res,1991,82(2):593ˉ598.
[7] Ihnat MA,Nervi AM,Anthony SP,et al.Effects of mitomycin C and carboplatin pretreatment on multidrug resistance-associated P-glycoprotein expression and on subsequent suppression of tumor growth by doxorubicin and paclitaxel in human metastatic breast cancer xenografted nudemice[J].Oncol Res,1999,11(7):303 ˉ310.
[8] 岑娟,李运曼.多药耐药肿瘤的联合用药[J].国外医药:抗生素分册,2009,30(5):224ˉ228.
[9] Filipits M.Mechanisms of cancer:multidrug resistance[J].Drug Discov Today:Dis Mech,2004,1(2):229ˉ234.
Fstablishment of a cisplatin-resistantmousemodel of 4T1 triple negative breast cancer
SHENG Jia-yu,CHEN Hong-feng*
(Department of Breast Surgery,Longhua Hospital,Shanghai University of Traditional Chinese Medicine,Shanghai200032,China)
【Abstract】ObjectiveTo establish a cisplatin-resistant4T1 mousemodel of triple negative breast cancer.M ethodsA drug resistantmice model was established with cisplatin(DDP)induction and in-vivo/in-vitro tumorigenic approach.Its resistance characteristics were identified by MTT assay.Changes of drug resistance gene(MDR1,BCRP,MMP7,GST-π)and protein(P-gp,BCRP,MMP7)expression,and phosphorate-Akt and total-Akt protein expression were evaluated by real-time PCR,immunohistochemistry and western blotmethod,respectively.Small animal live imaging technology was applied to detect tumor growth.ResultsResistance fold(RF)of cisplatin-resistant4T1 mousemodelwas 12.84.The expression of MDR1,BCRP,MMP 7,GST-πmRNA and P-gp,BCRP,MMP 7 proteins in the resistantmice were higher than that in the non-resistantmice.The result ofwestern blot showed that a statistically higher expression of p-Akt in resistantmice than that in non-resistantmice at protein levels(P<0.01).No significant difference of tumor growth rate was observed between non-resistant and resistantmice(P>0.05).Given same dose of DDP,resistantmice showed lower sensitivity than non-resistantmice significantly(P<0.01).ConclusionsWe have successfully established a cisplatin-resistant triple negative breast cancermodel inmice,which provides a new platform for further study on chemoresistant reversal strategy and individualized clinical treatment of this disease.
【Key words】Triple negative breast cancer;Neoplasm drug resistance;Cisplatin;Animalmodels;Mice
Q95-33
A
1005-4847(2015)05-0466-08
10.3969/j.issn.1005ˉ4847.2015.05.005
2015-04-14
国家自然科学基金资助项目(81373647)。
盛佳钰(1983ˉ),女,博士研究生,主治医师,研究方向:中医药防治乳腺癌研究。E-mail:shengjiayu@gmail.com
陈红风。E-mail:chhfluk@126.com