天津市城区肺结核患者对吡嗪酰胺耐药的现状及特征
2015-05-25张国钦商健张玉华钟达陈盛玉傅衍勇
张国钦 商健 张玉华 钟达 陈盛玉 傅衍勇
·论著·
天津市城区肺结核患者对吡嗪酰胺耐药的现状及特征
张国钦 商健 张玉华 钟达 陈盛玉 傅衍勇
目的 了解天津市城区肺结核患者对吡嗪酰胺(PZA)耐药的现状及特征。 方法 应用Bactec MGIT 960系统,对2011—2013年天津市结核病控制中心门诊部确诊的痰培养阳性肺结核患者进行一线抗结核药物的药敏试验,以812例有药物敏感性试验(简称“药敏试验”)结果的患者为研究对象,分析PZA耐药情况。 结果 初治肺结核患者PZA耐药率为2.8%(20/706),复治患者为7.5%(8/106),差异有统计学意义(χ2=6.15,P=0.01)。MDR-TB患者的PZA耐药率为32.0%(16/50),高于非MDR-TB患者的1.6%(12/762)(χ2=130.46,P<0.01)。INH、RFP、EMB、Sm耐药和敏感患者的PZA耐药率分别为18.7%(26/139)、0.3%(2/673)、32.7%(17/52)、1.4%(11/760)和60.9%(14/23)、1.8%(14/789)、14.8%(18/122)、1.4%(10/690),差异均有统计学意义(χ2值分别为117.25、142.71、234.40和55.12,P值均<0.01)。经多因素分析,外地人口(Waldχ2=6.31,P=0.01,OR=5.02,95%CI=1.43~17.68)、INH耐药(Waldχ2=10.90,P<0.01,OR=18.25,95%CI=3.26~102.26)、RFP耐药(Waldχ2=3.76,P=0.05,OR=3.28,95%CI=0.99~10.91)、EMB耐药(Waldχ2=22.87,P<0.01,OR=24.60,95%CI=6.62~91.41)是PZA耐药危险因素。结论 PZA耐药与其他一线药耐药性有关联,PZA耐药率在MDR患者中较高,应重视对MDR-TB患者进行PZA药敏试验。
结核, 肺; 吡嗪酰胺; 抗药性, 细菌; 天津市
肺结核千百年来一直威胁着人类健康。尽管20世纪以来,抗结核化疗药物的应用使得大部分肺结核患者可以被治愈,然而近年来耐药结核分枝杆菌的流行加上抗结核新药和疫苗研发的滞后,使得结核病控制面临严峻挑战[1]。2012年,全球肺结核发病860万例,其中45万例为耐多药结核病(MDR-TB);中国是世界第二大结核病高负担国家,肺结核年发病约100万例,其中MDR-TB 12万例[2]。吡嗪酰胺(PZA)是5种一线抗结核药物中的强杀菌药,不仅是肺结核标准化治疗方案的重要成分,也被归为MDR-TB治疗的第一组药物,全程应用于MDR-TB和XDR-TB的24个月和30个月标准化治疗方案中[3]。然而,由于PZA体外试验对培养条件的特殊要求,改良罗氏培养(L-J)法尚不能检测PZA的耐药性[4]。因此,虽然其他4种一线抗结核药物的耐药性检测已逐步开展,但是对PZA耐药的情况少有报道,也未包含在全国抗结核药物耐药性监测中[5]。了解肺结核患者对PZA的耐药情况及特征,对肺结核的临床治疗、耐药肺结核的防治有重大意义。
对象和方法
一、资料来源
天津市结核病控制中心门诊部代管城区(包括和平区、河北区、河东区、南开区、红桥区,共5个区)结核病诊疗工作,自2011年开展基于Bactec MGIT 960液体培养的PZA药物敏感性试验(简称“药敏试验”)。2011—2013年间,在该门诊部共确诊活动性肺结核患者2193例,1083例(49.4%)痰培养阳性,其中,排除丢失、迁出或拒绝检查等未做药敏试验的患者外,共812例(75.0%)有药敏试验结果的培养阳性患者作为研究对象,通过统一门诊病历获取临床和流行病学资料。肺结核诊断及分类依据《中国结核病防治规划实施工作指南(2008年版)》[6]。
二、实验室检查
采用美国BD公司生产的Bactec MGIT 960全自动分析仪,通过连续检测接种标本培养管的荧光强度判断是否有分枝杆菌生长。培养阳性的菌液进行异烟肼(INH)、利福平(RFP)、乙胺丁醇(EMB)、链霉素(Sm)和吡嗪酰胺(PZA)的药敏试验。操作步骤如下。
1. 痰标本处理:5 ml痰液以等量的N-乙酰-L半胱氨酸+2%NaOH消化液处理,震荡静置后加入磷酸盐缓冲液(PBS)(pH值=6.8),以3000×g离心15 min,倒去上清液后再加入1~3 ml PBS,中和pH值至6.8。
2. 液体培养:采用BactecTMMGITTM960 Growth Supplement(生长添加剂)、BactecTMMGITTM960 PANTA(杂菌抑制剂)和BBL MGITTM7 ml tube(7 ml培养管)。在7 ml培养管中加入0.8 ml生长添加剂溶解后的杂菌抑制剂,接种0.5 ml处理过的标本,另接种1滴标本至分枝杆菌固体培养基和血平板培养基以检测是否污染。
3. 药敏试验:采用比例法,使用SIRE和PZA两种药敏试验试剂盒,药敏试验判断的临界度为1%。SIRE 试剂盒(Sm:332 μg;INH:33.2 μg;RFP:332 μg;EMB:1660 μg)用4 ml无菌蒸馏水溶解;PZA 试剂盒(PZA:20 000 μg)用2.5 ml无菌蒸馏水溶解。在标记的相应MGIT管中加入0.8 ml BactecTMMGITTM960 SIRE、PZA 100 μl,每种药物及未稀释的菌液0.5 ml,以0.5 ml 1∶100稀释后的菌液接种于生长控制管。
三、质量控制
用Middlebrook 7H9液体培养基配制的美国菌种保藏中心(American Type Culture Collection,ATCC)标准质控菌株的菌悬液检验每批产品的质量,MGIT培养管应在规定范围内报出阳性结果,如超出预期则不用该批次产品。
四、分析方法
应用χ2检验比较PZA耐药与敏感患者的一般情况、临床特征差异,分析PZA耐药与其他一线抗结核药物耐药的关系,采用单因素及logistic回归的多因素分析。应用SAS 9.13统计软件,α=0.05(美国SAS软件研究所)。
结 果
一、一般情况
研究对象中男551例(67.9%),女261例(32.1%);本地户籍618例(76.1%),外地户籍194例(23.9%);涂阳360例(44.3%),涂阴452例(55.7%);初治706例(87.0%),复治106例(13.0%);年龄呈非正态分布(P<0.01,偏度=0.63),中位年龄33岁(24,54)。
二、PZA耐药概况
5种一线抗结核药物中,初复治患者均以INH和Sm的耐药率最高(表1),PZA耐药率仅稍高于EMB,低于其他药物耐药率及耐多药率。在所有研究对象中,PZA耐药率为3.4%(28/812),其中初治患者为2.8%(20/706),复治患者为7.5%(8/106),初复治患者的PZA耐药率差异有统计学意义(χ2=6.15,P=0.01)。

表1 2011—2013年天津市城区肺结核患者一线抗结核药物耐药结果(Bactec MGIT 960法)
注a:二项分布法获得的可信区间
三、PZA耐药与其他药物耐药的关系
在28例PZA耐药患者中,单耐PZA占3.6%(1/28),其余患者同时对其他一线抗结核药物耐药(图1)。PZA耐药患者同时耐INH、RFP、EMB和Sm的比率分别为92.9%(26/28)、60.7%(17/28)、50.0%(14/28)、64.3%(18/28),其中57.1%(16/28)为耐多药患者。

图1 PZA耐药患者对其他一线抗结核药物耐药情况
INH耐药和敏感患者对PZA的耐药率分别为18.7%(26/139)和0.3%(2/673),差异有统计学意义(χ2=117.25,P<0.01);RFP耐药和敏感患者对PZA耐药率分别为32.7%(17/52)和1.4%(11/760),差异有统计学意义(χ2=142.71,P<0.01);EMB耐药和敏感患者对PZA耐药率分别为60.9%(14/23)和1.8%(14/789),差异有统计学意义(χ2=234.40,P<0.01);Sm耐药和敏感患者对PZA耐药率分别为14.8%(18/122)和1.4%(10/690),差异有统计学意义(χ2=55.12,P<0.01)。耐多药患者的PZA耐药率为32.0%(16/50),非耐多药患者的PZA的耐药率为1.6%(12/762),两组差异有统计学意义(χ2=130.46,P<0.01)。对其余4种药物耐药患者同时耐PZA的情况见图2所示。

图2 对其余4种一线抗结核药物耐药患者的PZA耐药情况
四、PZA耐药相关因素
比较PZA敏感和耐药患者的流行病学和临床特征,见表2所示。两组患者的初复治分类的差异有统计学意义(χ2=6.15,P<0.05),复治对PZA耐药的OR值为2.8(95%CI:1.2~6.5),而两组患者性别、年龄、户籍、学历、痰涂片、有无空洞、是否合并肺外结核和糖尿病的差异均无统计学意义(P值均>0.05)。
以PZA是否耐药为因变量,将可能与PZA耐药相关的因素引入多因素logistic回归分析,变量及赋值见表3所示,分析结果见表4所示。最终户籍类型及INH、RFP、EMB耐药与PZA耐药的关联有统计学意义,对PZA耐药的调整OR值分别为5.02(95%CI:1.43~17.68)、18.25(95%CI:3.26~102.26)、3.28(95%CI:0.99~10.91)、24.60(95%CI:6.62~91.41)。
讨 论
Bactec MGIT 960为世界卫生组织推荐的液体药敏系统。与传统L-J法相比,Bactec MGIT 960法虽然价格高,但对结核分枝杆菌培养的敏感度更高、时间更短,对一线抗结核药物敏感性检测结果与传统方法具有很好的一致性[7-8]。本研究对象中,初复治肺结核患者对除PZA以外其余4种一线抗结核药物的耐药率低于2007年全国调查的耐药水平,其中初复治患者耐多药率分别为4.7%和16.0%,低于全国水平的5.7%和25.6%[5]。较低的耐药水平与天津市肺结核总体疫情处于全国较低水平相一致[9]。但由于全国耐药基线调查采用L-J法,无法比较PZA耐药情况[5]。该研究对象结果显示,初复治肺结核患者PZA耐药率分别为2.8%和7.6%,初治患者的PZA耐药率与1999—2009年美国肺结核患者PZA总体耐药率2.7%、非耐多药患者耐药率2.2%相近[10]。现有Meta分析显示,非耐多药肺结核患者的PZA耐药率的中位数为5%(0~9%),高于本次结果[11]。国内梁庆福等[12]报道,福建省2008—2011年收集的218株菌株中,源于初复治患者菌株的PZA耐药率分别为14.1%(23/163)和29.1%(16/55),远高于本研究的结果,但其研究的菌株中耐多药比例高达41.7%(91/218),而单独对非耐多药的菌株进行分析,PZA耐药率为2.4%,与该研究中非耐多药患者的PZA耐药率1.6%接近。
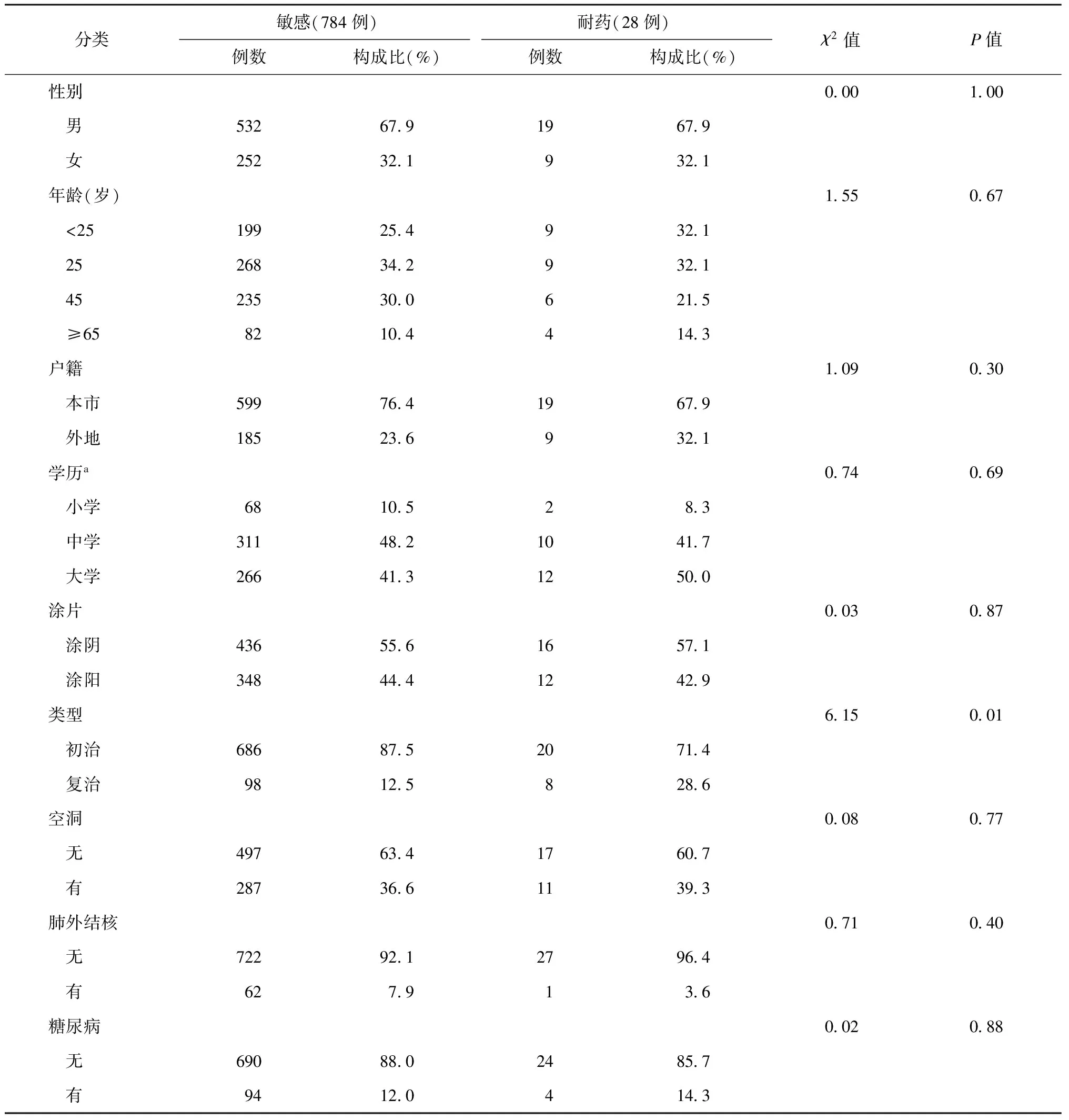
表2 812例PZA敏感与耐药患者一般特征、临床特征比较
注a:学历一项分类中,部分患者信息不全,故总例数少于812例

表3 多因素分析变量赋值

表4 PZA耐药相关因素多因素logistic回归分析结果
复治是肺结核耐药的主要危险因素。此外,特定年龄段、流动人口等流行病学因素,临床表现也与抗结核药物耐药具有相关性[13-16]。1999—2009年美国肺结核患者PZA耐药还与0~24岁年龄、HIV感染和合并肺外结核等因素有统计学关联[10]。但在该研究中,PZA耐药除了外地人口具有更高风险外,与INH、RFP、EMB耐药相关性更为突出,其调整OR值分别为18.3、3.3和24.6,而单耐PZA少见。单耐PZA而对其他药物敏感的患者很可能感染的为牛分枝杆菌,美国1999—2009年在625例单耐PZA的菌株中,68.3%为牛分枝杆菌[10]。但本研究对象的菌株并未进行菌株分型,因而无法获知牛分枝杆菌感染情况。但PZA与其他3种抗结核药物有强的关联性,提示PZA与这些药物存在交叉耐药的可能性。本次分析显示,在耐多药患者中PZA耐药率为32.0%,远高于非耐多药患者1.6%的PZA耐药率,与其他报道的结果相近[10-11,17-19]。美国的监测显示,耐多药患者的PZA耐药率为38.0%,高于非耐多药患者的2.2%。南非一项研究发现,PZA在耐多药患者和其他一线药物全敏感患者中的耐药率分别为52.1%和10.2%[17]。日本一项报道也显示耐多药患者的PZA耐药率为53%[18]。国内福建省218例菌株的检测结果显示,耐多药患者的PZA耐药率为39.6%,而非耐多药患者的PZA耐药率为2.4%[12]。另一项对95例耐多药患者进行pncA法和Bactec MGIT 960法进行PZA检测也显示,耐多药患者的PZA耐药率为54.7%[19]。现有研究的Meta分析显示,耐多药患者中PZA的耐药率中位数为51%(31%~89%),高于非耐多药患者的5%(0~9%)[11]。因此,尽管总体上PZA耐药率相对较低,但在其他一线药物耐药的患者及耐多药患者中PZA耐药率较高。一方面,说明在普通肺结核标准化治疗方案中,PZA作为强杀菌药仍然具有很重要的作用;另一方面,对于耐药肺结核患者,尤其是耐多药和广泛耐药患者的治疗中,至少应包括4种有效抗结核药物,PZA耐药高发将对其治疗产生不利影响[20]。因此,制定耐多药结核病和广泛耐药结核病患者化疗方案时,应该重视推行对PZA进行药敏试验。
本研究的局限性:研究对象为天津市城区结核病定点医疗机构确诊肺结核患者,而非抽样调查获得,获得PZA耐药率在外推时受到限制;研究对象多数为门诊患者,未包含重症住院患者,因此PZA耐药率可能被低估。
[1] Lönnroth K, Castro KG, Chakaya JM, et al. Tuberculosis control and elimination 2010-50: cure, care, and social deve-lopment. Lancet, 375(9728): 1814-1829.
[2] World Health Organization. Global TB report, 2013. Geneva: World Health Organization, 2013.
[3] 王宇. 耐多药肺结核防治管理工作方案. 北京: 军事医学科学出版社, 2012.
[4] Zhang Y, Mitchison D. The curious characteristics of pyrazinamide: a review. Int J Tuberc Lung Dis, 2003, 7(1):6-21.
[5] 中华人民共和国卫生部. 全国结核病耐药性基线调查报告(2007—2008年). 北京: 人民卫生出版社, 2010.
[6] 中华人民共和国卫生部疾病预防控制局, 中华人民共和国卫生部医政司, 中国疾病预防控制中心. 中国结核病防治规划实施工作指南(2008年版). 北京: 中国协和医科大学出版社, 2009: 38-40.
[7] 王巍, 李洪敏, 王安生, 等. BACTEC-MGIT 960快速培养药敏对肺结核诊治的应用和评价. 中国防痨杂志, 2003, 25(6): 379-381.
[8] 赵丽丽, 夏强, 刘志广, 等. MGIT 960和比例法对结核分枝杆菌药物敏感性试验的对比研究. 医学研究杂志, 2011, 40(5): 40-43.
[9] 肖东楼. 全国结核病防治规划(2001—2010年)终期评估报告. 北京: 军事科学出版社, 2011:110-130.
[10] Kurbatova EV, Cavanaugh JS, Dalton T, et al. Epidemiology of pyrazinamide-resistant tuberculosis in the United States, 1999—2009. Clin Infect Dis, 2013, 57(8): 1081-1093.
[11] Chang KC, Yew WW, Zhang Y. Pyrazinamide susceptibility testing inMycobacteriumtuberculosis: a systematic review with meta-analyses. Antimicrob Agents Chemother, 2011, 55(10):4499-4505.
[12] 梁庆福, 郑金凤, 陈求扬, 等. 218例涂阳肺结核吡嗪酰胺耐药情况分析. 中国人兽共患病学报, 2012, 28(10): 1000-1002.
[13] Shen X, DeRiemer K, Yuan ZA, et al. Drug-resistant tuberculosis in Shanghai, China, 2000-2006: prevalence, trends and risk factors. Int J Tuberc Lung Dis, 2009, 13(2):253-259.
[14] Espinal MA, Laserson K, Camacho M, et al. Determinants of drug-resistant tuberculosis: analysis of 11 countries. Int J Tuberc Lung Dis, 2001, 5(10):887-893.
[15] Lomtadze N, Aspindzelashvili R, Janjgava M, et al. Prevalence and risk factors for multidrug-resistant tuberculosis in the Republic of Georgia: a population-based study. Int J Tuberc Lung Dis, 2009, 13(1):68-73.
[16] Dalton T, Cegielski P, Akksilp S, et al. Prevalence of and risk factors for resistance to second-line drugs in people with multidrug-resistant tuberculosis in eight countries: a prospective cohort study. Lancet, 2012, 380(9851): 1406-1417.
[17] Mphahlele M, Syre H, Valvatne H, et al. Pyrazinamide resistance among South African multidrug-resistantMycobacteriumtuberculosisisolates. J Clin Microbiol, 2008, 46(10):3459-3464.
[18] Ando H, Mitarai S, Kondo Y, et al. Pyrazinamide resistance in multidrug-resistantMycobacteriumtuberculosisisolates in Japan. Clin Microbiol Infect, 2010, 16(8):1164-1168.
[19] 孙冰梅, 朱婕, 高静. 耐多药结核分枝杆菌临床分离株吡嗪酰胺耐药基因pncA的检测. 山西医药杂志, 2007, 36(7): 665-666.
[20] Hoek KG, Schaaf HS, Gey van Pittius NC, et al. Resistance to pyrazinamide and ethambutol compromises MDR/XDR-TB treatment. S Afr Med J, 2009, 99(11):785-787.
(本文编辑:郭萌)
Prevalence and characteristic of Pyrazinamide resistance among pulmonary tuberculosis patients in urban area in Tianjin
ZHANGGuo-qin,SHANGJian,ZHANGYu-hua,ZHONGDa,CHENSheng-yu,FUYan-yong.
TianjinCenterforTuberculosisControl,Tianjin300041,China
Correspondingauthor:ZHONGDa,Email:zhongdada321@163.com
Objective To understand the prevalence and characteristics of Pyrazinamide (PZA) resistance among pulmonary tuberculosis (PTB) patients in urban area in Tianjin. Methods Bactec MGIT 960 system was used to test the susceptibility of first line anti-TB drugs for culture positive PTB patients diagnosed in clinic department of Tianjin Center for TB Control during 2011 to 2013. Eight hundred and twelve patients with drug susceptibility test results were enrolled to analyze the prevalence and characteristics of PZA resistance. Results Among new patients 2.8% (20/706) were resistant to PZA compared to 7.5% (8/106) among previously treated patients (χ2=6.15,P<0.05), and the difference was statistically significant (χ2=6.15,P=0.01). Among MDR-TB patients 32.0% (16/50) were resistant to PZA, which was significantly higher than 1.6% (12/762) among non MDR-TB patients (χ2=130.46,P<0.01). Among patients with and without INH resistance, RFP resistance, EMB resistance and Sm resistance, the proportions of PZA resistance were respectively 18.7% (26/139) vs 0.3% (2/673), 32.7% (17/52) vs 1.4% (11/760), 60.9%(14/23)vs 1.8% (14/789) and 14.8% (18/122) vs 1.4% (10/690), and the differences were statistically significant (χ2were respectively 117.25, 142.71, 234.40 and 55.12,P<0.01). In multivariate analysis, migrants (Waldχ2=6.31,P=0.01,OR=5.02,95%CI=1.43—17.68), resistances to INH(Waldχ2=10.90,P<0.01,OR=18.25, 95%CI=3.26—102.26), resistance to RFP(Waldχ2=3.76,P=0.05,OR=3.28, 95%CI=0.99—10.91) and resistance to EMB (Waldχ2=22.87,P<0.01,OR=24.60, 95%CI=6.62—91.41) were risk factors to PZA resistance. Conclusion PZA resistance has relation to resistance to other first line anti-TB drugs, and proportion of PZA resistance was significant higher among MDR-TB patients, which emphasizes the importance to test susceptibility of PZA among MDR-TB patients.
Tuberculosis, pulmonary; Pyrazinamide; Drug resistance, bacterial; Tianjin city
10.3969/j.issn.1000-6621.2015.05.009
300041 天津市结核病控制中心
钟达,Email:zhongdada321@163.com
2014-12-12)
