厄洛替尼联合鞘内化疗治疗非小细胞肺癌脑膜转移的临床效果
2015-05-24严伟红罗庆芬孙成晖
严伟红 李 艺 罗庆芬 孙成晖▲
1.广东省阳春市人民医院肿瘤科,广东阳春 529600;2.广东省阳春市人民医院耳鼻喉科,广东阳春 529600;3.广东省阳春市人民医院外四科,广东阳春 529600
目前的流行病学研究结果显示,肺癌的发病率及死亡率都在不断增高[1],而研究显示在所有确诊的肺癌患者中,约40%的患者发生脑实质的转移,并且有10%~26%的患者会发生脑膜转移[2]。目前对于肺癌脑膜转移的治疗方案主要有全脑放疗及鞘内化疗,但效果并不理想。近年来随着医学的不断发展,靶向药物逐渐崭露头角,尤其在非小细胞肺癌的治疗中,表皮生长因子受体酪氨酸激酶抑制剂的应用为肿瘤科医生开创了靶向治疗的新时代,目前在晚期非小细胞肺癌的一线治疗、维持治疗、二线中,厄洛替尼作为一种表皮生长因子酪氨酸激酶抑制剂是重要的可选药物。但是目前国内外评估应用厄洛替尼治疗非小细胞肺癌脑膜转移的病例报道较少,为进一步明确厄洛替尼在非小细胞肺癌脑膜转移中的治疗效果,笔者将我院自2007年1月~2012年12月收治的确诊为非小细胞肺癌脑膜转移的患者进行筛选,对符合筛选标准的患者进行回顾性分析,评价应用厄洛替尼治疗的效果。
1 资料与方法
1.1 一般资料
选择广东省阳春市人民医院肿瘤科于2007年1月~2012年12月收治的确诊为非小细胞肺癌脑膜转移的患者46例,根据患者所接受的治疗方案不同分为观察组(鞘内化疗联合厄洛替尼,n=17)和对照组(鞘内化疗,n=29)。其中观察组17例患者中,男5例,女12 例,平均年龄为(54.3±7.6)岁,病理类型:11 例为腺癌,6例为鳞癌;对照组29例患者中,男14例,女15 例,平均年龄为(56.2±8.3)岁,病理类型:17 例为腺癌,12例为鳞癌。两组患者性别、年龄、病理类型等临床特征比较,差异无统计学意义(P>0.05),具有可比性。
1.2 入选标准
①患者经病理学检查确诊为非小细胞肺癌,且经脑脊液检查发现癌细胞确诊为脑膜转移,既往接受过1个或1个以上不同化疗方案全身化疗;②患者确诊脑膜转移后接受过鞘内化疗,放疗并联合厄洛替尼治疗;③生存期>3个月,KPS评分≥70分,近期疗效可评价;④临床病历资料齐全;⑤无神经系统并发症发生。
1.3 方法
观察组患者接受鞘内化疗,同时应用厄洛替尼治疗;对照组患者接受鞘内化疗。
1.3.1 鞘内化疗方案 选取化疗药物甲氨蝶呤(生产厂家:上海医药有限公司华联制药厂,批号:070103B、080402A),每周2次鞘内注射5 mg/m2,所有患者连续给药至少4周。用药过程中注意观察患者有无神经系统并发症发生。
1.3.2 厄洛替尼治疗方案 观察组患者自确诊发生脑膜转移后开始口服厄洛替尼(生产厂家:瑞士罗氏公司,批号:20060902)150 mg,1 次/d,口服,直至疾病进展或无法耐受不良反应。
1.4 疗效评价标准
1.4.1 脑脊液癌细胞转阴率 如患者脑脊液细胞学检查未找到癌细胞,将其定义为脑脊液癌细胞转阴,计算每组患者的脑脊液癌细胞转阴率。
1.4.2 症状缓解率 根据患者脑膜刺激征症状(头痛,头晕、呕吐)缓解情况进行评价。于患者鞘内化疗结束后至少2周,停用减轻脑水肿药物至少1周以上时评价患者脑膜转移症状缓解情况,如症状完全消失评价为缓解,如任何一种症状仍然存在评价为未缓解。
1.4.3 无进展生存期 患者自确诊脑膜转移接受治疗至病情进展或死亡的时间。
1.5 统计学方法
数据采用SPSS 17.0软件进行统计分析,计数资料比较采用χ2检验,无进展生存期采用Kaplan-Meier法获得,并经long-rank检验,以P<0.05为差异有统计学意义。
2 结果
2.1 两组患者脑脊液癌细胞转阴率、脑膜转移症状缓解率的比较
观察组与对照组脑脊液癌细胞转阴率分别为52.9%和24.1%,两组比较差异有统计学意义 (P<0.05)。观察组与对照组脑膜转移症状缓解率分别为64.7%和31.0%,两组比较差异有统计学意义(P<0.05)。
2.2 两组患者无进展生存期的比较
观察组与对照组中位无进展生存期分别为5.3个月和3.4个月,两组比较差异有统计学意义 (P<0.05),无进展生存期生存曲线见图1。
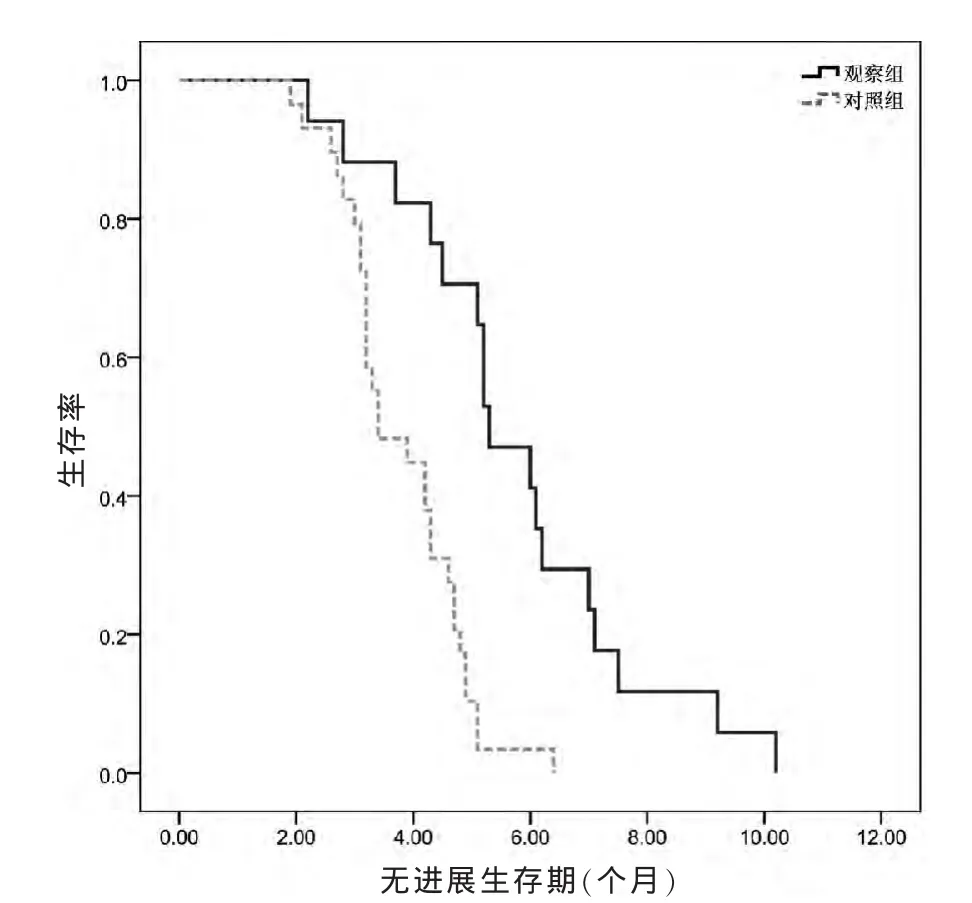
图1 两组患者无进展生存期Kaplan-Meier生存曲线
2.3 两组不良反应发生率的比较
两组患者治疗后发生的不良反应主要为粒细胞减少、贫血、乏力、皮疹,未观察到有血小板减少、腹泻、肝功能异常及特异的神经系统症状等并发症的发生。两组患者粒细胞减少、贫血、乏力发生率相近,观察组中有3例患者出现了轻度的皮疹(表1),但患者均可耐受,未因此而更改治疗计划或延长住院时间。
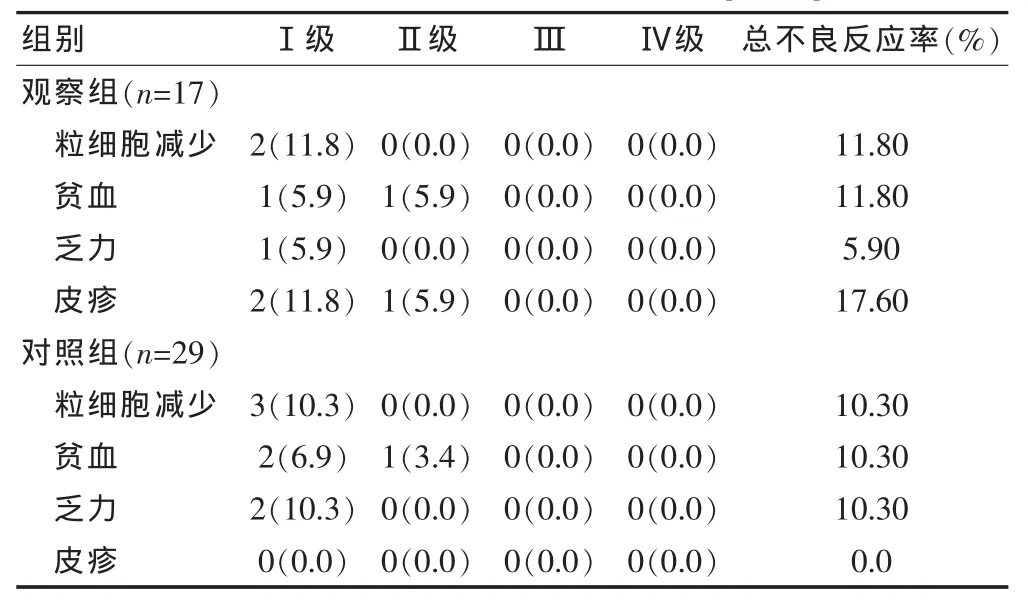
表1 两组患者主要不良反应的统计[n(%)]
3 讨论
由于医疗水平的不断提高,肿瘤患者的生存期得到延长,肿瘤患者发生全身多处转移以及脑膜转移的概率较以往增高,同时目前CT、MRI、脑脊液检查等检查项目的普及应用使得既往无法明确诊断为脑膜转移的患者能够得到确诊,以上因素使得目前确诊为脑膜转移的患者不断增多。而肺癌由于其高发病率而成为发生脑膜转移瘤最常见的肿瘤类型之一[3]。肺癌患者发生脑膜转移的转移途径为血行转移,肿瘤细胞由肿瘤原发灶脱离后经血液运输到脑膜。癌细胞通过对软脑膜侵蚀使脑脊液循环障碍,可产生头疼、头晕、恶心呕吐、意识不清等相应的脑神经系统症状。
目前对于非小细胞肺癌脑膜转移并没有一个标准的治疗方案,全身化疗因药物很难通过血-脑脊液屏障,所以疗效不佳,较少采用。目前的治疗方法主要包括鞘内化疗及全脑放疗,但脑膜转移癌对鞘内化疗的反应率较低,效果不理想[4],且会导致患者神经功能的损伤[5],使部分患者出现化疗后脑白质病。同样研究显示,全脑放疗治疗非小细胞肺癌脑膜转移并不能有效改善患者的预后[6]。少部分患者因颅内压力过高难以控制可行姑息性的脑室腹腔分流术。近年来非小细胞肺癌的靶向治疗研究结果显示,厄洛替及吉非替尼治疗非小细胞肺癌具有较好的效果[7-8]。药物治疗非小细胞肺癌脑膜转移的一个难点是药物是否可突破血-脑脊液屏障,而已有文献报道厄洛替尼能够通过血-脑脊液屏障,因此该药物可用于治疗非小细胞肺癌的脑转移瘤[9]。最近一些文献也报道,厄洛替尼及吉非替尼在非小细胞肺癌脑膜转移的治疗中能改善患者的预后,延长患者的生存期[10-12]。通过对本研究纳入的17例采用鞘内化疗联合应用厄洛替尼治疗的观察组患者治疗后的脑脊液癌细胞转阴率、症状缓解率及无进展生存期进行分析,结果显示,观察组脑脊液癌细胞转阴率为52.9%,症状缓解率为64.7%,中位无进展生存期为5.3个月,均高于对照组。该结果与Yi等[11]报道的结果相近,提示鞘内化疗联合厄洛替尼对于控制非小细胞肺癌脑膜转移具有较好的疗效。
在本研究中,观察组患者无进展生存期及脑脊液癌细胞转阴率均明显高于Lee等[13]研究中应用吉非替尼治疗非小细胞肺癌脑膜转移患者的无进展生存期,笔者推测厄洛替尼对比吉非替尼治疗非小细胞肺癌脑膜转移效果更好的原因可能为:①与其EGFRTKI常规给药剂量不同有关。目前临床中应用厄洛替尼的标准剂量是150 mg/d,同时该剂量也是该药物的最大可耐受剂量,而目前应用吉非替尼的标准剂量是250 mg/d,是该药物的最大可耐受剂量(750 mg/d)的1/3,导致进入脑脊液中吉非替尼药物浓度无法达到抑制肿瘤生长的最低药物浓度。有文献报道将吉非替尼剂量增加到1000 mg/d能够提高其在脑脊液中的药物浓度,使得脑膜转移的控制率提高,而其毒副作用仍在可控制范围内[14],因此如提高吉非替尼给药剂量则有可能改善其对脑膜转移的治疗效果。②与EGFR基因突变状态有关。目前已经证实EGFR基因突变状态是厄洛替尼疗效的预测指标,但部分EGFR基因野生型患者应用厄洛替尼也可取得较好疗效,临床上认为女性、不吸烟者是厄洛替尼治疗的优势人群。本研究观察组患者均为亚裔人群,存在EGFR基因突变的患者比例可能较高,但由于本研究为回顾性研究,部分患者未接受EGFR基因突变检测,无法获得相应数据进行分析。③与脑脊液中厄洛替尼效较高药物浓度有关。患者发生脑膜转移后,应用鞘内化疗有可能使血脑屏障的通透性发生改变,使厄洛替尼容易通过,容易达到控制脑膜转移的最低药物浓度。如设计前瞻性试验对患者脑脊液进行药物浓度检测,同时对治疗效果进行评价,分析两者关系则能进一步验证厄洛替尼治疗非小细胞肺癌脑膜转移的效果与脑脊液中药物浓度是否有关。
本研究作为一个单中心、非随机的回顾性研究,入选患者例数较少,可能存在选择性偏差,因此结果需经更大样本量的研究进行证实;同时本研究作为一个回顾性研究,部分患者发生脑膜接受治疗后的总生存期无法明确,无法对比治疗组及观察组患者的总生存期,所以需进行更加合理、严谨的前瞻性临床研究从而进一步评估厄洛替尼在治疗非小细胞肺癌脑膜转移中的有效性及安全性。最近有文献报道患者血清乳酸脱氢酶水平也可用于预测厄洛替尼治疗效果[15]。而对于应用厄洛替尼治疗非小细胞肺癌脑膜转移,需要通过更多的研究来寻找预测疗效的指标。
总之,本研究回顾性分析证实,厄洛替尼联合常规鞘内化疗对于治疗非小细胞肺癌脑膜转移具有较好的效果,值得在临床上进行进一步的验证及应用。
[1]陈万青,郑荣寿,张思维,等.2003-2007年中国肺癌发病与死亡分析[J].实用肿瘤学杂志,2012,26(1):6-10.
[2]Hammerer V,Pauli G,Quoix E.Retrospective study of a series of 26 carcinoma atousmeningitis secondary to lung cancer[J].Bull Cancer,2005,92(11):989-994.
[3]De Angelis LM.Diagnosis and treatment of leptomeningeal metastasis[M].Educational Book Am Soc Clini Oncol,2002:369-374.
[4]杜亦陶.肺癌脑膜转移诊治现状[J].中国肿瘤临床与康复,2010,17(4):376.
[5]陶荣杰,徐军,王爽力,等.肺癌脑膜转移的临床诊断及治疗[J].中国神经肿瘤杂志,2007,5(3):183-185.
[6]Morris PG,Reiner AS,Szenberg OR,et al.Leptomeningeal metastasis from non-small cell lung cancer:survival and the impact of whole brain radiotherapy[J].J Thorac Oncol,2012,7(2):382-385.
[7]Shepherd FA,Rodrigues PJ,Ciuleanu T,et al.Erlotinib in previously treated non-small-cell lung cancer[J].N Engl J Med,2005,353(2):123-132.
[8]Lynch TJ,Bell DW,Sordella R,et al.Activating mutations in the epidermal growth factor receptor underlying responsiveness of non-small-cell lung cancer to gefitinib[J].N Engl JMed,2004,350(21):2129-2139.
[9]Lai CS,Bosh off C,Falzon M,et al.Complete response to erlotinib treatment in brain metastases from recurrent NSCLC[J].Thorax,2006,61(1):91.
[10]Park JH,Kim YJ,Lee JO,et al.Clinical outcomes of leptomeningeal metastasis in patients with non-small cell lung cancer in the modern chemotherapy era[J].Lung Cancer,2012,76(3):387-392.
[11]Yi HG,Kim HJ,Kim YJ,et al.Epidermal growth factor receptor (EGFR) tyrosine kinase inhibitors (TKIs) are effective for leptomeningeal metastasis from non-small cell lung cancer patients with sensitive EGFR mutation or other predictive factors of good response for EGFR TKI[J].Lung Cancer,2009,65(1):80-84.
[12]Umemura S,Tsubouchi K,Yoshioka H,et al.Clinical outcome inpatients with leptomeningeal metastasis from non-small cell lung cancer:Okayama Lung Cancer Study Group[J].Lung Cancer,2012,77(1):134-139.
[13]Lee E,Keam B,Kim DW,et al.Erlotinib versus geftinibfor control of leptomeningeal carcinomatosis in non–smallcelllung cancer[J].J Thorac Oncol,2013,8 (8):1069-1074.
[14]Jackman DM,Holmes AJ,Lindeman N,et al.Response and resistance in a non-small-cell lung cancer patient with an epidermal growth factor receptor mutation and leptomeningeal metastases treated with high-dose gefitinib[J].JClin Oncol,2006,24(27):4517-4520.
[15]杨芳,王萌,杨朝阳,等.探讨影响厄洛替尼治疗晚期非小细胞肺癌预后的因素[J].实用肿瘤学杂志,2012,26(1):92-96.
