炭疽杆菌表面四糖抗原全合成的研究进展
2015-05-24许克寒吴俊琪俞世冲吴秋业第二军医大学药学院有机化学教研室上海200433
黄 蕾,许克寒,吴俊琪,姚 阔,俞世冲,吴秋业(第二军医大学药学院有机化学教研室,上海 200433)
·综述·
炭疽杆菌表面四糖抗原全合成的研究进展
黄 蕾,许克寒,吴俊琪,姚 阔,俞世冲,吴秋业(第二军医大学药学院有机化学教研室,上海 200433)
炭疽是由炭疽杆菌引起的人畜共患的传染病。炭疽杆菌属于需氧芽孢杆菌属,为G+菌,其病原体是芽孢。炭疽芽孢最外层含有特定结构的四糖抗原,可用于制备糖缀合物疫苗,诱导免疫反应。综述近10年来文献报道对炭疽四糖化学合成的研究进展,并结合国内外最新研究成果介绍各条制备路线,比较各种方法的主要优缺点。
炭疽四糖;糖基化;化学合成
1 前言
炭疽是由炭疽杆菌引起的人畜共患的传染病。炭疽杆菌为致病菌中最大的G+菌,属于需氧芽孢杆菌属[1]。该菌在宿主体内形成荚膜,荚膜具有很强的致病性和抗吞噬作用。炭疽杆菌在体外可形成芽孢,芽孢具有很强的抵抗力,可在动物尸体及土壤中存活数十年[2]。一旦它进入人体,炭疽芽孢便会迅速繁殖并释放出毒力很强的外毒素和荚膜物质,引起组织水肿、出血和坏死,使人丧失劳动力,直至死亡。该菌具有强大的杀伤力,能够承受恶劣的生长环境,并且易于扩散,炭疽孢子在历史上曾被许多国家和恐怖组织用于制造大规模杀伤性武器。目前治疗炭疽的首选药物是抗生素,然而炭疽毒素对抗生素并不敏感,所以对于中晚期炭疽患者,临床医生几乎束手无策[3]。由此可见,有效的抗炭疽疫苗具有重大的临床价值[4]。
由于糖基化是生命过程中普遍存在的现象,而承载重要生物学功能的糖缀合物的糖链在病理过程中的异常和高表达以及异种生物糖链的特异性,使糖类化合物作为抗原决定簇而引起特异性免疫反应。基于此开发的一系列常用寡糖疫苗[5]能够在感染的早期阶段起到灭活细菌的作用,并在临床实践中被证实是有效和安全的。另外,癌症[6]、疟疾[7]和b型流感病毒[8]等的寡糖疫苗合成工作也已取得了令人鼓舞的进展。
2004年,Turnbough报道了炭疽芽孢表面四糖抗原anthrose(图1)的特异性结构:由3个L-鼠李糖和一个D-单糖组成,且含有一个非还原性末端[9]。炭疽四糖1结构的阐明,为发展炭疽疫苗提供了新的靶标抗原和分子基础。炭疽芽孢最外层上的寡糖抗原具有高度保守性结构和免疫应答的可靠性[9],可与不同的蛋白载体结合,用于开发新型的糖缀合物疫苗[10]。由于细胞表面的寡糖往往难以由分离得到,所以寻找有效的炭疽四糖1及其类似物的化学合成方法尤为重要。本文综述近10年来对炭疽四糖化学合成研究进展的文献报道,并结合国内外最新研究成果,介绍了各条路线的制备机制,比较了各种方法的主要优缺点。

图1 炭疽四糖1、2、3、5的化学结构式

2 合成路线
2.1[2+2]路线 2005年9月,Seeberger[11]报道采用[2+2]的策略首次合成了anthrose类似物炭疽四糖2(图1)。炭疽四糖2的末端含有戊烯基,在开发疫苗过程中可作为连接点缀合载体蛋白。此路线(图2)以L-鼠李糖和D-岩藻糖为原料,分别修饰成单糖中间体11、12、13和14。单糖13和14在三氟甲磺酸三甲基硅酯(TMSOTf)催化下,糖基化后与吡啶反应脱去Fmoc基团得二糖中间体16。单糖11和12在TMSOTf催化下进行β-选择性糖基化后,在MeI/Ag2O催化下甲基化得二糖中间体15。二糖中间体15在TMSOTf催化下与Cl3CCN、NaH反应得二糖中间体17。二糖中间体16和17在TMSOTf催化下糖基化,[2+2]耦合得四糖中间体18。最后,四糖中间体18与液氨中的钠反应脱去所有的永久保护基团,叠氮部分转化成胺,得目标产物。合成路线总体步骤较短,相对快捷,方便获取类似物和短序列;但由于D-岩藻糖价格较贵,并不适合实际生产应用。
2.2以鼠李糖和葡萄糖为原料的[1+3]路线 2005年10月,Kovac[12]课题组,报道采用[1+3]的策略合成了anthrose类似物炭疽四糖苷3(图1)。炭疽四糖苷3的末端侧链,可用于缀合蛋白质或其他合适的载体。此路线(图3)以L-鼠李糖和D-葡萄糖为原料,分别制得单糖受体19、单糖供体20和单糖供体25。前两者在NIS,AgOTf条件下糖基化得二糖中间体21。二糖中间体21脱保护成二糖受体22,再次与单糖供体20糖基化得三糖中间体23。三糖中间体23在甲醇钠条件下脱保护成糖基受体24。单糖供体25与糖基受体24在NIS、Ag-OTf条件下糖基化,经[1+3]耦合成四糖中间体26。最后,四糖中间体经过连续甲基化、氢解脱苄基等步骤即得目标产物。由于炭疽四糖3上存在2-甲氧基,为了保证高度立体选择性,线路中使用了2-O位无邻基参与的糖基供体进行糖基化,但是此反应条件极其不易控制,并且降低了产率。1年后,Adamo小组运用同一思路,进一步合成了糖配体28、29和30(图4)[13]。这些糖配体的鼠李糖末端均含有与炭疽四糖苷3相同的子结构单元,可通过不同方式结合蛋白质形成糖缀合物。
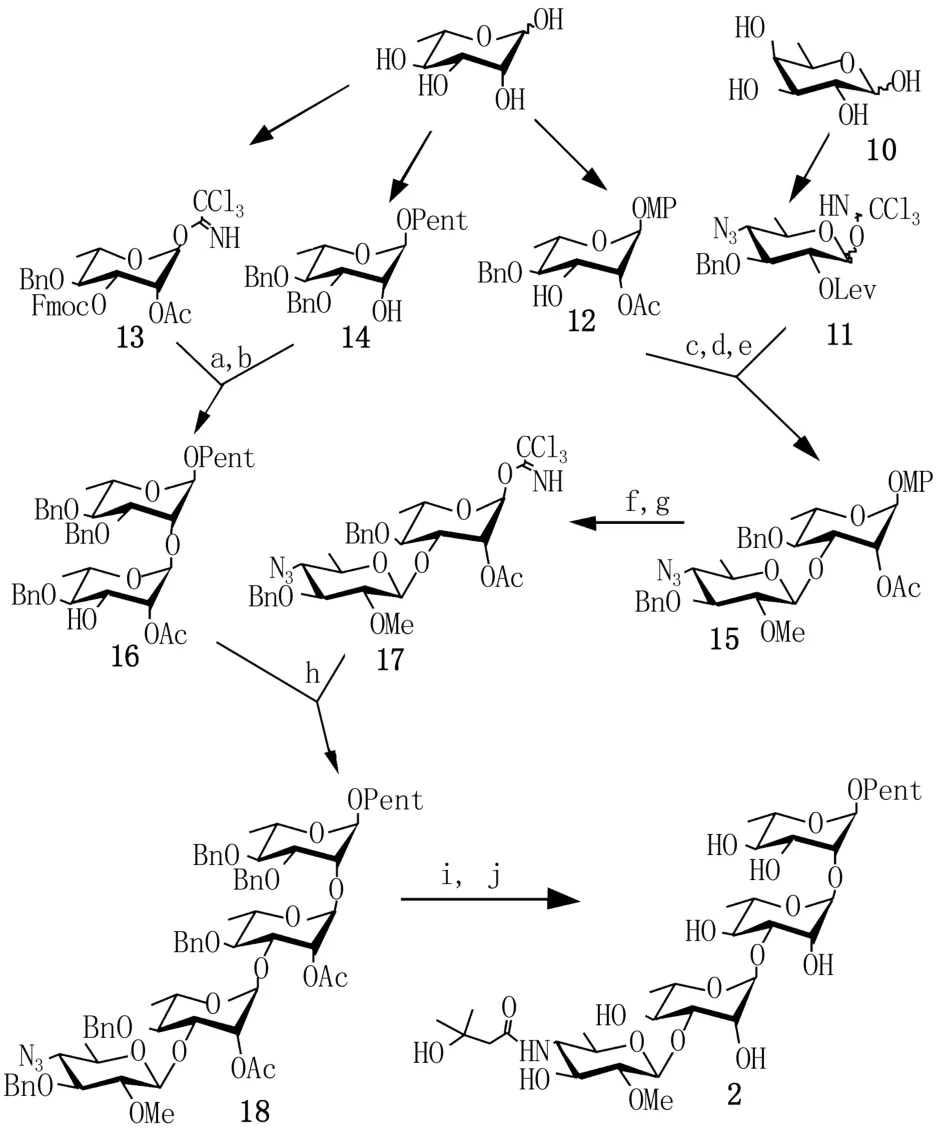
图2 Seeberger的工作
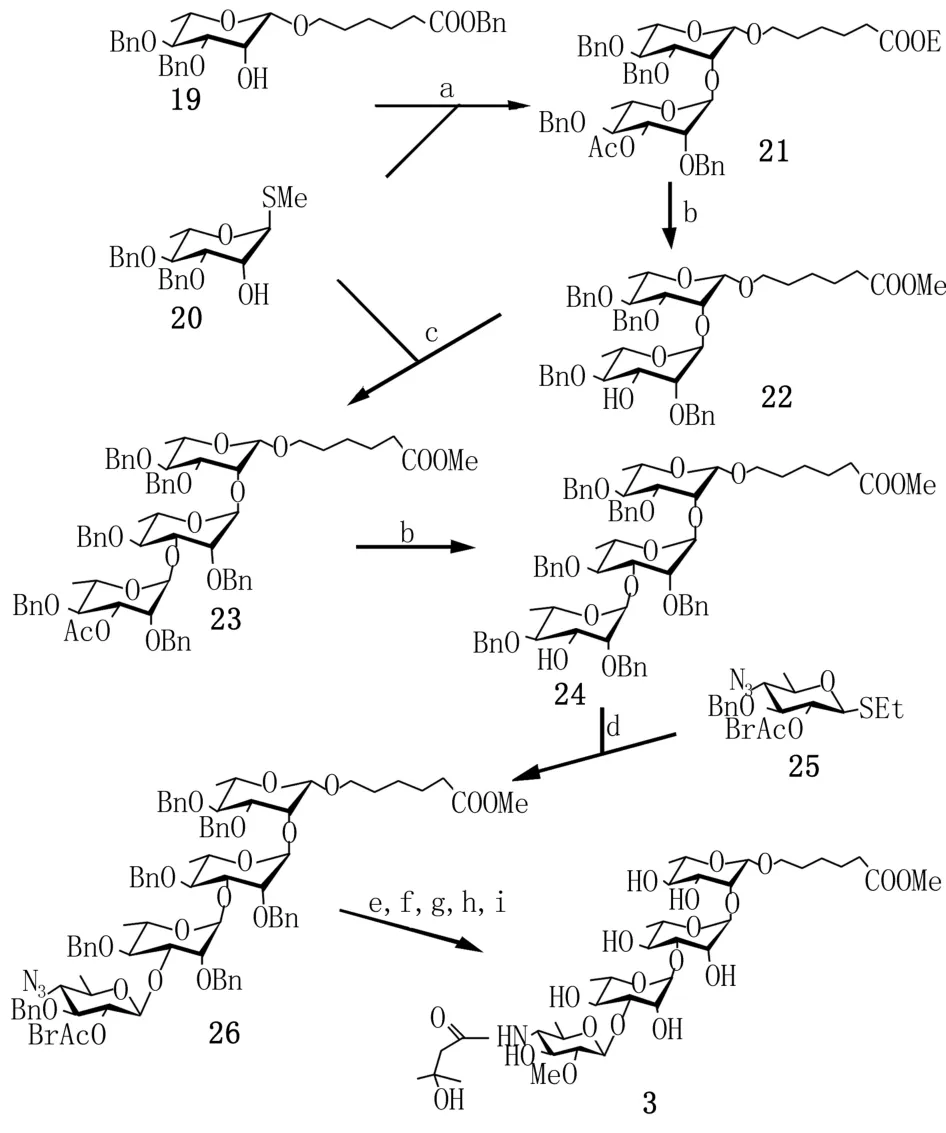
图3 Kova c的工作

图4 Ad amo的工作
2.3 基于非糖原料的[1+3] 路线 2007年,Guo[14]报道使用[1+3]从头不对称合成策略合成炭疽四糖1(图5)。第一步,先用乙酰呋喃合成重要的吡喃酮中间体8,再由吡喃酮中间体31得到D-单糖中间体32、33和鼠李糖受体34。在钯催化条件下,鼠李糖受体34上的C-2位羟基与中间体31糖基化结合成中间体35。中间体35经Luche还原羟化后进行乙酰化保护,得到鼠李二糖受体36。鼠李二糖受体36如上述流程叠加成鼠李三糖中间体37。鼠李三糖中间体37先经还原羟化并酰化保护后得鼠李三糖中间体38。在TMSOTf催化下,鼠李三糖中间体38与单糖中间体32或33结合成四糖中间体39。最后,四糖中间体经甲基化、脱保护等步骤转化为目标产物。总路线共计25步,总产率为13%。尽管不再使用价格较贵的鼠李糖和岩藻糖为原料,创新性地选择了价格便宜的乙酰呋喃以降低成本,但步骤较繁杂,牺牲了效率。随后,Guo延续这一思路进一步合成了末端具有叠氮基团的炭疽四糖类似物5(图1)[15],以便缀合载体蛋白。
2.4 以鼠李糖和半乳糖为原料的[1+3]路线 同为2007年,Crich[16]课题组报道采用[1+3]策略合成了反式糖苷键连接athrose末端部分的炭疽四糖2(图6)。以D-半乳糖和L-鼠李糖为原料分别合成单糖供体44、鼠李糖供体41、鼠李糖受体42和鼠李糖受体40。鼠李糖供体41与鼠李糖受体42在Ph2SO,TTBP,Tf2O,-60℃条件下糖基化结合后加保护成二糖中间体43。取二糖中间体43的β-型体与鼠李糖受体40在相同条件下糖基化后脱保护成鼠李三糖受体45。鼠李三糖受体45与单糖供体44仍采用相同的方式进行糖基化结合,得四糖中间体46。最后选择β-构型四糖中间体46,进行相应的脱保护步骤修饰成目标产物。此路线使用了较少的基团保护操作,增加了合成的效率,同时适当降低了原料成本。
2.5 以鼠李糖和岩藻糖为原料的[1+3]路线 2011年,Wang[17]小组报道采用[1+3]的策略合成炭疽四糖6(图7)。此路线以L-鼠李糖和D-岩藻糖为原料,修饰成单糖受体47、单糖中间体48和单糖供体49。将单糖中间体47置于[Ir(COD)(PMePh2)2]PF6条件下异构化成相应的1-丙烯基的糖基供体,与单糖受体2NIS/TfOH条件下糖基化后经碱处理得二糖中间体50。二糖中间体50使用相同方式依次将单糖受体47和单糖受体49糖基化结合组成四糖中间体52。最后,四糖中间体经后续脱保护等修饰工作得目标产物。路线中所用的两阶段活化烯丙基糖基供体的糖基化方法避免了耗时的末端基团保护和纯化步骤,缩短了反应路线。对于寡糖的合成,不需要任何保护和脱保护属性调整,显著简化了中间体的制备,并全面提高了合成效率。但原料中的D-岩藻糖价格较贵,且使用了价格比较昂贵的促进剂,成本较高,不适合实际投产。
2012年,Grandjean[18]课题组报道采用[1+3]策略合成了炭疽四糖类似物8(图8)。此路线以L-鼠李糖和D-岩藻糖为原料,得到单糖中间体53、单糖受体54、单糖供体55和单糖供体59。单糖受体53与单糖中间体54在NIS,AgOTf催化下糖基化结合后选择性脱保护得二糖受体56。二糖受体56与单糖供体55经Schmidt′s糖基化得三糖57。三糖57近一步脱保护修饰成三糖受体58。三糖受体58与单糖供体59在TMSOTf条件下糖基化耦合得四糖60。最后,四糖60经常规甲基化、氢解脱苄基保护等步骤得目标产物。随后,Grandjean延续此思路进一步合成了炭疽四糖的环状硫酸酯中间体——去甲基化的二糖衍生物9(图9)。相关免疫学活性研究表明,双糖结合到牛血清白蛋白(BSA)能够诱导抗原四糖的IgG抗体反应,可以在一个糖结合物的抗原制剂中使用[19]。

图5 Gu o的工作
3 结论与展望
综上所述,炭疽四糖的化学合成已取得了显著进展,同时也存在诸多不足。这些路线多是使用传统糖类(碳水化合物)作为前体来绘制其立体化学构型,如昂贵的D-岩藻糖、D-半乳糖,或不常见的L-鼠李糖。从头不对称合成所使用的原料乙酰呋喃,虽然价格低廉,但其合成步骤复杂,效率低。为了节约步骤,在鼠李寡糖糖基化反应中,Kovac、Crich和Wang小组都选择了无邻基参与的α-连接。然而由于没有相邻的基团参与,立体选择性几乎完全依赖于糖基化条件的确定,目前只有Kovac小组能够较好地控制反应条件。

图7 Wa n g的工作
图8 Gr and j ean的工作
图9 二糖衍生物9
炭疽杆菌的检测及新型糖缀合物炭疽疫苗的研发迫切需要炭疽四糖载体蛋白偶联物的大量合成。与蛋白合成相比,糖类合成的难点在于有更多的功能基团需要保护与去保护,且为了区分这些相似的官能团,保护和去保护的方法必须具有很好的选择性和专一性;更重要的是,糖苷键的形成还应具有较好的立体选择性,并且在后续合成中要保持其构型不变,这些因素都是限制多糖合成的主要原因。经过科学家们不懈的努力,化学合成寡糖的能力和速度已有较大提高,尤其是一些新型保护基、新技术及新策略的出现和应用为复杂寡糖的合成开拓了广阔前景。实现炭疽四糖的大规模合成指日可待。由于炭疽四糖及其衍生物结构的极大差异性和复杂性,各种合成过程中的分离方法还难以达到令人满意的效果。因此,不断完善有效的炭疽四糖及其衍生物的合成方法仍是当前的迫切需求。
[1] Mock M,Fouet A.Anthrax[J].Annu Rev M icrobiol,2001,55:647-671.
[2] Nicholson W L,M unakata N,Horneck G,et al.Resistance of Bacillus endospores to ex treme terrestrial and ex traterrestrial environments[J].MMBR,2000,64(3):548-572.
[3] Bouzianas DG.Current and future medical app roaches to combat the anthrax threat[J].J Med Chem,2010,53(11):4305-4331.
[4] Turnbull PC.Current status of immunization against anthrax:old vaccines may be here to stay for a w hile[J].Curr Opin Infect Dis,2000,13(2):113-120.
[5] Roy R.New trends in carbohydrate-based vaccines[J].D rug Discov Today:Techn,2004,1(3):327-336.
[6] Hecht M L,Stallforth P,Silva DV,etal.Recent advances in carbohyd rate-based vaccines[J].Curr Opin Chem Biol,2009,13(3):354-359.
[7] Schofield L,Hew itt MC,Evans K,etal.Synthetic GPIas a candidate anti-toxic vaccine in amodel ofmalaria[J].Nature,2002,418(6899):785-789.
[8] Verez-Bencomo V,Fernandez-Santana V,Hardy E,et al.A synthetic conjugate polysaccharide vaccine against Haemophilus influenzae type b[J].Science,2004,305(5683):522-525.
[9] Daubenspeck JM,Zeng H,Chen P,et al.Novel oligosaccharide side chains of the collagen-like region of BclA,themajor glycop rotein of the Bacillus anthracis exosporium[J].J Biolog Chem,2004,279(30):30945-30953.
[10] Wong CH.Carbohyd rate-based drug discovery[M].New York:W iley-VCH Verlag GmbH,2003:45-50.
[11] Werz DB,Seeberger PH.Total synthesis of antigen Bacillus anthracis tetrasaccharide-creation of an anthrax vaccine candidate[J].Angew Chem Int Edit,2005,44(39):6315-6318.
[12] Adamo R,Saksena R,Kovac P.Synthesis of the beta anomer of the spacer-equipped tetrasaccharide side chain of the major glycoprotein of the Bacillus anthracis exosporium[J].Carbohyd r Res,2005,340(17):2579-2582.
[13] Adamo R,Saksena R,Kovac P.Studies tow ards a conjugate vaccine for anthrax:synthesis of the tetrasaccharide side chain of the Bacillus anthracis exosporium[J].Helv Chim Acta,2006,89(6):1075-1089.
[14] Guo H,O′Doherty GA.Denovo asymmetric synthesis of the anthrax tetrasaccharide by a palladium-catalyzed glycosylation reaction[J].Angew Chem Int Edit,2007,46(27):5206-5208.
[15] Guo H,O′Doherty GA.De novo asymmetric synthesis of anthrax tetrasaccharide and related tetrasaccharide[J].JOrgan Chem,2008,73(14):5211-5220.
[16] Crich D,Vinogradova O.Synthesis of the antigenic tetrasaccharide side chain from themajor glycoprotein of Bacillus anthracis exosporium[J].JOrgan Chem,2007,72(17):6513-6520.
[17] Wang Y,Liang X,Wang PF.Concise synthesis of Bacillus anthracis exosporium tetrasaccharide via two-stage activation of allyl glycosyl donor strategy[J].Tetrahedr Lett,2011,52(30):3912-3915.
[18] M ilhomme O,Dhénin SG,Djedaini-Pilard F,etal.Synthetic studies toward the anthrax tetrasaccharide:alternative synthesis of this antigen[J].Carbohydr Res,2012,356:115-131.
[19] M ilhomme O,Kohler SM,Ropartz D,et al.Synthesis and immunochem ical evaluation of a non-methylated disaccharide analogue of the anthrax tetrasaccharide[J].Organ Biomolecul Chem,2012,10(42):8524-8532.
Research progress in the synthesis of antigen Bacillusanthracis tetrasaccharide
HUANG Lei,XU Kehan,WU Junqi,YAO Kuo,YU Shichong,WU Qiuye(Depar tment of Organic Chemist ry,School of Pharmacy,Second M ilitary Me dical Un iversity,S hanghai 200433,China)
ObjectiveAnthrax is an anthropozoonosis caused by the bacterium Bacillusanthracis.Bacillusanthracis is an aerobic,spore-forming,rod-shaped bacterium,which infects human through ingestion or inhalation of the spores.Theexosporium of spores of Bacillusanthracis contains tetrasaccharide antigen w ith specific chemical structure,which can be used in preparation of glycoconjugates vaccines,inducing an immune response.This paper reviewed articles in the last decade that reported research advances in chemical synthesis of anthrax tetrasaccharide,presented themethods for synthesis,and compared the advantages and lim itations among differentmethods.
anthrax tetrasaccharide;glycosylation;chemosynthesis
O621.3;R378.72
A
1006-0111(2015)06-0481-06
10.3969/j.issn.1006-0111.2015.06.001
2014-04-03
] 2014-07-11[本文编辑]李睿旻
国家科技重大专项(No.2012ZX09502001-005,2011ZXJ09201-012),国家自然科学基金青年项目(No.21202200),第二军医大学药学院大学生科研训练计划项目
黄 蕾,硕士研究生.Tel:13062669850;E-mail:huanglei0026@163.com
吴秋业,教授.研究方向:抗真菌、抗肿瘤药物、寡糖及其他天然产物的全合成研究.Tel:(021)81871225;E-mail:qyw u2008@163.com
