可口革囊星虫Phasolosma esculenta体腔液的抗菌活性研究
2015-05-22梁倩蓉于曙光刘顺王国良郑晓叶彭雪美惠周素明
梁倩蓉,于曙光,刘顺,王国良,郑晓叶,彭雪美惠,周素明
(宁波大学 教育部应用海洋生物技术重点实验室,浙江 宁波315211)
0 引言
可口革囊星虫Phasolosma esculenta俗称海丁、土笋等,隶属星虫动物门Sipuncula、革囊星虫纲Phascolosomatidea、革 囊 星 虫 目 Phascolosomaliformes、革囊星虫科Phascolosomatidae、革囊星虫属Phascolosoma,广泛分布于我国东南沿海广西、广东、海南岛、福建和浙江等地,为我国特有种,常供食用[1],是我国红树林区大型底栖经济动物之一,栖息于潮间带营底埋生活,体柔软蠕虫状、长圆筒形,以底栖硅藻和有机碎屑为食[2]。
近些年对可口革囊星虫的研究主要集中在组织胚胎学、体内营养成分分析、重金属毒理学以及养殖增殖等方面[2-6],现代医学生物学研究发现可口革囊星虫营养物质丰富,其虫体富含多种人体所需氨基酸,并含有丰富的钙、磷、铁等微量元素,牛磺酸以及多种不饱和脂肪酸等。另外,可口革囊星虫虫体还存在多种具有抗疲劳、调节免疫以及溶栓作用等[7-8]的生物活性成分。
在抗生素长期使用甚至滥用带来一系列负面影响的背景下,抗菌肽、抗菌蛋白等一系列生物来源的新型抗菌物质逐渐成为医学生物学研究热点,近年来这类抗菌物质的相关研究频见报道,诸如一些甲壳类、软体动物、鱼类、爬行动物、哺乳动物等生物甚至人类体内的多种抗菌活性物质的发现和分离纯化[9]。而无脊椎动物分布广泛、数量庞大,且具非特异性免疫防御机制及相关活性物质,体内物质组成相对脊椎动物简单,是为筛选抗菌活性物质之良选。可口革囊星虫作为一种重要的海洋经济无脊椎动物,其体壁是主要的食用成分,而体腔液部分在食用过程中基本被丢弃。本研究针对可口革囊星虫体腔液的抗菌活性进行研究,一方面出于对我国特有星虫种充分利用的考虑;另一方面,也希望通过研究获得新的抗菌活性物质。
1 材料与方法
1.1 细菌培养
试验菌种为宁波大学应用海洋生物技术水产动物病害重点实验室保存的菌种,详见表1。

表1 试验菌株Tab.1 Experimental bacteria strains
培养方式:使用NB或BHI液体培养基以温度30℃或37℃,转速210r/min振荡培养试验菌种24 h;固体培养基采用脑心浸出液琼脂(Brain Heart Infusion Agar,BHIA)、营养琼脂(Nutrient Agar,NA)或马铃薯葡萄糖琼脂(Potato Dextrose Agar,PDA)培养基。
1.2 可口革囊星虫体腔液提取物的制备
试验用健康可口革囊星虫40余条取自温岭坞根镇养殖户,暂养于普通海水中,待其吐尽体内浊物后解剖,得到体腔原液。原液处理:(1)仅采取体腔原液5 000r/min离心10min提取的上清液记为T1;(2)超声波破碎裂解再经离心得到的上清液记为T2;(3)用2%乙酸提取的体腔提取液记为T3。上述提取液都可保存在-20℃冰箱待用。
1.3 可口革囊星虫体腔液提取物的抗菌作用
采用琼脂径向扩散来确定上述体腔液提取物对不同细菌或真菌的抗菌效果。琼脂径向扩散的具体方法:将40mL的BHI、NA或PDA固体琼脂熔化后冷却至40℃以下,注入过夜培养菌液1mL,倾倒至平皿中,凝固后用打孔器在含细菌固体培养基上打孔,每孔滴加25μL体腔液提取物。培养基在30℃或37℃继续培养24h后观察结果(下述琼脂扩散方法类似)。
1.4 可口革囊星虫体腔液提取物抗菌动力学
将金黄色葡萄球菌(根据上步实验确定的典型敏感菌株)培养24h后用PBS缓冲液洗菌2~3次,重旋后将细菌稀释至104CFU/mL与T2提取液等体积混匀,分别在孵育0、15、30、45、60、75和90min取100μL进行10倍梯度稀释后涂板计数,该实验同时进行3次平行实验。细菌于37℃恒温培养24h后进行菌落计数,统计结果使用SPSS 20.0和Excel进行分析处理,下同。
1.5 可口革囊星虫体腔液抗菌物质初步分离
利用商品化超滤离心管(截留分子量分别为3、10、30、50和100kDa)对T2提取液(本实验抗菌效果最佳组分)进行超滤,初步得到2个组分:T2’(滤过液)和T2’’(截留液),利用琼脂径向扩散方法测定抑菌圈直径大小,比较分析上述2个组分的抗菌效果。
1.6 可口革囊星虫体腔液抗菌物质的抗菌理化特性
温度对T2提取液抗菌活性的影响:将星虫体腔提取物T2液在40、50、60、70和80℃水浴中孵育10min,采用琼脂径向扩散方法测试抗菌活性随高温温度的变化。将T2液在5、10、15、20、25和30℃培养箱中与细菌PBS重旋液(稀释至104CFU/mL)等体积混匀后孵育0.5h,进行稀释涂板计数(含室温孵育的对照),比较研究较低温对T2提取液抗菌活力的影响。实验组包含3个平行。
T2提取液抗菌活性对金属离子的依赖性:EDTA是一种常见的可和多种金属离子结合形成稳定螯合物的金属螯合剂。本实验利用EDTA作为可口革囊星虫体腔提取物中金属离子的螯合剂,以研究该抗菌活性物质对金属离子的依赖性。将1.0~9.0mmol/L EDTA(aq)分别和T2液孵育0.5h后,以等量0.9%生理盐水配成的EDTA作为阴性对照,未处理的T2原液为阳性对照,进行琼脂径向扩散,重复多次。
反复冻融对T2提取液抗菌活性的影响:反复室温解冻,-20℃保存样品5、6、7、8、9和10次,以0℃解冻样品作为对照进行琼脂径向扩散比较分析抗菌效果,重复多次。
2 结果与分析
2.1 可口革囊星虫体腔液提取物的抗菌效果比较
通过对抑菌圈直径的测量结果显示,3种体腔液提取物T1(离心上清液),T2(超声离心破碎上清液)和T3(2%乙酸提取液)表现出不同的抗菌活性,T1和T3的抗菌作用明显弱于T2,甚至无抗菌活性,而T2的抗菌作用很明显;且结果还显示该抗菌物质对不同菌株的抗菌效果也有明显差异,其对试验的3种革兰氏阳性细菌具有显著的抗菌效果,而对试验的3种革兰氏阴性细菌及真菌无明显抗菌效果(表2)。
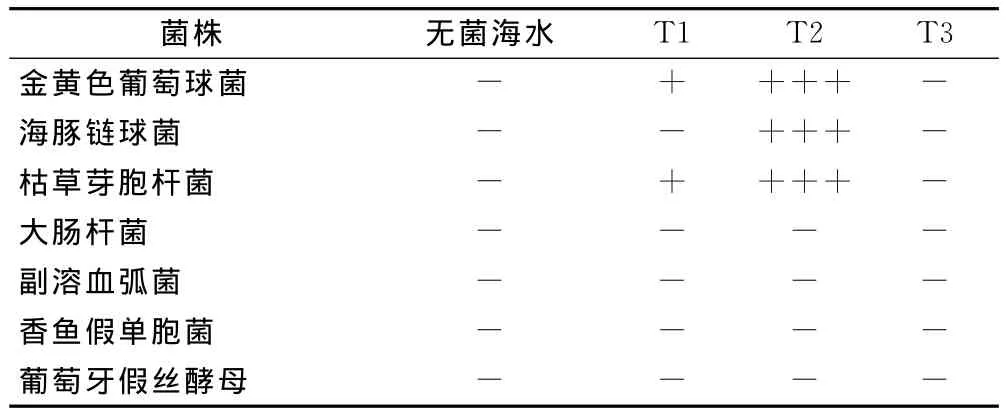
表2 可口革囊星虫体腔液不同提取方式的抗菌效果Tab.2 Antibacterial effects of different extractions from coelomic fluid of Phasolosma esculenta
2.2 可口革囊星虫体腔液抗菌物质对金黄色葡萄球菌的抗菌动力学
为了进一步揭示该抗菌活性物质抗菌效力随时间推移的变化趋势,将金黄色葡萄球菌PBS重旋后用PBS缓冲液稀释至104CFU/mL与T2提取液等体积混匀,分别在孵育0、15、30、45、60、75和90min取100μL进行10倍梯度稀释后涂板计数。计数结果如图1所示。图1结果显示随着孵育时间的增加,活菌量不断下降,经过15min孵育,活菌量明显下降一半左右(p<0.01),15min后活菌量减少也很明显(p<0.01),孵育90min时活细菌基本很少。
2.3 抗菌物质分子量估计和初步分离
利用商品化3~100kDa截留孔径的超滤管对可口革囊星虫T2提取液(T2’为超滤管滤过液,T2’’为上层截留液)进行分离和截留(T2’和T2’’等体积)。通过对抑菌圈直径的测量结果显示(表3),3~30kDa超滤管分离所得下层物质基本无抗菌活性,而50kDa超滤管分离,下层物质开始表现出抗菌活性作用,100 kDa分离所得下层物质的抑菌圈明显比50kDa分离所得的大(p<0.01),但两者的抑菌圈分别与对应T2原液和上层物质的相比较小(p<0.01)。结果表明该抗菌物质的分子量大于100kDa。

图1 可口革囊星虫体腔液抗菌物质对金黄色葡萄球菌的抗菌动力学Fig.1 Antibacterial kinetics of antibacterial components extracted from coelomic fluid of Phasolosma esculentaagainst Staphylococcus aureus

表3 不同孔径超滤管分离抗菌物质的抑菌圈比较Tab.3 Comparison of bacteriostatic rings of the antibacterial component separated by different diameter ultrafiltration tube
2.4 可口革囊星虫体腔液抗菌物质理化特性研究结果
2.4.1 温度对体腔液提取物抗菌活性的影响
琼脂径向扩散试验中,温度在40~50℃仍有抑菌圈,其中40℃抑菌圈和室温(28℃左右)孵育抑菌圈大小基本相近,60℃抑菌圈已不明显,而60℃以上基本无抑菌圈,表明该抗菌活性物质不耐高温,具有热不稳定性。而对其在5~30℃条件下涂板计数以确定最佳抗菌活力温度结果如图2所示,其中25℃时的抗菌率明显高于其它温度(p<0.05),由此可估计该种抗菌活性物质发挥作用的最适温度约为25℃。
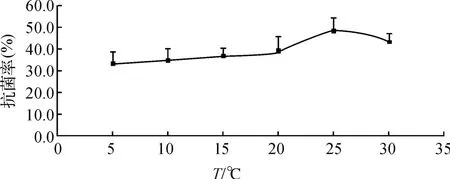
图2 5~30℃温度对抗菌物质活力的影响Fig.2 Temperature influence on the antibacterial activity within experiment temperature ranging from 5to 30℃
2.4.2 体腔液提取物抗菌活性对金属离子的依赖性
在含1.0~9.0mmol/L EDTA(aq)的 T2液孵育琼脂径向扩散实验中,阴性对照(仅含等浓度的EDTA生理盐水)无明显抑菌圈,而含EDTA的T2液的琼脂附近出现了明显的抑菌圈,表明主要起到抗菌作用的仍是T2液。通过对抑菌圈直径的测量结果显示,不同EDTA浓度梯度间抑菌圈大小基本无差异,重复实验,结果相同。由此可认为金属离子在该抗菌物质发挥活性作用中不起关键作用。
2.4.3 反复冻融对体腔液提取物抗菌活性的影响
反复冻融5~10次后进行抗菌实验,并测量抑菌圈直径,发现各抑菌圈差异不大(图3)。结果表明该抗菌物质不易受反复冻融的影响。

图3 反复冻融对抗菌活性的影响Fig.3 Effects of repeated freezing and thawing on the antibacterial activity
3 讨论与结论
无脊椎动物由于缺乏获得性免疫仅依靠非特异性免疫系统来抵御外界细菌等有害生物和物质入侵,因此其免疫系统及防御机制成为目前研究的热点之一。许多无脊椎动物例如家蝇[10]、环节动物[11],一些贝类[12]、虾蟹类[13-14]、海胆[15]等体内具有多种抗菌活性物质。已有学者在这些生物体内分离得到了一些抗菌肽以及活性免疫蛋白。目前研究已得到海洋无脊椎动物抗菌肽主要来源于刺胞类、环节类、软体类、甲壳类和棘皮类,且其中大多数抗菌肽种类区别于陆生动物,有防御素、水母素、贻贝素等富含半胱氨酸的阳离子抗菌肽、沙蚕素、硬皮素和对虾抗菌素家族、鲎肽素、海胆素等[16],都具有广谱抗性。活性免疫蛋白有凝集素、几丁质、壳聚糖等。其中,蚯蚓体腔液中含有一种分子量约为38kDa,具有破坏非自身细胞膜结构能力的膜穿孔蛋白[17];软体动物毛蚶的抗菌蛋白组分具有很好的热稳定性,对胰蛋白酶和蛋白酶K不敏感,对革兰氏阳性菌和部分真菌表现出抗菌作用,对革兰氏阴性细菌则无[18];BULGAKOV et al[19]从Ruditapes philippinarum体内分离得到一种分子量为138kDa,对Ca2+依赖,具有热不稳定性的C型凝集素 MCL,而 TAKAHASHI et al[20]则从其中分离得到了一种扮演着促进血细胞吞噬作用、分子量为147kDa的新型凝集素MCL-4,说明Ruditapes philippinarum中富含多种不同的免疫活性蛋白;Scylla serrata精浆中存在一种分子量为10.8kDa,不同于在该物种中已分离得到抗菌肽的抗菌蛋白Scygonadin[21]。
可口革囊星虫是一种低等海洋无脊椎动物,久居滩涂。由于生活环境复杂恶劣,其体内必然具有一套独特的防御机制以抵御致病菌侵染,故而我们推测其体内很可能具有抗菌活性物质。通过本研究可发现可口革囊星虫体腔液中存在着一种抗菌效果显著的活性物质,该结果证实了之前的推测,而这一类似研究内容在国内尚未有过相关报道;在国外虽曾有学者对星虫动物门的其它物种进行过相关研究,但是进一步深入的研究却比较少[22-23]。
经理化特性等研究结果分析和比较表明,可口革囊星虫体腔液中存在一种具有不耐高温、不依赖金属离子发挥作用、抗冻融性强等特性,分子量大于100kDa的抗菌活性物质,且该物质对金黄色葡萄球菌抗菌作用高效、持久(作用90min后细菌量明显降低),在5~30℃范围内最适活性发挥作用温度约为25℃。几种提取方式(离心上清液、超声离心上清液和2%乙酸提取液)的对比发现,超声离心上清液的抗菌作用明显强于仅经离心得到的上清液,不排除因部分体腔细胞破碎而造成细胞内抗菌物质的外流而使得仅离心所得上清液也存在抗菌作用的情况,可以由此推测可口革囊星虫抗菌活性物质主要存在于体腔细胞内。而经2%乙酸抽提的体腔液则基本无抗菌效果,表明此抗菌活性物质非碱性物质。据以上许多特性与常见广谱的、耐高温、碱性、对金属离子有依赖性的小分子抗菌肽的性质[24]不同,可初步判断该抗菌活性物质不是一种抗菌肽而很可能是一种大分子的抗菌蛋白。
对可口革囊星虫体腔液抗菌活性研究表明,该抗菌物质对3种典型革兰氏阳性细菌(金黄色葡萄球菌,海豚链球菌和枯草芽胞杆菌)表现出强抗菌活性,而对试验的3种典型革兰氏阴性细菌(大肠杆菌,副溶血弧菌,香鱼假单胞菌)和真菌(葡萄牙假丝酵母)则基本无抗菌活性。据此结果猜想可口革囊星虫体内抗菌物质可能为一种针对革兰氏阳性细菌菌体体表某一类特异性位点起作用,从而抑制细菌生长或者杀死细菌的物质,而不同菌体细胞壁组成的差异可能是该抗菌物质主要针对革兰氏阳性细菌起抗菌作用而对革兰氏阴性细菌和真菌无抗菌活性的原因所在。
本研究发现在可口革囊星虫体腔液中存在对革兰氏阳性细菌具有较强抗菌活性的蛋白,并对该蛋白部分理化特性有了一定的了解,这为今后对该抗菌活性蛋白的纯化、质谱鉴定以及星虫等海洋蠕虫类动物的防御机制深入研究奠定了坚实的基础。
(References):
[1]LI Feng-lu.A checklist of Sipuncula from the China coasts[J].Journal of Ocean University of Qingdao,1989,19(3):78-90.
李凤鲁.中国沿海革囊星虫属(星虫动物门)的研究[J].青岛海洋大学学报,1989,19(3):78-90.
[2]JIN Chun-hua,ZHU Jun-quan,XU Shi-jian,et al.Study on the embryonic and larval development of Phascolosoma esculenta[J].Oceanologia et Limnologia Sinica,2011,42(1):94-100.
金春华,竺俊全,许式见,等.可口革囊星虫(Phascolosoma esculenta)胚胎及幼虫发育研究[J].海洋与湖沼,2011,42(1):94-100.
[3]DENG Zhong-ri,HUANG Bo,FANG Zai-guang.Morphological and histological characteristics of body wall in Phscolosoma esculenta[J].Fisheries Science,2007,26(6):335-339.
邓中日,黄勃,方再光.可口革囊星虫体壁形态和组织学结构[J].水产科学,2007,26(6):335-339.
[4]ZHOU Ying-song,DING Li-fa,XU Ji-lin,et al.Analysis of main nutritional components in Phascolosoma esulenta[J].Acta Nutrimenta Sinica,2007,29(4):413-414.
周迎松,丁理发,徐继林,等.可口革囊星虫主要营养要素的分析[J].营养学报,2007,29(4):413-414.
[5]ZENG Hai-xiang,ZHU Jun-quan,DING Li-fa.The heavy metal Cadmium and Zinc toxicity test on Phascolosoma esculenta[J].Reservoir Fisheries,2006,26(2):96-98.
曾海祥,竺俊全,丁理法.重金属镉和锌对可口革囊星虫的毒性试验[J].水利渔业,2006,26(2):96-98.
[6]DING Li-fa,ZHU Jun-quan,YE Rong-hua,et al.Great artificial breeding of Phascolosoma esculenta[J].Scientific Fish Farming,2006,2004(5):31-32.
丁理法,竺俊全,叶荣华,等.可口革囊星虫人工养殖获高效[J].科学养鱼,2004(5):31-32.
[7]NIU Rong-li,TANG Jian-hong.Research of anti-fatigue effect of Phascolosoma esculenta[J].Science and Technology of Food Industry,2012,33(24):389-391.
牛荣丽,唐健红.可口革囊星虫抗疲劳作用的研究[J].食品工业科技,2012,33(24):389-391.
[8]TANG Jing-cai,LIAO Gong-shan,LEI Dan-qing,et al.Study on fibrinolytic enzyme fromPhascolosoma esculenta[J].Journal of SNAKE(Science & NAture are KEy to health),2010,22(4):339-341.
唐景财,廖共山,雷丹青,等.可口革囊星虫体内纤溶酶的初步研究[J].蛇志,2010,22(4):339-341.
[9]LIU Chen,LI Man-xiang,LU Shuai,et al.Progress on antibacterial peptide[J].Progress in Veterinary Medicine,2011,32(3):94-99.
刘诚,黎满香,卢帅,等.抗菌肽研究进展[J].动物医学进展,2011,32(3):94-99.
[10]ZHAO Fei.Advances of antimicrobial active substance from Musca domestica(Houseflies)[J].Journal of Shanxi Agricultural Sciences,2007,35(9):23-26.
赵飞.家蝇抗菌活性物质研究进展[J].山西农业科学,2007,35(9):23-26.
[11]LIU Yan-qin,WANG Dong-hui,SUN Zhen-jun.In vitro antibacterial effect of earthworm coelomic fluid and crude extracts[J].Ecology of Domestic Animal,2004,25(4):51-54.
刘艳琴,王东辉,孙振钧.蚯蚓体腔液及粗组分体外抗菌特性[J].家畜生态,2004,25(4):51-54.
[12]DING Yun-chao,ZHANG Shi-cui.Progress on marine animal antimicrobial peptide[J].Chinese Journal of Marine Drugs,2013,32(6):87-96.
丁云超,张士璀.海洋动物抗菌肽研究进展[J].中国海洋药物,2013,32(6):87-96.
[13]HAUG T,KJUUL A K,STENSVARG K,et al.Antibacterial activity in four marine crustacean decapods[J].Fish &Shellfish Immunology,2002,12(5):371-385.
[14]CHISHOLMT J R S,SMITH V J.Comparison of antibacterial activity in the hemocytes of different crustacean species[J].Comparative Biochemistry and Physiology Part A:Physiology,1995,110(1):39-45.
[15]LI C,HAUG T,STYRVOLD O B,et al.Strongylocins,novel antimicrobial peptides from the green sea urchin,Strongylocentrotus droebachiensis[J].Developmental and Comparative Immunology,2008,32(12):1 430-1 440.
[16]CASAS S M,COMESANA P,CAO A,et al.Comparison of antibacterial activity in the hemolymph of marine bivalves from Galicia(NW Spain)[J].Journal of Invertebrate Pathology,2011,106(2):343-345.
[17]LANGE S,KAUSCHKE E,MOHRIG W,et al.Biochemical characteristics of Eiseniapore,apore-forming protein in the coelomic fluid of earthworms[J].European Journal of Biochemistry,1999,262(2):547-556.
[18]GUO Dao-sen,WEI Yu-xi,LI Li,et al.Purification of antimi
crobial protein from plasma of the mussel Scapharca subcrenata and its antimicrobial activity[J].Marine Sciences,2005,29(3):25-29.
郭道森,魏玉西,李丽,等.毛蚶血浆中抗菌蛋白的纯化及抗菌活性研究[J].海洋科学,2005,29(3):25-29.
[19]BULGAKOV A A,PARK K I,CHOI K S,et al.Purication and characterisation of a lectin isolated from the Manila clamRuditapes philippinarumin Korea[J].Fish &Shellfish Immunology,2004,16(4):487-499.
[10]TAKAHASHI K G,KURODA T,MUROGA K.Purification and antibacterial characterization of a novel isoform of the Manila clam lectin(MCL-4)from the plasma of the Manila clam,Ruditapes philippinarum[J].Comparative Biochemistry and Physiology,Part B,2008,150(1):45-52.
[21]HUANG Wen-shu,WANG Ke-jian,YANG Ming,et al.Purifi
cation and part characterization of a novel antibacterial protein Scygonadin,isolated from the seminal plasma of mud crab,Scylla serrata (Forskål,1775)[J].Journal of Experimental Marine Biology and Ecology,2006,339(1):37-42.
[22]JOHNSON P T,CHAPMAN F A.Comparative studies on the in Vitro response of bacteria to invertebrate body fluids.I.Dendrostomum zostericolum,a sipunculid worm[J].Journal of Invertebrate Pathology,1970,16(1):127-138.
[23]KRASSNER S M,FLORY B.Antibacterial factors in the sipunculid worms Golfingia gouldii and Dendrostomum pyroides[J].Journal of Invertebrate Pathology,1970,16(3):331-338.
[24]SONG Hong-xia,ZENG Ming-yong,LIU Zun-ying,et al.Biological activity and its mechanism of action of antimicrobial peptides[J].Science and Technology of Food Industry,2006,27(9):185-188.
宋宏霞,曾明勇,刘尊英,等.抗菌肽的生物活性及其作用机理[J].食品工业科技,2006,27(9):185-188.
