不同分期肺腺癌患者大脑静息葡萄糖代谢改变研究
2015-05-20孙萌萌付畅史大鹏徐俊玲轩昂张杰
孙萌萌 付畅 史大鹏 徐俊玲 轩昂 张杰
·论著·
不同分期肺腺癌患者大脑静息葡萄糖代谢改变研究
孙萌萌 付畅 史大鹏 徐俊玲 轩昂 张杰
目的 探讨无脑部转移的不同分期肺腺癌患者大脑静息葡萄糖代谢改变特点及其关系。方法 回顾性分析120例组织学确诊为原发性肺腺癌患者的全身18F-FDGPET/CT检查资料,其中Ⅰ期患者为28例、Ⅱ期29例、Ⅲ期31例和Ⅳ期32例。50名健康体检者为对照组,分析Ⅰ、Ⅱ、Ⅲ、Ⅳ期肺腺癌患者脑葡萄糖代谢改变,并比较4组之间脑代谢改变的差异。结果 Ⅰ、Ⅱ、Ⅲ、Ⅳ期肺腺癌患者PET脑显像均表现区域性脑代谢减低,Ⅰ期累及脑区为左侧额上中回、右侧颞上中回、左侧颞中下回(体素数为681),Ⅱ期累及脑区为左侧额上中回、右侧颞上中回、左侧颞中下回(体素数为1258),Ⅲ期累及脑区为左侧额上中回、右侧颞上中回、左侧颞中下回、右侧顶下小叶(体素数为1810),Ⅳ期累及脑区为左侧额上中回、右侧颞上中下回、左侧颞上中下回、右侧顶下小叶、左侧前扣带回及右侧岛回(体素数为2910)。4组患者脑代谢减低区体素值差异具有统计学意义(F=25.444,P=0.0001),且随分期增加异常代谢脑区范围逐渐增大。结论 肺腺癌患者脑代谢减低区涉及多个与精神情感有关的功能脑区,且其脑代谢改变与肿瘤分期具有一定相关性。
脱氧葡萄糖F18;腺癌,肺;正电子发射断层显像术;体层摄影术,X线计算机;脑葡萄糖代谢;统计参数地图
恶性肿瘤患者易伴发抑郁为临床共识,不同的肿瘤或同一肿瘤的不同阶段产生精神情感障碍的表现和程度亦常有不同。以往的PET脑显像显示,恶性肿瘤患者存在多个精神情感功能区的脑代谢异常,但对肿瘤患者进行细致的分型或分期来探讨其脑代谢异常发展规律的报道尚少。付畅等[1]对不同组织学类型肺癌的脑代谢改变做过初步研究,发现肺癌患者脑葡萄糖代谢改变与其组织学类型具有相关性。本研究在此基础上继续搜集病例,在限定组织学分型(肺腺癌)的基础上探讨肿瘤分期与脑葡萄糖代谢改变的关系。
1 资料与方法
1.1 临床资料
搜集2012年2月至2015年3月因发现肺部占位而在我院PET/CT中心行全身PET/CT检查并最终经病理学证实为原发肺腺癌患者120例。纳入标准:①所有患者均为首次发现病变,未经任何治疗(包括手术、放化疗、中药治疗),随访穿刺活检或手术病理证实为原发性肺腺癌;②经PET、CT或MRI检查排除脑内原发或转移性肿瘤及其他脑部疾患;③患者既往无心、肺、肝、胰、肾等脏器病变,无甲状腺功能亢进症、糖尿病等代谢性疾病,无精神疾病史及长期乙醇、药物滥用史;④无严重疼痛主诉,未服用阿片类镇痛药物。根据PET/CT表现,按照肺癌TNM分期标准把肺腺癌患者分为4组:Ⅰ期组28例(男性13例、女性15例),平均年龄为(58.32±12.48)岁;Ⅱ期组29例(男性14例、女性15例),平均年龄为(60.12±17.35)岁;Ⅲ期组31例(男性16例、女性15例),平均年龄为(62.24±13.56)岁;Ⅳ期组32例(男性17例、女性15例),平均年龄为(59.47±10.68)岁。选取50名在本院行全身PET/CT健康体检无阳性发现且无上述疾病病史者作为对照组,其中男性26名、女性24名,平均年龄为(57.24±16.53)岁。所有受检者均为右利手,患者组和对照组的性别构成及年龄分布经过统计学检验均无显著差异。PET/CT检查前空腹血糖均低于6.1mmol/L。
1.218F-FDGPET/CT扫描
采用美国 GE Discovery TM VCT PET/CT仪,18F-FDG由医用回旋加速器GEMinitrace和FDG(由北京派特公司提供)自动合成装置合成,放化纯度>95%。检查前,受试者禁食6 h以上,指尖采血验血糖;静脉给药,剂量为5.55MBq·kg-1。在安静、温度适中(20~26℃)环境下闭目休息40~50min后进行扫描,扫描时将头部固定于相同位置,采用先透射、后发射方式进行采集。首先进行体部二维采集,完成后再进行头部三维采集,采集时间共30min,其中头颅采集10min。脑部CT扫描参数:电压120 kV,电流240mA,层厚3.75mm。采集计数用迭代法重建分别获得横断面、矢状面和冠状面图像。
1.3 统计学处理
在Matalab 7.2平台上应用统计参数地图(statisticalparametricmapping,SPM8)先将PET图像转换为Analyze7图像数据格式,然后对图像进行位置校正及归一化处理,使之与Talairach脑图谱的空间坐标对应,最后用2倍半高宽(FWHM)即8mm对图像进行平滑,得到矩阵128×128×63、体素大小为2mm×2mm×2mm的目标图像,之后进行图像的统计学处理,分别将Ⅰ期、Ⅱ期、Ⅲ期、Ⅳ期组与对照组的脑18F-FDGPET图像进行体素对体素的两样本t检验,取统计阈值为P<0.05,并对其进行族错误率(FWE)校正,得到各自的脑代谢差异分布图。借助SPM8中的插件xjview 8软件对存在统计学差异的脑区进行立体定位分析和体素值定量分析,计算代谢异常脑区各自所占的体素值(voxel,1体素值等于2mm×2mm×2mm体积,是数位资料于三维空间分割上的最小单位,可用于评估所研究区域的大小),应用SPSS18.0统计分析软件对4组患者所涉及的代谢异常脑区的体素数进行单因素方差分析,多重比较采用LSD-t检验,P<0.05表示差异有统计学意义。
2 结果
Ⅰ期、Ⅱ期、Ⅲ期、Ⅳ期组肺腺癌患者脑PET图像与对照组比较,均显示有静息状态下的区域性脑代谢减低(图1~4)。
Ⅰ期组患者脑代谢减低见于左侧额上中回、右侧颞上中回、左侧颞中下回(图1),脑代谢减低区域共计681个体素数,具体分布区见表1。
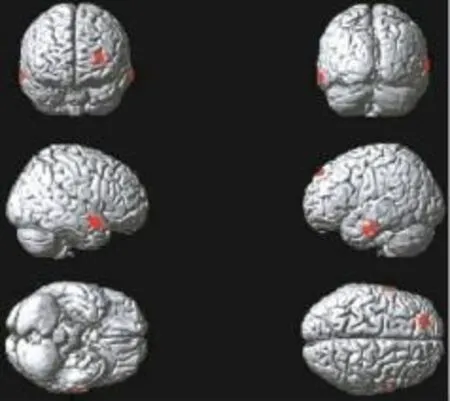
图1 肺腺癌Ⅰ期组大脑静息葡萄糖代谢减低区(红色区域)Fig.1 The cerebral regions of reduced brain glucose metabolism(red areas)in theⅠstagegroup patientswith lungadenocarcinoma
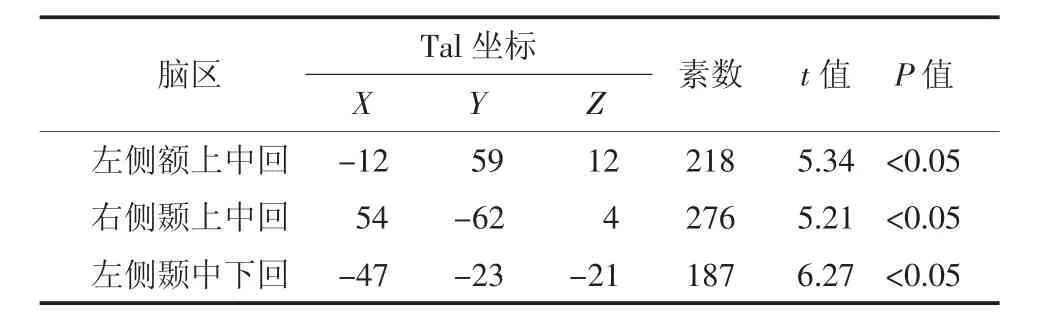
表1 肺腺癌Ⅰ期组大脑静息葡萄糖代谢减低区Table 1 Positions of the reduced glucose metabolism cerebral regions in theⅠstage group patients with lung adenocarcinoma
Ⅱ期组患者脑代谢减低见于左侧额上中回、右侧颞上中回、左侧颞中下回(图2),脑代谢减低区域共计1258个体素数,具体分布区见表2。
Ⅲ期组患者脑代谢减低见于左侧额上中回、右侧颞上中回、左侧颞中下回、右侧顶下小叶(图3),脑代谢减低区域共计1810个体素数,具体分布区见表3。
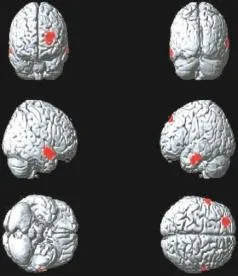
图2 肺腺癌Ⅱ期组大脑静息葡萄糖代谢减低区(红色区域)Fig.2 The cerebral regions of reduced brain glucose metabolism(red areas)in theⅡstagegroup patientswith lungadenocarcinoma
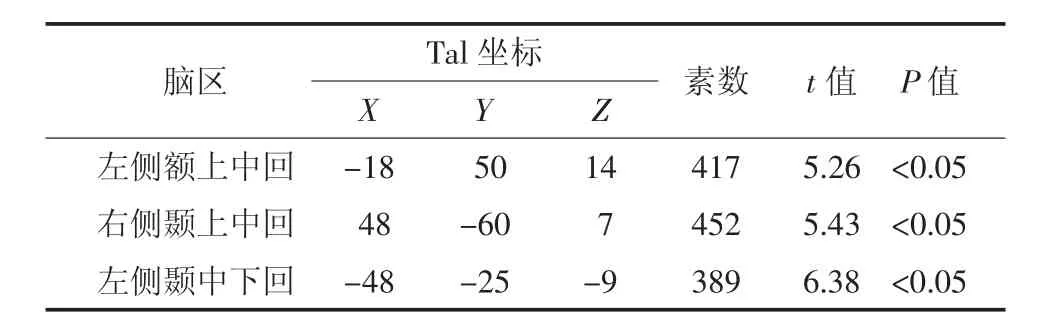
表2 肺腺癌Ⅱ期组大脑静息葡萄糖代谢减低区Table 2 Positions of the reduced glucose metabolism cerebral regions in theⅡstage group patients with lung adenocarcinoma
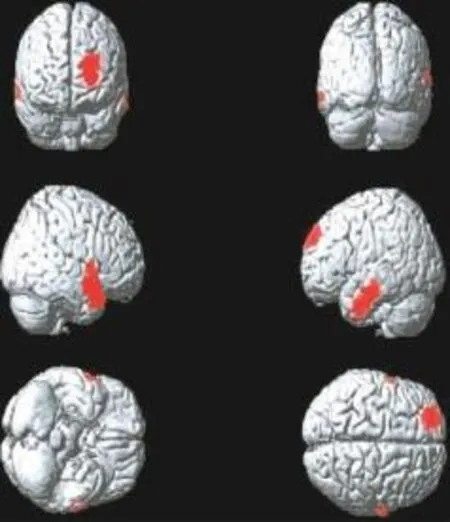
图3 肺腺癌Ⅲ期组大脑静息葡萄糖代谢减低区(红色区域)Fig.3 The cerebral regions of reduced brain glucose metabolism(red areas)in theⅢstagegroup patientswith lungadenocarcinoma
Ⅳ期组患者脑代谢减低见于左侧额上中回、右侧颞上中下回、左侧颞上中下回、右侧顶下小叶、左侧前扣带回及右侧岛回(图4),患者脑代谢减低区域共计2910个体素数,具体分布区见表4。
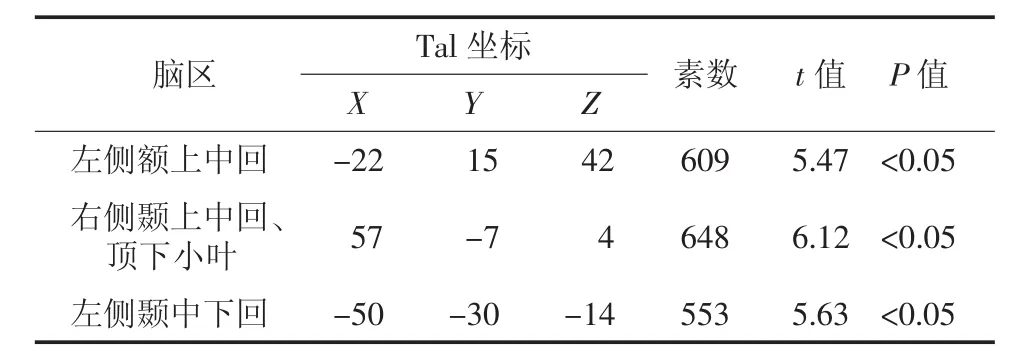
表3 肺腺癌Ⅲ期组大脑静息葡萄糖代谢减低区Table 3 Positions of the reduced glucose metabolism cerebral regions in theⅢstage group pa tients with lung adenocarcinoma
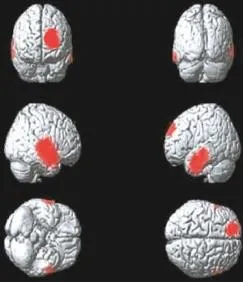
图4 肺腺癌Ⅳ期组大脑静息葡萄糖代谢减低区(红色区域)Fig.4 The cerebral regions of reduced brain glucose metabolism(red areas)in theⅣstagegroup patientswith lungadenocarcinoma
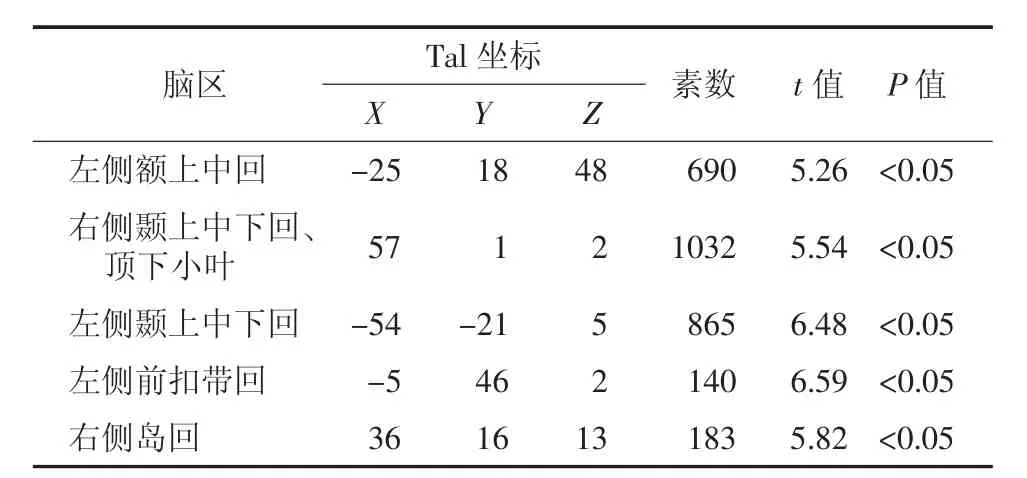
表4 肺腺癌Ⅳ期组大脑静息葡萄糖代谢减低区Table 4 Positions of the reduced glucose metabolism cerebral regions in theⅣstage group patients with lung adenocarcinoma
由上可见,肺腺癌患者随分期进展脑内异常代谢累及脑区逐渐增多,对4组脑代谢减低区域体素数进行单因素方差分析(ANOVA)显示,4组之间的差异具有统计学意义(F=25.444,P=0.0001),多重比较(LSD-t检验)结果显示,Ⅰ期组低代谢区面积分别小于Ⅱ期组(t=2.53,P=0.035)、Ⅲ期组(t= 4.96,P=0.001)和Ⅳ期组(t=8.37,P=0.0001),Ⅱ期组低代谢区面积分别小于Ⅲ期组(t=2.42,P= 0.042)和Ⅳ期组(t=5.84,P=0.0001),Ⅲ期组低代谢区面积小于Ⅳ期组(t=3.41,P=0.009)。
3 讨论
恶性肿瘤伴发抑郁的产生机制尚不完全清楚,一般认为与患者对癌症这一应激事件产生的心理反应与继发性情绪异常有关[2],但许多临床观察结果显示不同组织学类型或不同分期肿瘤患者伴发精神疾病的发病率和症状有较大差异,这说明除患者对疾病本身产生的应激心理反应因素外,肿瘤的分子生物学特点、恶性程度和分期等内在因素对脑组织产生的病理损害可能并不相同。PET脑显像可为抑郁障碍患者的脑部病变提供客观的分子影像学信息[3]。以往的部分研究显示,脑代谢异常与肿瘤部位、组织学类型和病程等具有相关性[1,4-5],但对于同一组织学类型的分期研究尚罕有报道。肺腺癌是我国发病率迅速增高的肺部恶性肿瘤,本研究选取未知晓病情且未接受任何治疗的初诊肺腺癌患者,对其不同分期的脑静息葡萄糖代谢改变进行分析,排除了患者心理因素、肿瘤组织学类型、病程、治疗等因素的影响,研究肿瘤分期对脑功能损伤的影响,有助于理解各期患者情绪障碍发作特点及对患者进行个性化预防和治疗,并为肿瘤患者抑郁症发病机制的研究提供帮助。
本研究显示,肺腺癌患者脑静息态葡萄糖代谢以区域性代谢减低为重要改变,受累脑区主要集中在左侧额叶和双侧颞叶,此与付畅等[1]对不同组织类型肺癌的研究中观察到的腺癌组脑代谢改变相似,所不同的是本研究的患者组除左侧额叶和双侧颞叶外,在Ⅲ、Ⅳ期患者中分别观察到了右侧顶下小叶及左侧前扣带回和右侧岛回的代谢降低,这可能与本组患者样本量增加、晚期受累脑区增多有关。统计学结果显示,患者组随肿瘤分期增加受累脑区部位逐渐增多、范围逐渐增大,4组体素数存在统计学差异(Ⅳ期>Ⅲ期>Ⅱ期>Ⅰ期),进一步证实了肿瘤分期与患者大脑代谢减低程度相关,这与以往临床研究所显示的肿瘤分期越晚,相应脑区功能损害越严重、患者负性情绪程度越严重的结果一致[6]。林盟菲等[5]对144例肺癌患者的分期研究也得到了相似结论,但该研究中各期患者未限定肺癌组织学分型。本研究样本量较大且排除了组织学分型可能造成的影响,其结果对肿瘤患者脑损伤的发生机制和发展规律研究具有更可靠价值。另外,相对于以往对恶性肿瘤患者的脑代谢研究,本研究观察到的异常代谢脑区部位相对较少,未见以往文献中报道的海马、基底节、杏仁核等区域的代谢异常[3,7-10],这也可能与本研究对象为单一分型且为初诊、病程相对较短等因素有关,而以往的不同部位或不同组织学类型肿瘤的混合研究缺乏特异性。
根据本研究和以往文献报道,肺癌患者的脑代谢损害以额叶和颞叶为核心受累区,随病程延长、恶性程度增加及分期增加而逐渐出现额颞叶以外的脑区受累,而所有这些受累脑区均与精神、情感、自我控制和认知等诸多功能密切相关。恶性肿瘤的脑代谢异常只是恶性肿瘤对脑组织损伤的结果,其通过何种机制影响脑代谢改变目前尚不完全清楚。在本研究中,造成肺腺癌随病变进展脑代谢异常范围扩大的原因可能是多方面的,包括肿瘤生物学特性[11]、病程、治疗及社会学和心理学因素等。本研究已对组织学类型、病程和治疗等进行了控制,但未控制其社会学和自身心理学因素,现笔者结合以往文献谨从肿瘤的分子生物学特性及其发展变化方面作一分析:①可能与肿瘤的内分泌功能有关。目前已知,中枢神经5-羟色胺和去甲肾上腺素减低与抑郁症发病密切相关。丘脑-垂体-肾上腺轴功能亢进是抑郁症的重要生物学改变,主要表现为下丘脑促肾上腺皮质激素释放素分泌增多,致垂体促肾上腺皮质激素分泌增多,进而刺激肾上腺分泌皮质醇增多,血浆皮质醇增高会抑制中枢5-羟色胺和去甲肾上腺素的合成和分泌[12]。目前已知小细胞肺癌是异位分泌垂体促肾上腺皮质激素最重要的恶性肿瘤,但非小细胞肺癌也存在垂体促肾上腺皮质激素分泌功能,且腺癌高于鳞癌,故推理其同样可以通过丘脑-垂体-肾上腺轴的调节机制影响脑功能,且有研究显示肺癌恶性程度越高内分泌功能可能越强[13],故随病程进展肿瘤的内分泌机制对脑组织产生的损伤效应可能越重。②可能与肿瘤细胞产生的炎症因子和免疫反应有关。近期的一些对肿瘤潜伏期和临床期的研究结果均显示,肿瘤浸润产生的免疫细胞和炎症因子在患者的诸多肿瘤相关症状中产生重要作用,包括疼痛、疲倦、睡眠和抑郁[14-15]。Reyes-Gibby等[16]研究显示,肺癌炎症基因IL-8与进展期肺癌患者的抑郁情绪、疲劳感和疼痛具有显著相关性,而在早期肺癌中,IL-10和IL-1A与肺癌患者的疲劳感相关性更强。以上分析显示,肿瘤的分子生物学特性会随病程发展而变化,在不同阶段产生明显差异,进而导致不同的损害结果。希望在以后的研究中能够通过肿瘤细胞因子的分子显像寻找更确切依据加以证实。
本研究显示,肺腺癌患者临床分期与脑静息葡萄糖代谢改变具有显著相关性,不同分期肺腺癌患者大脑静息葡萄糖代谢的改变均为涉及精神情感功能区的脑代谢降低,随分期增加脑代谢损伤程度加重。该结果可为恶性肿瘤伴发抑郁障碍的脑损伤改变特点及发生发展规律提供可靠依据。本研究为回顾性研究,主要不足为缺乏患者行为学改变和精神量表评分数据,无法将代谢改变与患者精神心理指标进行关联研究和分析,今后需要开展更多结合患者临床和心理评估的前瞻性研究,进一步分析脑代谢改变的临床意义,为临床对不同病期患者心理疾病的诊断、评估和干预提供更大帮助。
[1]付畅,史大鹏,徐俊玲,等.不同组织学类型肺癌患者大脑静息葡萄糖代谢改变研究[J].国际放射医学核医学杂志,2014,38(2):75-79.
[2]PirlWF,Traeger L,Greer JA,et al.Depression,survival,and epidermal growth factor receptor genotypes in patientswithmetastatic non-small cell lung cancer[J].Palliat Support Care,2013,11(3):223-229.
[3]苏亮,左传涛,管一晖,等.18F-FDGPET脑显像用于恶性肿瘤患者抑郁分析[J].中华核医学杂志,2005,25(3):159-161.
[4]倪建明,张追阳,黄钢.体部恶性肿瘤静息脑葡萄糖代谢改变与肿瘤类型的关系[J].临床放射学杂志,2012,31(5):627-631.
[5]林盟菲,黄钢,孙晓光,等.肺癌患者脑代谢改变与分期的关系[J].中国临床医学,2009,16(4):516-518.
[6]Lloyd-WilliamsM,Cobb M,O′connor C,et al.A pilot randomised controlled trial to reduce suffering and emotional distress in patientswith advanced cancer[J].JAffect Disord,2013,148(1):141-145.
[7]Fujimoto T,Takeuchi K,Matsumoto T,et al.Metabolic changes in thebrain ofpatientswith late-onsetmajor depression[J].Psychiatry Res,2008,164(1):48-57.
[8]Kim LS,HwangHS,Jon DI,etal.Dysfunction of theneuralnetworkassociated with sustained attention in cancer patientswith clinically significant depressive symptoms[J].Neurosci Lett,2008,447(1): 1-6.
[9]倪建明,刘建军,林盟菲,等.胰腺癌患者大脑静息葡萄糖代谢变化研究[J].中国医学计算机成像杂志,2009,15(6):561-565.
[10]InagakiM,Yoshikawa E,Kobayakawa M,et al.Regional cerebral glucosemetabolism in patientswith secondary depressive episodes after fatalpancreatic cancer diagnosis[J].JAffect Disord,2007,99(1/3):231-236.
[11]Miller AH,Ancoli-Israel S,Bower JE,et al.Neuroendocrine-immunemechanismsof behavioral comorbidities in patientswith cancer[J].JClin Oncol,2008,26(6):971-982.
[12]O′keane V,Frodl T,Dinan TG.A review of Atypical depression in relation to the course of depression and changes in HPA axis organization[J].Psychoneuroendocrinology,2012,37(10):1589-1599.
[13]Ionescu DN,Treaba D,GilksCB,etal.Nonsmall cell lung carcinomawith neuroendocrine differentiation--an entity of no clinical or prognostic significance[J].Am JSurg Pathol,2007,31(1):26-32.
[14]BremnesRM,Al-Shibli K,Donnem T,etal.The role of tumor-infiltrating immune cellsand chronic inflammation at the tumor site on cancer development,progression,and prognosis:emphasison nonsmallcell lung cancer[J].JThorac Oncol,2011,6(4):824-833.
[15]Rausch SM,Gonzalez BD,Clark MM,et al.SNPs in PTGS2 and LTA predict pain and quality of Life in long term lung cancer survivors[J].Lung Cancer,2012,77(1):217-223.
[16]Reyes-Gibby CC,Wang J,SpitzM,et al.Genetic variations in interleukin-8 and interleukin-10 are associated with pain,depressed mood,and fatigue in lung cancer patients[J].JPain Symptom Manage,2013,46(2):161-172.
Prelim inary study of metabolic changes in brain glucose of patients w ith lung adenocarcinoma
Sun Mengmeng,Fu Chang,Shi Dapeng,Xu Junling,Xuan Ang,Zhang Jie.Department of Nuclear Medicine,People′s Hospital of Zhengzhou University,Henan Provincial People′s Hospotial,Zhengzhou 450003,China
Xu Junling,Email:xjlhzq@163.com
Objective To investigate the metabolic changes in the resting brain glucose of patientswith different stages of lung adenocarcinoma butwithout brainmetastasis.M ethods A total of 120 patientswith primary untreated and histologically confirmed lung adenocarcinoma were divided into fourgroupsbased on TNM staging:stage I,28 cases;stage II,29 cases;stage III,31 cases;and stage IV,32 cases.The whole-body18F-FDG PET/CT images of the patients were retrospectively analyzed.The brain PET data of the four groupswere also examined individually and compared with those of the 50 healthy controls.Moreover,themetabolic changes in the brain glucose of the four groupswere compared.Results The brain PET images showed relative reductionsof the regional cerebral resting glucosemetabolism ofall the groups.In the stage Igroup,the reductionsweremainly observed in the left superior-middle frontal, rightsuperior-middle temporal,and leftmiddle-inferior temporalgyrus.The totalvoxel value for thisgroup was 681.The reductions in stage IIgroup were evident in the left superior-middle frontal,right superiormiddle temporal,and leftmiddle-inferior temporal gyrus.The total voxel value for the stage IIgroup was 1258.In the stage III group,reductions were evident in the left superior-middle frontal,right superiormiddle temporal,leftmiddle-inferior temporalgyrus,and right inferiorparietal lobule.The totalvoxelvalue for the stage IIIgroup was1810.In the stage IV group,reductionswere evident in the leftsuperior-middle frontal,right superior-middle-inferior temporal,left superior-middle-inferior temporal gyrus,right inferiorparietal lobule,leftanterior cingulated,and right insula gyrus.The total voxel value for the stage IV group was 2910.The four groups showed significantly different voxel values in their hypometabolic brain area(F=25.444,P=0.000 1),and the ranges expanded with tumor stage progression.Conclusions The reduced metabolic cerebral regions in lung adenocarcinoma patients involved a number of functional regions related tomood disorders.The ranges of themetabolic changes in the resting brain glucose in lung adenocarcinoma patientswere closely correlated to different tumorstages.
Fluorodeoxyglucose F18;Adenocarcinoma,lung;Positron-emission tomography;Tomography,X-ray computed;Brain glucosemetabolism;Statisticalparametricmapping
2015-03-20)
10.3760/cma.j.issn.1673-4114.2015.06.001
河南省卫生科技重点攻关计划项目(2011020142)
450003,郑州大学人民医院(河南省人民医院)核医学科
徐俊玲(Email:xjlhzq@163.com)
