18F-FDGPET/CT脑显像在新生儿缺血缺氧性脑病诊断及治疗后评估中的临床研究
2015-05-20邱琳陈跃黄占文张春银朱艳冯悦刘安敏
邱琳 陈跃 黄占文 张春银 朱艳 冯悦 刘安敏
·论著·
18F-FDGPET/CT脑显像在新生儿缺血缺氧性脑病诊断及治疗后评估中的临床研究
邱琳 陈跃 黄占文 张春银 朱艳 冯悦 刘安敏
目的 应用18F-FDGPET/CT脑显像测定健康新生儿及缺氧缺血性脑病(HIE)患儿的脑葡萄糖代谢水平,探讨18F-FDGPET/CT脑显像在HIE患儿严重程度分度及治疗后评估中的作用。方法 研究对象包括健康新生儿10名和不同程度HIE患儿34例,后者包括轻度16例、中度11例、重度7例,注射18F-FDG后显像测定患儿大脑双侧感觉运动皮质区、额叶、颞叶、枕叶、丘脑、基底节、脑干及小脑区脑组织SUVmax,观察治疗前不同程度HIE患儿各脑组织区葡萄糖代谢情况,并与健康新生儿脑代谢情况进行比较;HIE患儿治疗后再次行18F-FDGPET/CT脑显像,比较治疗前后HIE患儿各脑组织区SUVmax变化情况。结果 对于健康新生儿及不同程度HIE患儿,丘脑、基底节、脑干及小脑葡萄糖代谢水平均普遍较大脑皮层各叶脑组织高,而在大脑皮层脑组织中,感觉运动皮质区代谢较高。健康新生儿组各脑组织区葡萄糖代谢水平均显著高于HIE轻、中、重度组,不同程度HIE患儿脑葡萄糖代谢比较可见,HIE程度越重,患儿脑各部位葡萄糖代谢水平呈现逐步降低的趋势。不同程度HIE患儿治疗后各脑组织区葡萄糖代谢情况显著高于治疗前。结论18F-FDGPET/CT脑显像在HIE患儿严重程度分度及治疗后评估中具有较好的临床适用价值,为新生儿脑损伤提供了新的方法,其临床意义及对新生儿的辐射安全性值得进一步研究。
缺血缺氧,脑;氟脱氧葡萄糖F18;正电子发射断层显像术;最大标准化摄取值
新生儿缺血缺氧性脑病(hypoxic-ischemic encephalopathy,HIE)是指各种围产期窒息引起的部分或完全缺氧、脑血流减少或暂停而导致胎儿或新生儿脑损伤,是导致儿童精神运动发育迟缓的主要原因之一[1]。在婴儿早期大脑尚未出现明显形态结构的改变时,采用CT、MRI等传统影像学检查可能出现漏诊或误诊,对HIE的早期诊断、临床分度及治疗后评估作用有限。出生后新生儿大脑利用葡萄糖供能的能力增强[2],18F-FDG是临床上最常用的正电子放射性显像剂,作为葡萄糖类似物,能准确反映大脑组织的葡萄糖代谢水平。PET/CT是当代核医学领域最先进的检查设备之一,在中枢神经系统疾病的诊断方面具有独特的优势[3]。18F-FDG PET/CT脑显像在足月新生儿HIE中的应用目前国内外的研究甚少。本研究应用18F-FDG PET/CT脑显像对足月新生儿HIE临床分度及治疗反应进行评估,现将结果报道如下。
1 资料与方法
1.1 一般资料
选取2012年5月至2014年10月在我院核医学科行18F-FDG PET/CT脑显像的新生儿共76例。研究获得我院医学伦理委员会批准,经其父母或法定监护人知情同意后行18F-FDG PET/CT脑显像检查。HIE患儿入选标准:(1)胎龄≥37周的足月新生儿,满足由中华医学会儿科学会新生儿组制定的足月儿HIE诊断及分度标准;(2)初次18F-FDGPET/ CT脑显像在出生后2 d内进行,初次显像前患儿未接受抗惊厥药物治疗,在抗HIE治疗7 d后再次进行了18F-FDGPET/CT脑显像复查,治疗方法根据患儿的病情不同包括:3项维持疗法(①维持良好的通气、换气功能;②维持血糖在正常水平;③维持周身脏器足够的血液灌流,使心率和血压保持在正常范围)、3项对症治疗(①控制惊厥;②降低颅内压;③消除脑干症状)及亚低温疗法(降低脑温2℃~4℃)。最终有34例HIE足月新生儿入选,男18例、女16例,其中包括轻度16例、中度11例、重度7例。34例新生儿均排除电解质紊乱、颅内出血和产伤等原因引起的抽搐,以及宫内感染、遗传代谢性疾病和其他先天性疾病所引起的脑损伤。同期收集10名足月健康新生儿作为对照,其中男4名、女6名。所有受检新生儿的临床一般资料见表1,健康新生儿与HIE轻、中、重度患儿的性别构成、胎龄及初次显像时体重之间的差异无统计学意义。
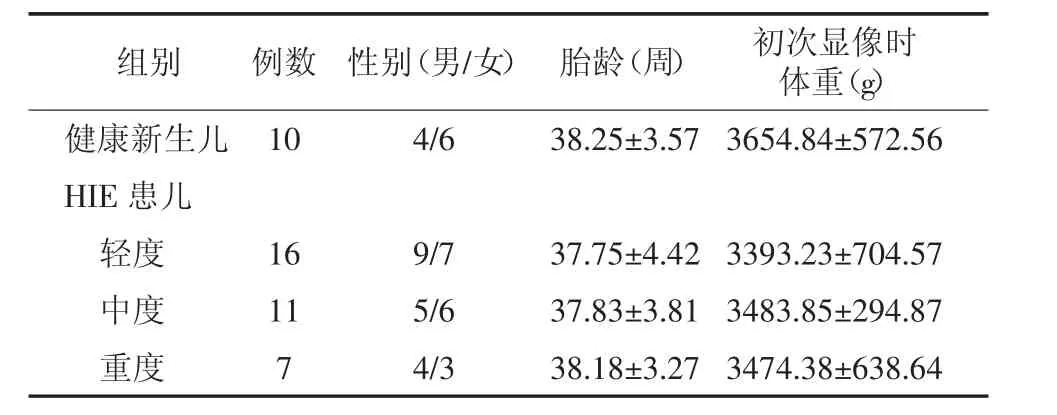
表1 健康新生儿及HIE患儿的一般临床资料Table 1 The general clinical data of healthy neonates and HIE infants
1.218F-FDGPET/CT脑显像方法
新生儿18F-FDG PET/CT脑显像采用荷兰Philips公司GEMINITF PET/CT仪。18F-FDG由德国Siemens公司的eclipse HP/RD回旋加速器及自动合成系统生产,合成效率>60%,放化纯度>95%。检查前患儿均停止喂奶1~2 h,其间可喂以白开水,静脉注射18F-FDG 3.7MBq/kg后约40min,在患儿入睡期间行PET/CT脑显像,如患儿未能自行入睡,按8mg/kg用量予以注射用苯巴比妥钠镇静、催眠。新生儿取仰卧位,用温暖毛毯包裹。先行低剂量头颅CT定位扫描,扫描范围从颅顶至颅底,扫描条件采用420mAs、120 kV。PET数据采用三维采集模式,矩阵128×128、Hann滤波、放大2.5倍、半高宽为5。机器自动利用CT数据对PET图像进行衰减校正,并进行图像重建和融合。
1.318F-FDGPET/CT图像分析。
由两位分别具有10年以上放射诊断工作经验和核医学工作经验的正高级职称医师共同对CT、PET及融合图像进行阅片。测定患儿大脑双侧感觉运动皮质区、额叶、颞叶、枕叶、丘脑、基底节、脑干及小脑区脑组织SUVmax。
1.4 统计学方法
采用MicrosoftExcel和SPSS13.0软件分析,计量资料以均数±标准差表示,数据保留小数点后两位有效数字,检验方法采用多组均数比较方差分析、多个构成比χ2检验,P<0.05表示差异具有统计学意义。
2 结果
2.1 健康新生儿及不同程度HIE患儿脑组织SUVmax比较
不论是健康新生儿还是HIE患儿,丘脑、基底节、脑干及小脑葡萄糖代谢水平均普遍较大脑皮层各叶脑组织高,而在大脑皮层脑组织中,感觉运动皮质区代谢较高。健康新生儿组各脑组织区葡萄糖代谢水平(图1)均显著高于HIE轻、中、重度组(表2)。不同病情的HIE患儿中,轻度HIE患儿除脑干之外(t=1.4893,P>0.05),感觉运动皮质区、额叶、颞叶、枕叶、基底节、丘脑及小脑的葡萄糖代谢水平均显著高于中度HIE患儿(t=3.9192、3.2603、5.2501、4.1415、2.4454、2.7070、2.4646,P均<0.05),轻度HIE患儿各脑部位区葡萄糖代谢水平均显著高于重度HIE患儿(t=5.5062、5.5654、5.9370、 4.8875、8.8283、6.7671、8.5161、4.7074,P均<0.05),中度HIE患儿与重度HIE患儿各脑部位区比较,除枕叶差异无统计学意义外(t=1.6876,P>0.05),其余部位均高于重度HIE患儿相应脑部位区(t=3.8967、5.5654、2.5880、3.8856、3.7778、6.9660、4.0630,P均<0.05)(表2)。健康新生儿及不同程度HIE患儿脑葡萄糖代谢比较结果可见,HIE程度越重,患儿脑各部位区葡萄糖代谢水平呈现逐步降低的趋势(图2~图4)。
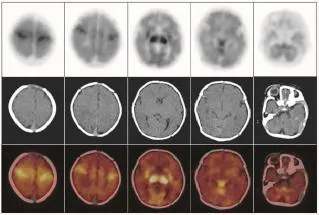
图1 健康新生儿18F-FDGPET/CT脑显像图Fig.118F-FDGPET/CTbrain imagingofhealthyneonate
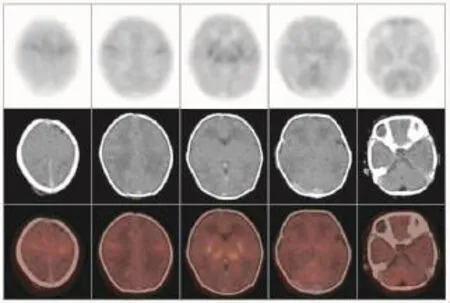
图2 轻度缺血缺氧性脑病患儿18F-FDGPET/CT脑显像图Fig.218F-FDG PET/CT brain imaging of infantwithmild hypoxicischemic encephalopathy
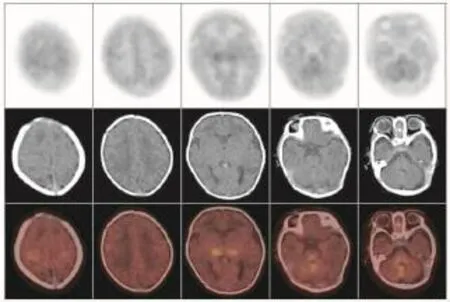
图3 中度缺血缺氧性脑病患儿18F-FDGPET/CT脑显像图Fig.318F-FDG PET/CT brain imaging of infant with moderate hypoxic-ischemic encephalopathy
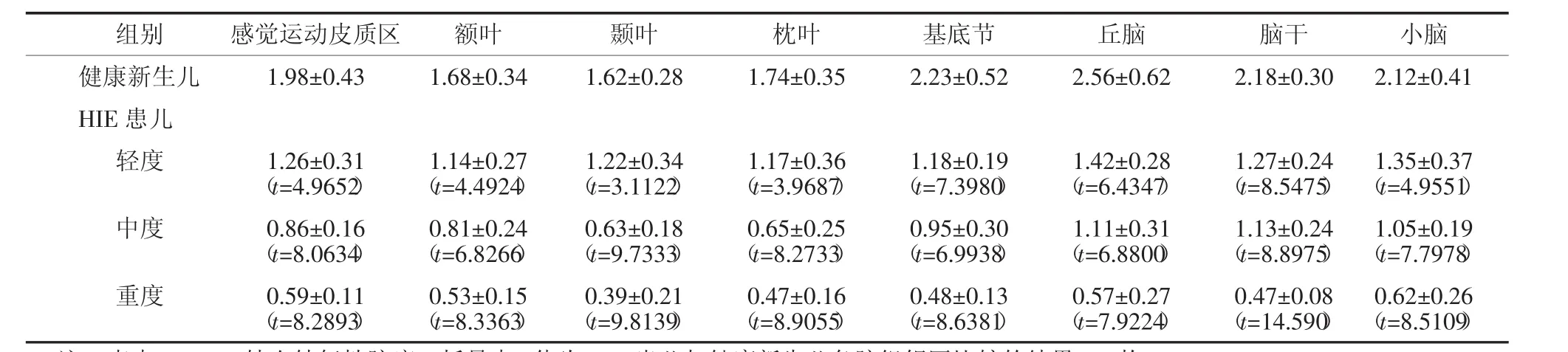
表2 健康新生儿及不同程度HIE患儿脑组织SUVmax比较Table2 The comparison of SUVmaxbetween healthy neonatesand infantswith differentdegreeofHIE
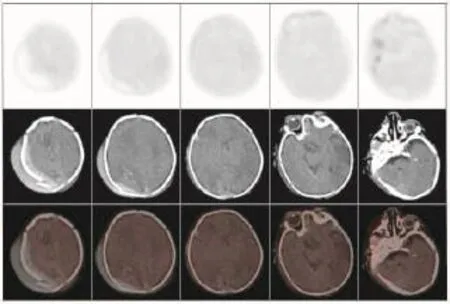
图4 重度缺血缺氧性脑病患儿18F-FDGPET/CT脑显像图Fig.418F-FDGPET/CTbrain imagingof infantwith severehypoxicischemic encephalopathy
2.2 HIE患儿治疗前后脑组织SUVmax变化情况比较
根据2.1节中健康新生儿组及不同程度HIE患儿组平均SUVmax情况,笔者自定义公式:x=(HIE患儿脑某部位SUVmax-健康新生儿相应部位平均SUVmax)/健康新生儿相应部位平均SUVmax×100%;并定义感觉运动皮质区、额叶、颞叶、枕叶、丘脑、基底节、脑干及小脑8个脑部位中,若有其中5个及以上部位的x≥10%为代谢高于正常,-10%≤x<10%为代谢基本正常,-30%≤x<-10%为代谢轻度降低,-50%≤x<-30%为代谢中度降低,x<-50%为代谢重度降低。分别测定34例HIE患儿治疗前后大脑各部位SUVmax,得到其治疗前后脑组织葡萄糖代谢情况例数及构成比分布(表3)。比较治疗前后HIE患儿脑葡萄糖代谢情况,结果显示治疗后脑葡萄糖代谢水平显著高于治疗前(χ2=32.30,P<0.05)。
3 讨论
18F-FDGPET/CT脑显像在成人中枢神经系统疾病如癫痫、脑肿瘤、脑血管病、阿尔兹海默病、帕金森病等方面已有较多应用,但在儿童中的报道不多,特别在新生儿期18F-FDG PET/CT脑显像的研究甚少。Chugani等[2,4-5]及Kinnala等[6]曾应用PET技术研究婴儿脑发育情况,指出婴儿脑葡萄糖代谢开始于分娩后,并且在一周岁前婴儿脑葡萄糖代谢水平将发生巨大变化。新生儿脑葡萄糖代谢率在初级感觉运动皮质区、丘脑、脑干、小脑蚓部、海马/杏仁核、基底节区代谢较高,而大脑皮层各叶脑组织代谢相对较低。该结论与本研究中健康新生儿脑葡萄糖代谢情况基本一致。Chugani等[7]进一步指出新生儿有别于成人的脑葡萄糖代谢高低区域与其固有的脑干反射及有限的视觉运动相关,而海马/杏仁核高代谢区暗示边缘结构功能上是有活性的,作者推测可能与婴儿的依恋情绪相关。新生儿脑葡萄糖代谢明显低于成年人,这可能与围产期皮质轴突形成较少及脑组织葡萄糖转运体还未成熟相关[8-9]。
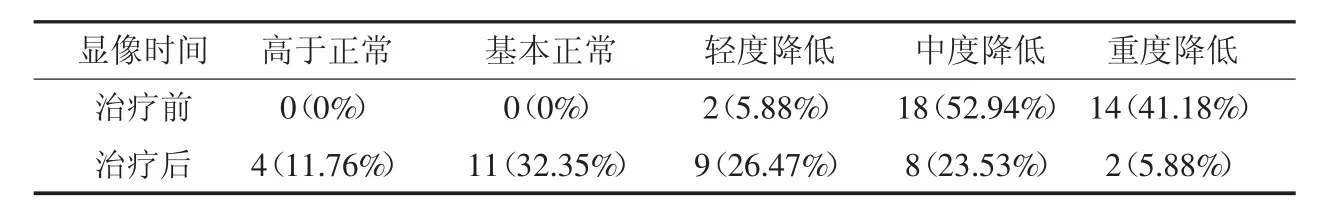
表3 缺血缺氧性脑病患儿治疗前后脑组织SUVmax变化情况[例(%)]Table 3 Comparison of SUVmaxbetween pre-and post-treatment hypoxicischemic encephalopathy infants[n(%)]
对于儿童脑葡萄糖代谢情况的测定,一些研究采用了定量指标葡萄糖代谢率[6,10-11]。SUVmax提供了一种半定量分析18F-FDG PET/CT脑显像测定脑葡萄糖代谢的方法,既往研究显示,SUVmax可较好地反映婴儿脑局部葡萄糖代谢率,并广泛应用于成人脑代谢测定[12]。因此在本研究中,对HIE严重程度分度及治疗后评估采用了半定量指标SUVmax。尽管在18F-FDG PET/CT脑显像时,SUVmax在一定程度上受到血中葡萄糖水平的影响,但在新生儿中,尤其当系列血液标本难以获得时,SUVmax是评估脑葡萄糖代谢水平的良好指标[13]。
本研究中,虽然不同程度HIE患儿个别脑组织区葡萄糖代谢差异无统计学意义,但HIE程度越重,患儿脑各部位区葡萄糖代谢水平呈现逐步降低的趋势,Shi等[12]对24例(包括早产儿及足月儿)不同程度HIE患儿行18F-FDGPET显像测定脑葡萄糖代谢也得出了相似结论。脑组织18F-FDG摄取降低,提示葡萄糖代谢水平下降,当达到临界值时,往往预示着不可逆转的脑损伤。Thorngren-Jerneck等[14]对20例HIE足月新生儿进行脑整体和局部糖代谢情况研究发现,脑组织的糖代谢与病情的轻重程度和短期预后存在显著相关性。HIE是导致儿童精神运动发育迟缓及造成新生儿神经功能障碍的主要原因之一,可引起如脑性瘫痪、智力低下、听视障碍等严重后遗症,因而,在新生儿期应用18F-FDG PET/CT脑显像显示脑组织低代谢区可能预测相应功能区的功能障碍,为早期诊断脑瘫等后遗症提供有益的帮助[15]。
新生儿发生缺氧缺血性脑损伤时,神经系统将可能会暂时性地增加葡萄糖转运来补充细胞能量,延迟细胞凋亡和坏死,葡萄糖转运蛋白(glucose transporter,GLUT)是哺乳动物转运葡萄糖的主要载体,脑缺氧缺血可增加脑内GLUT(GLUT1和GLUT3)的合成,以促进脑内葡萄糖的转运,适应无氧糖酵解增加的需要[16]。Uller等[17]进行的动物实验研究表明,脑内GLUT1基因缺陷所引起的葡萄糖转运异常将导致大鼠脑发育障碍。Hardy等[18]研究认为,在虽有脑血流的降低但脑组织葡萄糖代谢保持正常时,可能是进行早期治疗和干预的良好时机。
本研究比较了治疗前后HIE患儿脑葡萄糖代谢情况,发现治疗后绝大部分患儿脑组织葡萄糖代谢情况较治疗前有明显改善。但仍有8例患儿治疗后脑葡萄糖代谢呈中度降低,2例重度降低。钟敏泉等[19]对第一次PET或MRI/CT检查提示HIE的16例患儿于出生后4~6个月进行了第2次PET扫描,研究结果认为:第2次PET脑显像仍提示持续低葡萄糖代谢的患儿常伴随神经系统发育异常,尤其在小脑、基底节出现持续低葡萄糖代谢病灶的患儿,可能伴随严重的神经系统发育迟缓;另外,PET对新生儿缺氧缺血性脑病预后的评估,比MRI/CT具有更高的预测价值。
患儿行18F-FDG PET/CT检查会受到一定剂量的电离辐射,治疗后再次评估将进一步增加辐射剂量。辐射暴露可能会增加恶性肿瘤的发病率,对于婴幼儿辐射诱导的恶性肿瘤更容易发生。儿童接受一次全身18F-FDGPET/CT检查后,对辐射敏感的器官组织受到的辐射剂量分别为:甲状腺(0.1~0.6 Gy)、乳腺(0.3~0.7Gy)、骨髓(0.3Gy)、脑(1.5Gy)及皮肤(4.3~6.1Gy)[20-21]。出于辐射防护安全考虑,除非利大于弊,儿童不应该超过30mSv的剂量限制[22]。本研究所使用的18F-FDG剂量为3.7MBq/kg,远远低于在新生儿中所允许应用的安全剂量。尽管如此,由于新生儿器官发育还处于初期的特殊性,目前关于18F-FDGPET/CT在新生儿中的应用尚缺乏深入的研究。如何在确保安全的前提下,既能提高显像质量,又能降低患儿可能所受到的辐射剂量,仍然需要进一步的较大规模的临床研究提供更充分的证据[23]。
[1]金汉珍,黄德珉,官希吉,等.实用新生儿科[M].北京:人民卫生出版社,2003:762.
[2]ChuganiHT,PhelpsME.Maturational changes in cerebral function in infants determined by 18FDG positron emission tomography[J]. Science,1986,231(4740):840-843.
[3]GaillardWD,Weinstein S,Conry J,etal.Prognosisof children with partial epilepsy:MRIand serial18FDG-PET[J].Neurology,2007, 68(9):655-659.
[4]ChuganiHT,PhelpsME,Mazziotta JC.Positron emission tomography study of human brain functional development[J].Ann Neurol, 1987,22(4):487-497.
[5]Chugani HT.A critical period of brain development:studies of cerebral glucose utilization with PET[J].Prev Med,1998,27(2):184-188.
[6]Kinnala A,Suhonen-PolviH,Aärimaa T,etal.Cerebralmetabolic rate for glucose during the first six months of Life: an FDG positron emission tomography study[J].Arch Dis Child Fetal NeonatalEd,1996,74(3):F153-F157.
[7]ChuganiHT,Behen ME,Muzik O,etal.Local brain functional activity following early deprivation:a study of postinstitutionalized Romanian orphans[J].Neuroimage,2001,14(6):1290-1301.
[8]Greisen G.Effect of cerebral blood flow and cerebrovascular autoregulation on the distribution,type and extent of cerebral injury [J].Brain Pathol,1992,2(3):223-228.
[9]Vannucci RC.Cerebral carbohydrate and energy metabolism in perinatal hypoxic-ischemic brain damage[J].Brain Pathol,1992,2(3):229-234.
[10]Kinnala A,Nuutila P,Ruotsalainen U,et al.Cerebral metabolic rate for glucose after neonatal hypoglycaemia[J].Early Hum Dev, 1997,49(1):63-72.
[11]LuoM,LiQ,DongW,etal.Evaluation ofmild hypothermia therapy for neonatal hypoxic-ischaemic encephalopathy on brain energy metabolism using18F-fluorodeoxyglucose positron emission computed tomography[J].Exp TherMed,2014,8(4):1219-1224.
[12]ShiY,Zhao JN,Liu L,etal.Changesof positron emission tomography in newborn infants at different gestational ages,and neonatal hypoxic-ischemic encephalopathy[J].Pediatr Neurol,2012,46(2):116-123.
[13]Suhonen-Polvi H,Ruotsalainen U,Kinnala A,et al.FDG-PET in early infancy:simplified quantificationmethods tomeasure cerebralglucoseutilization[J].JNuclMed,1995,36(7):1249-1254.
[14]Thorngren-Jerneck K,Ohlsson T,Sandell A,etal.Cerebralglucose metabolism measured by positron emission tomography in term newborn infantswith hypoxic ischemic encephalopathy[J].Pediatr Res,2001,49(4):495-501.
[15]Azzarelli B,Caldemeyer KS,Phillips JP,et al.Hypoxic-ischemic encephalopathy in areas of primarymyelination:a neuroimaging and PETstudy[J].Pediatr Neurol,1996,14(2):108-116.
[16]Zovein A,Flowers-Ziegler J,Thamotharan S,etal.Postnatal hypoxic-ischemic brain injury altersmechanismsmediatingneuronalglucose transport[J].Am JPhysiol Regul Integr Comp Physiol,2004,286(2):R273-R282.
[17]Ullner PM,Di Nardo A,Goldman JE,et al.Murine glut-1 transporter haploinsufficiency: postnatal deceleration of brain weight and reactiveastrocytosis[J].NeurobiolDis,2009,36(1):60-69.
[18]Hardy OT,Hernandez-PampaloniM,Saffer JR,etal.Diagnosisand localization of focal congenital hyperinsulinism by18F-fluorodopa PET scan[J].JPediatr,2007,150(2):140-145.
[19]钟敏泉,钟劲,余宇晖,等.PET对新生儿缺氧缺血性脑病诊断和预后的临床评价[J].实用医学杂志,2010,26(3):398-400.
[20]Brenner D,Elliston C,Hall E,et al.Estimated risks of radiationinduced fatal cancer from pediatric CT[J].AJR Am JRoentgenol, 2001,176(2):289-296.
[21]Kleinerman RA.Cancer risks following diagnostic and therapeutic radiation exposure in children[J].Pediatr Radiol,2006,36(suppl 2):S121-125.
[22]Qiu L,Chen Y,Wu J.The role of18F-FDG PET and18F-FDG PET/ CT in the evaluation of pediatric Hodgkin′s lymphoma and non-Hodgkin′s lymphoma[J].Hell JNuclMed,2013,16(3):230-236.
[23]Brenner DJ,Hall EJ.Computed tomography—an increasing source of radiation exposure[J].N Engl JMed,2007,357(22):2277-2284.
Clinical research on using18F-FDG PET/CT brain imaging in the diagnosis of and therapeutic effectevaluation in neonatalhypoxic-ischem ic encephalopathy
Qiu Lin,Chen Yue,Huang Zhanwen,Zhang Chunyin,Zhu Yan,Feng Yue,Liu Anmin.Department of Nuclear Medicine,the First Affiliated Hospitalof Sichuan MedicalUniversity,Luzhou 646000,China
Chen Yue,Email:chenyue5523@126.com
Objective Cerebralglucosemetabolismwasmeasuredusing18F-FDGPET/CTinhealthy full-term neonates and infants exhibiting neonatal hypoxic-ischemic encephalopathy(HIE)to investigate the role of18F-FDG PET/CT brain imaging in HIE diagnosis and in therapeutic effect evaluation in HIE. M ethods Ten healthy full-term neonates and thirty-four term infants exhibiting different degrees of HIE(mild,n=16;moderate,n=11;and severe,n=7)were included in this research.The SUVmaxweremeasured to determine the cerebral glucose metabolism in various brain anatomical regions,including bilateral sensorimotor cortex,frontal lobe,temporal lobe,occipital lobe,thalamus,basal ganglia,brain stem,and cerebellum.The cerebral glucosemetabolism in healthy neonates and infants exhibiting different degrees of HIEwas compared.The glucosemetabolism pre-and post-treatmentwas also assessed using18F-FDG PET/CT and then compared with each other.Results Results indicated that uptake in themajor brain areas was significantly higher in healthy term newborns than in the neonatal HIE patients.Moreover, patientswith severer HIE demonstrated lower cerebralglucosemetabolism.Cerebralglucosemetabolism in patients exhibiting different degrees of HIE was also significantly higher after treatment than before treatment.Conclusions18F-FDG PET/CT brain imaging demonstrated a preferable clinical applicable value in the diagnosis and therapeutic effect evaluation of HIE patients and provides a new method fortreatment of neonatal brain injury.The clinical value and neonatal radiation safety of this technique warrants further investigation.
Hypoxia-ischemia,brain;Fluorodeoxyglucose F18;Positron-emission tomography; Maximum standardized uptake value
2015-05-08)
10.3760/cma.j.issn.1673-4114.2015.06.004
646000泸州,四川医科大学附属第一医院核医学科
陈跃(Email:chenyue5523@126.com)
