对一株超强马立克氏病毒株的检测和研究
2015-05-18龚振华林祥超郭光礼王丽萍于建敏李金平侯广宇
张 康,龚振华,林祥超,郭光礼,杜 翔,王丽萍,于建敏,李金平,侯广宇,单 虎
(1.中国动物卫生与流行病学中心,山东 青岛 266032;2.青岛农业大学,山东 青岛 266109;3.青岛易邦生物工程有限公司,山东 青岛 266032;4.临朐县畜牧局,山东 临朐 262600)
马立克氏病(Marek's Disease,MD)野毒株多年来一直在不断地变异[1]。1922年美国报道发生MD,鸡死亡率达20%,这一时期的马立克氏病毒表现为内脏器官出现淋巴肿瘤。50年代起,“急性MD毒株”对于养鸡业的危害已经比较严重,MD开始出现暴发,不仅仅是神经病变,内脏淋巴肿瘤性病变也较多,死亡率超过30%[2]。到了1970年开始推广使用疫苗,MD得到了控制[3]。1980年以来,MDV进一步变异。1990年,出现毒力更强的野毒株,可以突破经HVT-血清型Ⅱ型病毒株联苗和CVI988/Rispens疫苗免疫的鸡群,引起免疫鸡发生MD[4]。
近年来,我国MD野外流行毒株毒力不断增强,这一问题在临床方面表现得比较突出。我们对某鸡场送检的疑似感染马立克氏病的病死鸡进行了诊断,从病死鸡中分离到一株超强马立克氏病毒株,并进行了基因序列和致病性分析。
1 材料和方法
1.1 材料
1.1.1 试验动物。本研究所用的试验鸡由SPF鸡胚(济南斯帕法斯家禽有限公司)孵化。
1.1.2 马立克病毒参考毒株。超强马立克病毒株SD2012-1[5](GenBank中检索号KC511815)由本实验室保存。
1.1.3 疫苗。HVT疫苗,批号:兽药生字(2010)100082001。CVI988疫苗,批号:JC241。
1.1.4 试剂。DNA纯化试剂盒、Taq DNA 聚合酶、pGM-T、感受态细胞。
1.1.5 引物。采用文献[5]报道的扩增马立克氏病毒meq基因的引物,F:5'-CCGTCTAGAAGGCG GGCACGG TAC-3',R:5' -CGGAAGCTT AAACATGGGGCATAGACG-3'。分析野毒株SD2012-1与CVI988疫苗株的meq基因序列可知,SD2012-1片段扩增长度预期为1081bp。CVI988/Rispens疫苗株片段扩增长度预期为1255bp。
1.2 方法
1.2.1 病死鸡的处理。解剖某鸡场送检的病死鸡,记录每只病死鸡的病理变化特征,取其病变的肝、心、肺、脾和肾等,备用。
1.2.2 病毒的细胞分离。按实验室常规方法制备鸡胚成纤维细胞[6]。将病死鸡的羽髓剪碎,加入适量的PBS进行研磨,低速离心后取上清,用滤器除菌过滤,再将滤液加入单层的鸡胚成纤维细胞,37℃孵育30 min后,加入培养液,37℃培养。光学显微镜下观察细胞病变情况。
1.2.3 PCR检测。提取分离病毒的细胞培养物、CVI988/Rispens疫苗的DNA。按照参考文献[7],进行PCR反应,检测马立克氏病病毒的DNA。95℃ 5 min 预变性,94℃ 1min 变性、53℃ 1min退火,72℃ 2min延伸,35个循环,72℃ 10min完全延伸。用1%琼脂糖凝胶电泳检测PCR产物。
1.2.4 相关致瘤基因meq的测序。胶回收分离马立克氏病毒的meq基因扩增产物,进行克隆。meq基因扩增产物连接于pGM-T 载体,转化至感受态细胞中,筛选meq重组质粒。选取阳性重组质粒进行双脱氧法DNA测序。
1.2.5 病毒感染动物试验。将1日龄的SPF鸡共分7组,每组30只,分别是未免组、常规剂量HVT组、常规剂量CVI988组、常规剂量HVT+CVI988组、10×常规剂量HVT组、10×常规剂量CVI988 组和10×常规剂量HVT+CVI988组,各个试验组在鸡出壳后24h内用相应疫苗和剂量进行免疫。将细胞分离的该马立克氏病毒进行蚀斑纯化。用纯化的病毒腹部皮下接种7日龄试验鸡,剂量为2000PFU/羽份。至90d结束试验。试验期间记录攻毒后鸡的临床发病情况。
2 结果
2.1 剖检死鸡的结果
病死鸡病理症状明显,与典型的MD病症状相同。肝脏表面有散在的白色肿瘤结节,脾脏破裂并有纤维素性渗出,腺胃乳头出血和肠道出血,见图1。
2.2 病毒的细胞分离结果
鸡羽髓的组织提取物在鸡胚成纤维细胞上培养5d后开始出现局部性的病变,表现为轻微细胞脱落和细胞聚集。继续传至3代后,病毒感染后第3d开始形成蚀斑,表现为细胞堆积,中心区域融合成网状结构并伴有细胞脱落如图2(B),未接种病毒的健康细胞未出现病变如图2(A)。
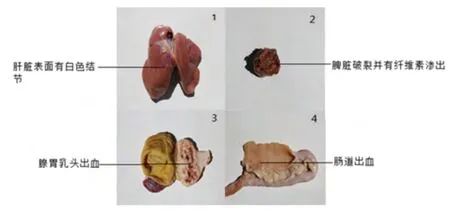
图1 病死鸡的内脏器官出现的病变
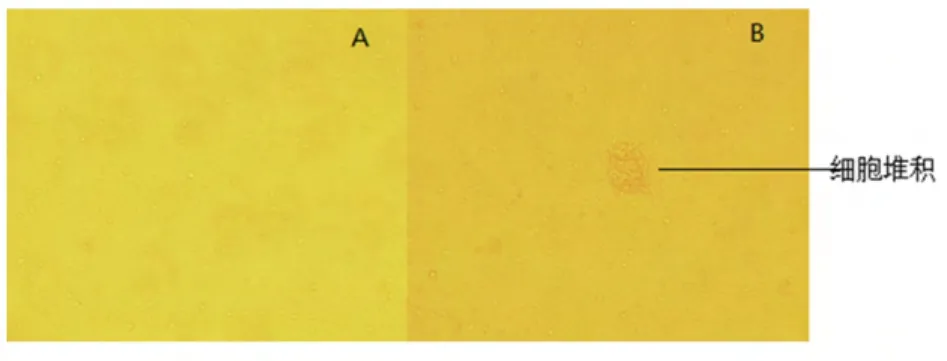
图2 分离病毒在CEF产生的病变(PI 72h)
2.3 PCR检测结果
SD2012-1株扩增出特异性目的条带,与预期长度大小1081bp相符。CVI988疫苗株扩增的特异性目的条带,与预期长度大小1255bp相符。阴性对照没有扩增出任何条带如图3。该分离病毒株扩增的特异性目的条带与SD2012-1大小一致,其大小为1081bp见图3。
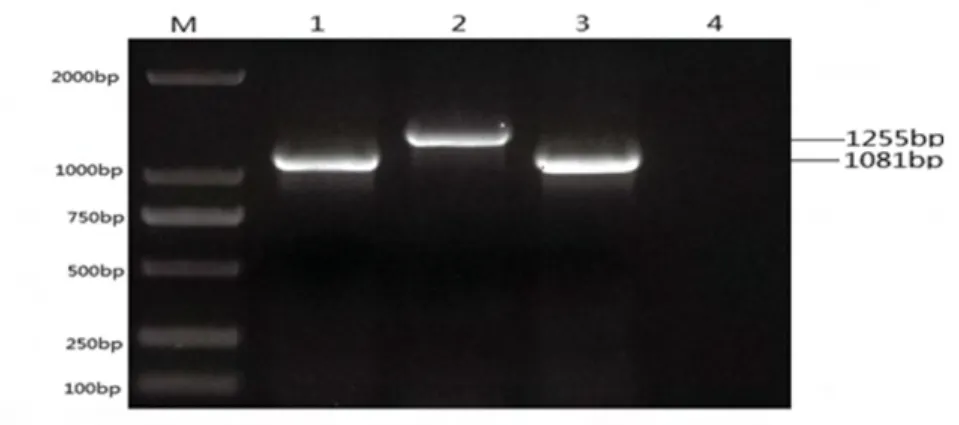
图3 PCR扩增产物电泳图
2.4 病毒株的meq基因的测定结果
该分离株(ZC2014)的meq基因的ORF大小为1020bp。与CVI988、SD2012-1的meq基因(GenBank中检索号为DQ530348 、KC511815)同源性都为99%。
2.5 病毒感染试验鸡的结果
未免组、常规剂量HVT组和10×常规剂量HVT组的发病率分别为80.0%、73.0%和76.6%。常规剂量CVI988组和10×常规剂量CVI988组的发病率分别为30.0%和30.0%。常规剂量HVT+CVI988组和10×常规剂量HVT+CVI988组的发病率分别为26.6%和26.7%。
3 讨论
MDV分为3个血清型:血清型Ⅰ型、血清型Ⅱ型和血清型Ⅲ型[8]。其中只有MDV-1拥有meq基因[9]。由于目前认为meq具有转录激活因子和调控病毒DNA复制的功能,MDV-1的强弱毒株在致瘤性上的不同与其meq基因有关[10]。而且近年来发现MDV-1的meq基因的长度并不相同。CVI988的meq全长392个氨基酸,有些马立克超强毒株的meq在194~252位点缺少58个氨基酸,通过在缺失端的两端设计引物,进行PCR反应,可以将野毒株与CVI988疫苗株进行区分。本研究中我们PCR扩增SD2012和ZC2015扩增大小为1081bp,而该PCR扩增CVI988DNA长度为1255bp,临床上采用该PCR方法可以将野毒株与疫苗株进行区分。
其他研究又表明,MDV的meq基因在575~577位置表现出变异。疫苗毒株V1988/Rispens 和814均缺失了meq 基因ORF中的第575~577位的3 个碱基(CAC),而属强毒株的GA株(vMDV)、648A(vv+MDV)、中国的2个野毒株N株和G2株在这个位点则完全保持不变。韦平等人又对4个广西MD阳性病例的肿瘤病料中获得的MDV 基因组DNA 进行meq 基因扩增、测序时,也获得了与强毒株相同的结果[10]。序列分析发现,我们的分离株ZC2014比疫苗株CVI988/Rispens的meq序列在第575~577位多插入3个碱基(CAC),与SD2012-1相同。
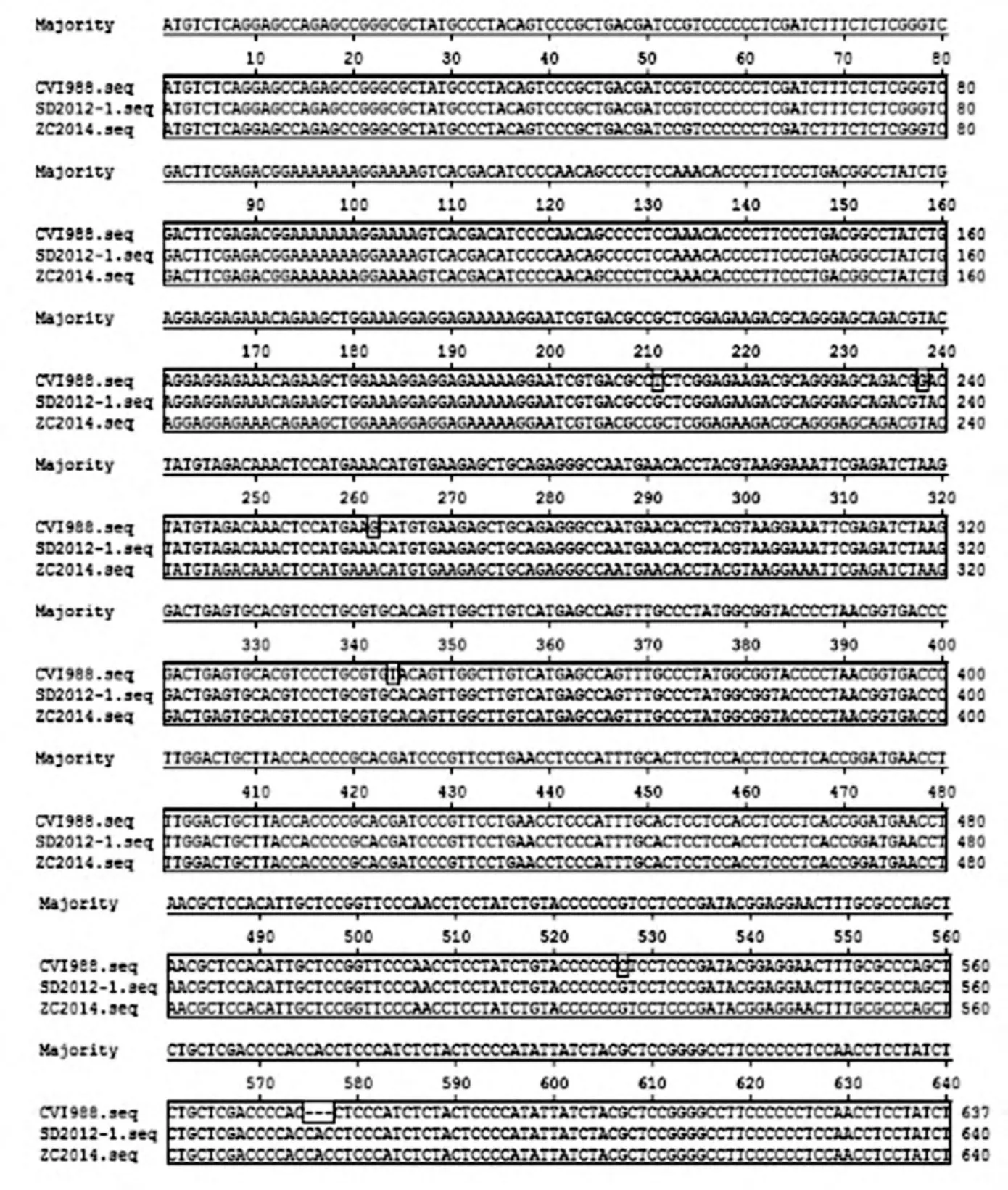
图4 各MDV-1毒株meq基因核苷酸序列对比

图5 各MDV-1毒株meq基因的氨基酸序列比较
用病毒感染试验鸡,未免组的、常规剂量HVT组和10×常规剂量HVT组的发病率分别为80.0%、73.3%和76.6%,HVT不能对该毒株产生免疫保护。常规剂量CVI988组和10×常规剂量CVI988组的发病率分别为30.0%和30.0%,常规剂量HVT+CVI988组和10×常规剂量HVT+CVI988组的发病率分别为26.6%和26.7%,CVI988疫 苗 和HVT+CVI988联苗可以为攻毒鸡群提供部分免疫保护。HVT+CVI988联苗免疫效果比单独免疫CVI988疫苗稍好。从本实验研究结果来看,建议鸡场按常规剂量将HVT疫苗和CVI988疫苗联合使用,对鸡群进行免疫。
本项目通过细胞分离病毒、meq致瘤基因的序列分析和攻毒免疫保护试验确证分离到一株超强马立克氏病毒株。野外MDV毒力变异不断增强,临床防控马立克氏病则更困难,所以当前的MD防治应依靠疫苗、建立快速检测方法及改善鸡的饲养环境等。
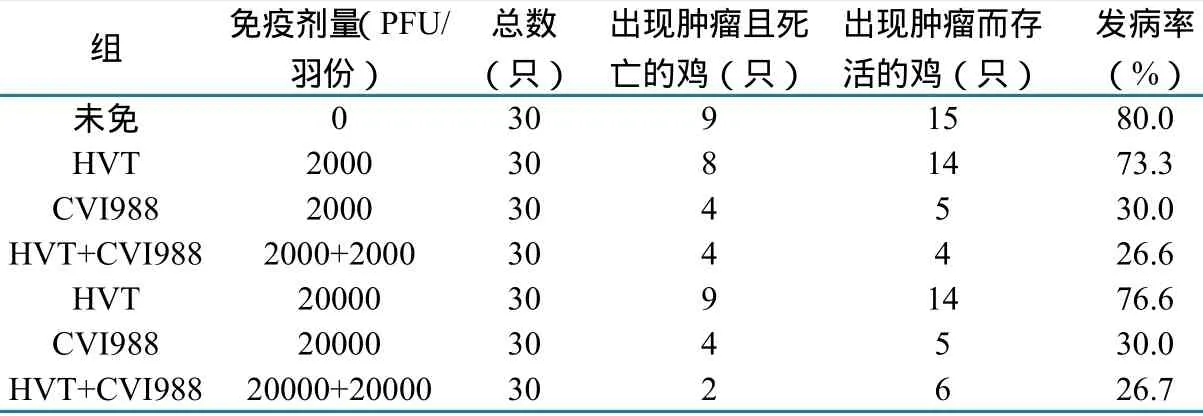
表1 各组鸡在试验期间的死亡数、存活鸡肿瘤发生数和发病率等情况统计
[1]Bulow V V,Biggs P M.Differentiation between strains of Marek's disease virus and turkey herpesvirus by immunofluorescence assays[J].Avian Pathol 1975,4:133-146.
[2]Witter R L.Characteristics of MDV isolated from vaccinated commercial chicken flocks:association of viral pathotype with lymphoma frequency[J].Avian Dis,1983,27:113-132.
[3]Witter R L,Sharma J M,Fadly A M,et al.Pathogenicity of variant Marek’s disease virus isolants in vaccinated and unvaccinated chickens [J].Avian Dis,1980,24:210-232.
[4]Witter R L.Characteristics of Marek's disease viruses isolated from vaccinated commercial chicken flocks:association of viral pathotype with lymphoma frequency[J].Avian Dis 1983,27:113 -132.
[5]Gong Z,Zhang L,Wang J,et al.Isolation and analysis of a very virulent Marek’s disease virus strain in China[J].Virol J,2013,5(10):155.
[6]殷震,刘景华.动物病毒学[M].2 版.北京:科学出版社,1997,204-246;1051-1066.
[7]Tian M,Zhao Y,Lin Y,et al.Comparative analysis of oncogenic genes revealed unique evolutionary features of field Marek’s disease virus prevalent in recent years in China[J].Virol J 2011,8:121–131.[8]Saif Y M.禽病学[M].苏敬良,译.11版.北京:中国农业出版社,2005,447-518.
[9]Calnek B W,Witter R L.Neoplastic diseases/Marek’s disease.In :Diseases of poultry(10th ed .),B.W.Calnek,et al.1997,Iowa State University Press ,Ames,Iowa,USA,367 -413 .
[10]韦平,崔治中,Lee L F.马立克氏病病毒不同致病型meq基因的比较研究[J].中国预防兽医学报,2002,24(2):88-92.
